16. 碘是人体必需的微量元素,也可用于工业、医药等领域。大量的碘富集于海藻灰〔主要成分是

)中,因此从海藻灰中提取碘,可有效利用海洋资源。
(1)某兴趣小组以海藻灰为原料进行

的制备实验。具体步骤如下:将海藻灰加热浸泡后,得到了

溶液,将适量

固体溶于

溶液,再将

饱和溶液滴入上述溶液中,生成白色

沉淀,该反应的离子方程式为
______。
(2)待

沉淀完全后,过滤,将沉淀物置于小烧杯中,在搅拌下逐滴加入适量浓

,观察到
______(颜色)气体放出,
______(颜色)晶体析出。出于安全和环保考虑,该实验操作需在
______(条件)下进行。该反应的化学方程式为
______。
(3)用倾析法弃去上清液,固体物质用少量水洗涤后得到粗

,进一步精制时,选择必需的仪器搭建装置,并按次序排列:
______(夹持装置略)。
(4)将精制得到的

配成浓度为

的标准溶液,用来测定某样品中维生素C(相对分子质量为M的含量。具体操作如下:准确称量ag样品,溶于新煮沸过并冷却至室温的蒸馏水中,煮沸蒸馏水的目的是
______。用

容量瓶定容,使用
______(仪器)量取

样品溶液于锥形瓶中,再加入

1∶1醋酸溶液和适量的
______指示剂,立即用

标准溶液滴定,溶液显稳定的
______(颜色)即为滴定终点,消耗

标准溶液
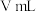
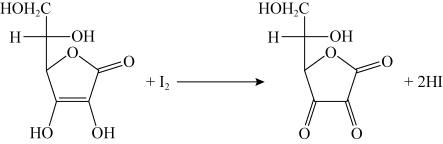
,则样品中维生素C的质量分数是
______(写出表达式)。已知滴定反应方程式: