18. 环氧乙烷是高效消毒剂,可用于口罩等医用品消毒,工业常用乙烯氧化法生产。
主反应:2CH
2=CH
2(g) + O
2(g)

2
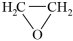
(g) △
H1=-209.8 kJ/mol
副反应:CH
2=CH
2(g) + 3O
2(g)=2CO
2(g)+ 2H
2O(g) △
H2=-1323.0 kJ/mol
回答下列问题:
(1) C
2H
4的燃烧热△
H=-1411.0 kJ/mol,则环氧乙烷(g)的燃烧热△H=
_______。
(2)以下既能加快反应速率又能提高环氧乙烷产率的方法有的
_______ (填标号)。
A.降低温度
B.向容器中充入N
2使压强增大
C.采用改性的催化剂
D.用空气替代氧气
(3)已知:
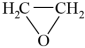
(g)+HCl(g)

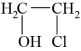
(l),合成过程中的温度与氯乙醇的平衡产率关系如图a,30℃下原料投料比与氯乙醇的平衡产率关系如图b。
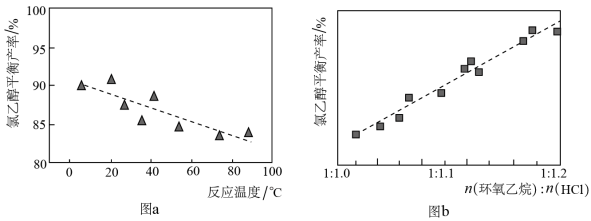
反应随温度升高平衡产率降低的可能原因为
_______;其它条件不变时,降低环氧乙烷与HCl的投料比,环氧乙烷的平衡转化率将
_______(填“增大”“减小”或“不变”)。
(4)环氧乙烷经水解可得到乙二醇。乙二醇 易溶于水的原因为
_______;写出乙二醇—氧气碱性燃料电池的负极电极反应式:
_______。