19. 工业上以钒炉渣(主要含V
2O
3还有少量SiO
2、P
2O
5等杂质)为原料可以制备氧钒碱式碳酸铵晶体[(NH
4)
a(VO)
b(CO
3)
c(OH)
d•nH
2O),其中V为+4价。其生产工艺流程如下:
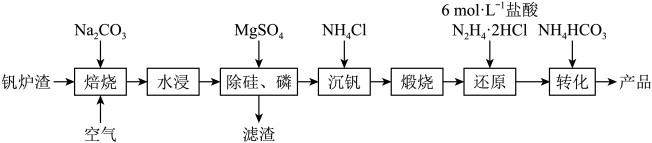
(1)“沉钒”得到偏钒酸铵(NH
4VO
3),若滤液中
c(

)=0.lmol•L
-1,为使钒元素的沉降率达到98%,至少应调节
c(

)为
_______mol•L
-1。已知:
Ksp(NH
4VO
3)=1.6×10
-3。
(2)“还原”V
2O
5过程中,生成VOCl
2和一种无色无污染的气体,该反应的化学方程为式
_________。用浓盐酸与V
2O
5反应也可以制得VOCl
2,该方法的缺点是
________。
(3)为测定氧钒碱式碳酸铵样品的组成,进行下列实验:
①准确称量1.0650g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加水稀释至100.00mL得到溶液A。将溶解过程产生的气体全部通入足量澄清石灰水,生成白色沉淀0.4000g。
②准确量取20.00mL溶液A,加足量的NaOH溶液并充分加热,生成NH
322.4mL(标准状况)。
③准确量取20.00mL溶液A,加入0.l000mol•L
-1KMnO
4溶液将VO
2+恰好氧化成

,然后用0.l000mol•L
-1(NH
4)
2Fe(SO
4)
2标准溶液滴定至终点,消耗标准溶液的体积为12.00mL。已知滴定反应为:

+Fe
2++2H
+=VO
2++Fe
3++H
2O。
通过计算确定该氧钒碱式碳酸铵晶体样品的化学式(写出计算过程)
__________。