VA族元素及其化合物在生产、生活中用途广泛。
(1)① 常用于制造火柴,P和S的第一电离能较大的是
常用于制造火柴,P和S的第一电离能较大的是______ 。
② 俗称雄黄,其中基态
俗称雄黄,其中基态 原子的核外电子排布式为
原子的核外电子排布式为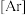
______ ,有______ 个未成对电子。
③P、S、 电负性由大到小的顺序是
电负性由大到小的顺序是______ 。
(2) 、
、 、
、 中沸点最高的是
中沸点最高的是______ ,其主要原因是______ 。
(3)①白磷在氯气中燃烧可以得到 和
和 ,其中气态
,其中气态 分子的立体构型为
分子的立体构型为______ 。
②研究发现固态PCl5和PBr5均为离子晶体,但其结构分别为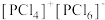 和
和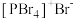 ,分析PCl5和PBr5结构存在差异的原因是
,分析PCl5和PBr5结构存在差异的原因是______ 。
(4)锑酸亚铁晶胞如图所示,其晶胞参数分别为anm、bnm、cnm, ,则:
,则:
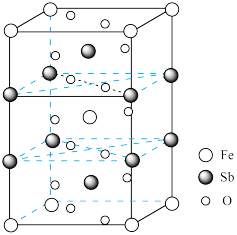
①锑酸亚铁的化学式为______ 。
②晶体的密度为______  (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)①
 常用于制造火柴,P和S的第一电离能较大的是
常用于制造火柴,P和S的第一电离能较大的是②
 俗称雄黄,其中基态
俗称雄黄,其中基态 原子的核外电子排布式为
原子的核外电子排布式为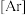
③P、S、
 电负性由大到小的顺序是
电负性由大到小的顺序是(2)
 、
、 、
、 中沸点最高的是
中沸点最高的是(3)①白磷在氯气中燃烧可以得到
 和
和 ,其中气态
,其中气态 分子的立体构型为
分子的立体构型为②研究发现固态PCl5和PBr5均为离子晶体,但其结构分别为
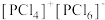 和
和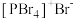 ,分析PCl5和PBr5结构存在差异的原因是
,分析PCl5和PBr5结构存在差异的原因是(4)锑酸亚铁晶胞如图所示,其晶胞参数分别为anm、bnm、cnm,
 ,则:
,则:
①锑酸亚铁的化学式为
②晶体的密度为
 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
2021·湖南·模拟预测 查看更多[5]
(已下线)02 物质结构与性质综合题型集训(2) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)专题19 物质结构与性质-2022年高考化学二轮复习重点专题常考点突破练(已下线)第4周 晚练题-备战2022年高考化学周测与晚练(新高考专用)广西名校大联考2022届高三上学期第一次大联考(入学摸底考试)化学试题湖南省2021年普通高中学业水平选择考适应性测试化学试题
更新时间:2021-01-25 13:37:00
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】我国古代在西汉《淮南子·万毕术》一书中有湿法炼铜的文字记载: “曾青得铁则化铜”铜金属被广泛地应用于电力、电子、交通、轻工、新兴产业等领域。
回答下列问题:
(1) 铁原子的外围电子排布图为___________ 。
(2)向FeCl3溶液加入KSCN溶液形成K3[Fe(SCN)6]血红色溶液。
①写出与SCN-离子互为等电子体的合理分子或离子:_____________ 。(两个)
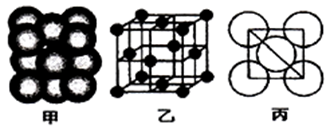
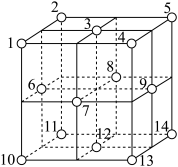
②铁原子的堆积方式如右图(甲)所示,其晶胞特征如右图(乙)所示,原子之间相互位置关系的平面图如右图(丙)所示; 已知铁原子半径rpm,铁晶胞空间利用率为:____________ 。(用字母π表示)
(3)含有Fe2+的水溶液可以用K3[Fe(CN)6]于实验室的定性检验,检验Fe2+离子的离子方程式为:___________ 。
(4)一水合硫酸四氨合铜[Cu(NH3)4]SO4·H2O 为蓝色正交晶体,常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。
①[Cu(NH3)4]SO4·H2O 中非金属元素H、N、O的电负性由大到小的顺序为:___________ 。(用元素符号作答)
②[Cu(NH3)4]SO4·H2O 晶体中存在的化学键有___________ (填编号)
a金属键 b离子键 c氢键 d 配位键 e极性键 f非极性键
③NH3分子的VSEPR模型为:___________ ;SO42-中S为___________ 杂化。
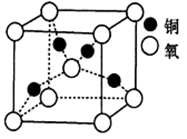
(5)铜的某种氧化物晶胞结构如图所示,若该晶胞的边长为acm,则该氧化物的密度为______ g/cm3(设阿伏伽德罗常数的值为NA)。
回答下列问题:
(1) 铁原子的外围电子排布图为
(2)向FeCl3溶液加入KSCN溶液形成K3[Fe(SCN)6]血红色溶液。
①写出与SCN-离子互为等电子体的合理分子或离子:
②铁原子的堆积方式如右图(甲)所示,其晶胞特征如右图(乙)所示,原子之间相互位置关系的平面图如右图(丙)所示; 已知铁原子半径rpm,铁晶胞空间利用率为:

(3)含有Fe2+的水溶液可以用K3[Fe(CN)6]于实验室的定性检验,检验Fe2+离子的离子方程式为:
(4)一水合硫酸四氨合铜[Cu(NH3)4]SO4·H2O 为蓝色正交晶体,常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。
①[Cu(NH3)4]SO4·H2O 中非金属元素H、N、O的电负性由大到小的顺序为:
②[Cu(NH3)4]SO4·H2O 晶体中存在的化学键有
a金属键 b离子键 c氢键 d 配位键 e极性键 f非极性键
③NH3分子的VSEPR模型为:
(5)铜的某种氧化物晶胞结构如图所示,若该晶胞的边长为acm,则该氧化物的密度为

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】富勒烯(C60)是一类完全由碳组成的中空分子,在催化、光电等很多领域都有重要作用。
I. C60以其完美的球烯受到科学家重视,其结构如图所示。60个碳原子是等同的,均为近似sp2杂化,但却有两种不同类型的碳碳键。其中一种为138pm;另一种为145pm。
(1)C60在水中溶解度__________ C60在甲苯中溶解度(填“>”、“<”或“≈”)
(2)石墨、C60互为同素异形体,但相同条件下,石墨的熔点比C60高得多,原因是_________________ 。
II.常态下是为紫色固体,不导电,但给富勒烯掺杂金属后(用金属原子把富勒烯分子连起来或者把金属原子放进富勒烯笼子里),其在一定条件下甚至可以成为超导体。
(3)C60晶体结构中存在四面体空隙(如图中1、3、6、7围成的空隙)和八面体空隙(如图中3、6、7、8、9、12围成的空隙),所有空隙均填充一个金属M原子,可获得某条件下的超导材料,则该超导材料中,平均一个C60晶胞需掺杂_________ 个M原子。
(4)C60、石墨、金刚石互为同素异形体
①石墨晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为_________ 个。已知石墨的密度为 ,C-C键键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距d为
,C-C键键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距d为__________ cm。

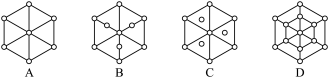
②金刚石晶胞如图3所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图__________ (从A~D图中选填)。
I. C60以其完美的球烯受到科学家重视,其结构如图所示。60个碳原子是等同的,均为近似sp2杂化,但却有两种不同类型的碳碳键。其中一种为138pm;另一种为145pm。
(1)C60在水中溶解度
(2)石墨、C60互为同素异形体,但相同条件下,石墨的熔点比C60高得多,原因是
II.常态下是为紫色固体,不导电,但给富勒烯掺杂金属后(用金属原子把富勒烯分子连起来或者把金属原子放进富勒烯笼子里),其在一定条件下甚至可以成为超导体。
(3)C60晶体结构中存在四面体空隙(如图中1、3、6、7围成的空隙)和八面体空隙(如图中3、6、7、8、9、12围成的空隙),所有空隙均填充一个金属M原子,可获得某条件下的超导材料,则该超导材料中,平均一个C60晶胞需掺杂

(4)C60、石墨、金刚石互为同素异形体
①石墨晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为
 ,C-C键键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距d为
,C-C键键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距d为
②金刚石晶胞如图3所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】氟是特种塑料、橡胶和冷冻剂(氟氯烷)中的关键元素。回答下列问题:
(1)基态F原子核外电子的空间运动状态有_______ 种。
(2)同周期元素N、O、F的第一电离能由大到小的顺序为_______ ,N、O、F 常见的氢化物NH3、H2O、HF的稳定性由强到弱的顺序为_______ 。
(3)氟气与水的反应复杂,主要生成HF和O2,副反应生成少量的H2O2、OF2等。OF2分子的空间构型为_______ ;HF与水能以任意比例互溶,原因是_______ 。 在一定浓度的氢氟酸溶液中,部分溶质以二分子缔合(HF)2形式存在,使HF分子缔合的作用力是_______
(4)同主族元素Cl、Br、I的单质均可与水反应生成次卤酸,则ClO-中氯原子的杂化方式为_______ 。
(5)XeF2晶体属四方晶系,晶胞结构如图所示,晶胞棱边夹角均为90.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子分数坐标。图中原子A的分数坐标为(0,0,0) ,原子B的分数坐标为( ,
, ,
, )。已知Xe- F键长为r pm,则原子C的分数坐标为
)。已知Xe- F键长为r pm,则原子C的分数坐标为_______ ;设NA为阿伏加德罗常数的值,XeF2的密度为_______ (列计算式)g·cm-3。

(1)基态F原子核外电子的空间运动状态有
(2)同周期元素N、O、F的第一电离能由大到小的顺序为
(3)氟气与水的反应复杂,主要生成HF和O2,副反应生成少量的H2O2、OF2等。OF2分子的空间构型为
(4)同主族元素Cl、Br、I的单质均可与水反应生成次卤酸,则ClO-中氯原子的杂化方式为
(5)XeF2晶体属四方晶系,晶胞结构如图所示,晶胞棱边夹角均为90.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子分数坐标。图中原子A的分数坐标为(0,0,0) ,原子B的分数坐标为(
 ,
, ,
, )。已知Xe- F键长为r pm,则原子C的分数坐标为
)。已知Xe- F键长为r pm,则原子C的分数坐标为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】研究发现,过量摄入铝元素能损害人的脑细胞。适当地补充碘元素可预防甲状腺肿大,但摄入过多也会导致甲状腺病变。试回答下列问题:
(1)Fe也是人体需要补充的元素之一,写出Fe3+的核外电子排布式:___________ 。
(2)与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能由大到小的顺序是___________ 。
(3)氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上获取铝单质不是电解熔融氯化铝,而是电解熔融氧化铝,原因是___________ ;为降低熔点和增强导电性,电解熔融氧化铝时通常要加入Na3AlF6(冰晶石),Na3AlF6中含有的化学键类型有___________ (填字母)。
A.离子键 B.金属键 C.氢键 D.配位键
(4)F与I是同一主族的元素,BF3与H3O+都是由四个原子构成的粒子,两种粒子的中心原子B和O的杂化方式分别为___________ 、___________ ,BF3的空间构型是___________ ,H3O+的空间构型是___________ 。
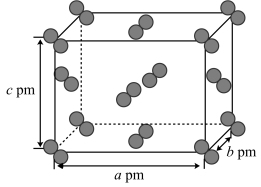
(5)I2晶体的晶胞结构如图所示,该晶胞中含有I原子的数目为___________ ,已知该晶胞的晶胞参数为apm、bpm和cpm,则I2晶体的密度是___________ g/cm3。(列出最简表达式,用NA表示阿伏加德罗常数的值)
(1)Fe也是人体需要补充的元素之一,写出Fe3+的核外电子排布式:
(2)与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能由大到小的顺序是
(3)氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上获取铝单质不是电解熔融氯化铝,而是电解熔融氧化铝,原因是
A.离子键 B.金属键 C.氢键 D.配位键
(4)F与I是同一主族的元素,BF3与H3O+都是由四个原子构成的粒子,两种粒子的中心原子B和O的杂化方式分别为
(5)I2晶体的晶胞结构如图所示,该晶胞中含有I原子的数目为

您最近半年使用:0次
【推荐2】铋及其化合物广泛应用于电子材料、医药等领域。一种以含铋烧渣(主要成分为Bi2O3、MnSO4,还含有少量MnS、Fe2O3、CuO及SiO2等)制取Bi2O3并回收锰的工艺流程如下:
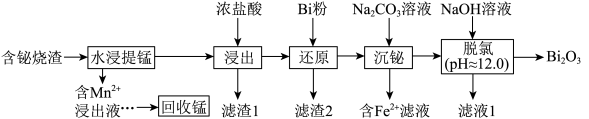
已知:①氧化性:Fe3+>Cu2+>Bi3+;
②Bi3+易水解成BiOCl沉淀:常温下,BiOCl存在的pH范围约为2.0~11.0;
③常温下,Ksp[Fe(OH)2]=4.9×10-17;1g7=0.85。
回答下列问题:
(1)基态锰原子的价电子排布式为___________ 。
(2)“水浸提锰”时,另加入少量稀硫酸可促进___________ (填化学式)溶解,进一步提高锰的浸取率。
(3)滤渣2主要成分是___________ 和Bi。
(4)常温下,“含Fe2+滤液”中Fe2+的浓度为0.01mol/L为保证BiOCl产品的纯度,理论上,“沉铋”时应控制溶液的pH<___________ 。
(5)“脱氯”过程中发生主要反应的离子方程式为___________ 。
(6)我国科学家在新型二维半导体芯片材料——硒氧化秘的研究中取得突破性进展。硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为apm,apm,bpm。
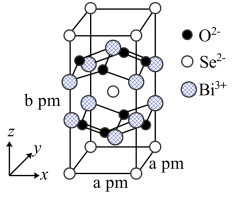
①该晶体中,每个O2-周围紧邻的Bi3+共有___________ 个。
②该晶体的密度为___________ g·cm-3(列出计算式,NA为阿伏加德罗常数的值)。

已知:①氧化性:Fe3+>Cu2+>Bi3+;
②Bi3+易水解成BiOCl沉淀:常温下,BiOCl存在的pH范围约为2.0~11.0;
③常温下,Ksp[Fe(OH)2]=4.9×10-17;1g7=0.85。
回答下列问题:
(1)基态锰原子的价电子排布式为
(2)“水浸提锰”时,另加入少量稀硫酸可促进
(3)滤渣2主要成分是
(4)常温下,“含Fe2+滤液”中Fe2+的浓度为0.01mol/L为保证BiOCl产品的纯度,理论上,“沉铋”时应控制溶液的pH<
(5)“脱氯”过程中发生主要反应的离子方程式为
(6)我国科学家在新型二维半导体芯片材料——硒氧化秘的研究中取得突破性进展。硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为apm,apm,bpm。

①该晶体中,每个O2-周围紧邻的Bi3+共有
②该晶体的密度为
您最近半年使用:0次
【推荐3】元素周期表前四周期的A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ns1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)写出元素名称:C___________ 、D___________ 、E___________ 。
(2)C基态原子的电子排布图为___________ 。
(3)当n=2时,B的最简单气态氢化物的电子式为___________ ,BC2分子的结构式是___________ ;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是:___________ 。
(4)E元素原子的外围电子排布式是___________ 。
(1)写出元素名称:C
(2)C基态原子的电子排布图为
(3)当n=2时,B的最简单气态氢化物的电子式为
(4)E元素原子的外围电子排布式是
您最近半年使用:0次
【推荐1】过渡金属及其化合物在生产生活中有着广泛应用。锰钢异常坚硬,且具抗冲击性能,是制造枪栓、保险库、挖掘机械和铁路设施的理想材料;锰也是人体的重要微量元素。请根据所学知识,回答下列问题:
(1)铬、锰、铁称为黑色金属,位于同一周期的相邻位置。锰的原子序数是______ ; 基态离子的价层电子排布图为
基态离子的价层电子排布图为______ 。
(2)下列状态的铁中,电离最外层的一个电子所需能量最大的是______(填编号)。
(3)水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与 形成黄色的配合物。锰试剂的结构如图所示,
形成黄色的配合物。锰试剂的结构如图所示,
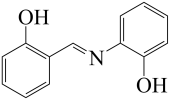
其分子中可能与 形成配位键的原子有
形成配位键的原子有______ ;锰试剂______ (填“能”或“不能”)形成分子内氢键。
(4)锰试剂分子中除氢以外的元素,第一电离能从小到大的顺序为______ (用元素符号表示)。
(5) 规则指的是配合物中心原子价电子数和配体提供的电子数之和为18.符合
规则指的是配合物中心原子价电子数和配体提供的电子数之和为18.符合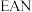 规则的配合物分子结构和化学性质都较稳定。已知
规则的配合物分子结构和化学性质都较稳定。已知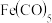 和
和 均符合
均符合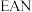 规则,性质稳定,而
规则,性质稳定,而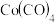 则容易在化学反应中表现氧化性。
则容易在化学反应中表现氧化性。
①x=______ 。
②从结构角度解释Co(CO)4容易在化学反应中表现氧化性的原因______ 。
(1)铬、锰、铁称为黑色金属,位于同一周期的相邻位置。锰的原子序数是
 基态离子的价层电子排布图为
基态离子的价层电子排布图为(2)下列状态的铁中,电离最外层的一个电子所需能量最大的是______(填编号)。
A.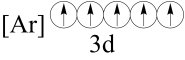 | B.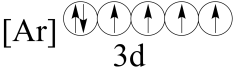 |
C.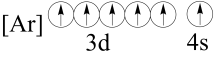 | D. |
 形成黄色的配合物。锰试剂的结构如图所示,
形成黄色的配合物。锰试剂的结构如图所示,
其分子中可能与
 形成配位键的原子有
形成配位键的原子有(4)锰试剂分子中除氢以外的元素,第一电离能从小到大的顺序为
(5)
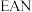 规则指的是配合物中心原子价电子数和配体提供的电子数之和为18.符合
规则指的是配合物中心原子价电子数和配体提供的电子数之和为18.符合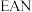 规则的配合物分子结构和化学性质都较稳定。已知
规则的配合物分子结构和化学性质都较稳定。已知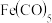 和
和 均符合
均符合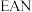 规则,性质稳定,而
规则,性质稳定,而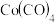 则容易在化学反应中表现氧化性。
则容易在化学反应中表现氧化性。①x=
②从结构角度解释Co(CO)4容易在化学反应中表现氧化性的原因
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】碘酸钾(KIO3)是重要的食品添加剂。可用Cl2氧化I2制取HIO3,再用KOH中和HIO3制取KIO3。其中,制取碘酸(HIO3)的实验装置示意图和有关资料如下:

回答下列问题:
(1)装置A中发生反应的化学方程式为___________________________________ 。
(2)装置B的名称为_____________ ,I2和Cl2在水中的溶解度小于在CCl4中的溶解度,原因是___________________________________________________________ 。
(3)KIO3晶体中,基态 K 原子核外电子占据的最高能层的符号是________ ,占据该能层电子的电子云轮廓图形状为__________ ;碘元素在周期表中的位置为___________ ,IO3-中心原子I的杂化类型为_____________ 。
(4)HIO3分子中三种元素电负性由大到小的顺序为___________ ,其电离方程式为______ 。

| HIO3 | ①白色固体,能溶于水,难溶于四氯化碳 ②Ka=0.169mol/L |
| KIO3 | ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生反应: ClO-+IO3-=IO4-+Cl- |
(1)装置A中发生反应的化学方程式为
(2)装置B的名称为
(3)KIO3晶体中,基态 K 原子核外电子占据的最高能层的符号是
(4)HIO3分子中三种元素电负性由大到小的顺序为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】天宫空间站有两对单翼翼展约30米的柔性太阳翼。关键部件为高性能颗粒增强铝基复合材料(SiC/Al)。请回答:
(1)基态Si的价电子轨道表示式是_______ 。碳化硅的晶体类型是_______ 晶体。
(2)矾土含Al3+,《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的Al3+、Ca2+生成的红色配合物X是最早的媒染染料。
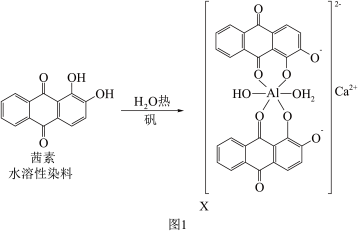
①C、N、O、Al的第一电离能从大到小的顺序为_______ 。
②X中Al3+的配位数为_______ ,C的杂化轨道类型是 _______ 。
③茜素水溶性较好的原因是_______ 。
(3)某硅、铁化合物晶胞如图2,铁有两种位置,分别用Fe1、Fe2(未画出)表示,Fe2占据硅形成的所有正四面体空隙。
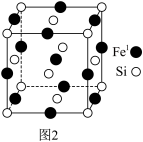
①距离Fe1最近的Fe1有_______ 个。
②若将Fe1置于晶胞顶点,则位于此晶胞面心、体心的原子分别是_______ 、_______ (选填“Si”、“Fe1”、“Fe2”)。
③若晶体密度为ρ g•cm﹣3,则两个最近的Fe1和Fe2之间的距离是_______ pm(不必化简)。
(1)基态Si的价电子轨道表示式是
(2)矾土含Al3+,《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的Al3+、Ca2+生成的红色配合物X是最早的媒染染料。

①C、N、O、Al的第一电离能从大到小的顺序为
②X中Al3+的配位数为
③茜素水溶性较好的原因是
(3)某硅、铁化合物晶胞如图2,铁有两种位置,分别用Fe1、Fe2(未画出)表示,Fe2占据硅形成的所有正四面体空隙。

①距离Fe1最近的Fe1有
②若将Fe1置于晶胞顶点,则位于此晶胞面心、体心的原子分别是
③若晶体密度为ρ g•cm﹣3,则两个最近的Fe1和Fe2之间的距离是
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
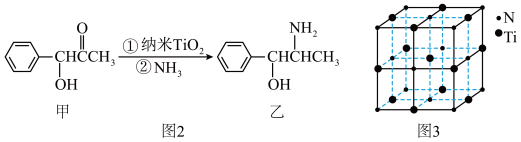
【推荐1】金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性。它兼具铁的高强度和铝的低密度。其单质和化合物具有广泛的应用价值。氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1)。

请回答下列问题:
(1)Ti的基态原子价电子排布式图(轨道表示式)_______________ ;
(2)N2的电子式为_______________ ;
(3)TiCl4在热水中水解除了生成H2TiO3还有一种气体,该气体的沸点比HF的沸点_______________ (填“高”或“低”),原因是_______________ ;
(4)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中碳原子采取的杂化方式是_______________ ,化合物乙中采取sp3方式杂化的所有原子对应的元素的第一电离能由大到小的顺序为_______________ ;
(5)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间最近距离为apm,则该氮化钛的密度为_______________ g·cm-3(NA为阿伏加 德罗常数的值,只列计算式)。该晶体中与Ti原子距离相等且最近的T'i原子有_______________ 个。

请回答下列问题:
(1)Ti的基态原子价电子排布式图(轨道表示式)
(2)N2的电子式为
(3)TiCl4在热水中水解除了生成H2TiO3还有一种气体,该气体的沸点比HF的沸点
(4)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中碳原子采取的杂化方式是

(5)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间最近距离为apm,则该氮化钛的密度为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题:
(1)Cr是第_____ 周期第_____ 族元素,基态Cr原子有______ 个未成对电子。
(2)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是______ 。
(3)炭基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含____ molσ键。
(4)砷化硼的晶胞结构如图a所示,图b中矩形AA′C′C是沿如图a放置的晶胞对角面取得的截图。
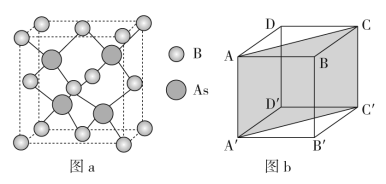
①若该晶体的密度为ag/cm3,设B和As的原子半径分别为rBpm和rAspm,则原子的空间占有率为_____ ×100%(列出计算表达式,阿伏加德罗常数的值为NA)。
②晶胞中各原子在矩形AA′C′C中的位置为_____ (填“甲”“乙”“丙”或“丁”)。
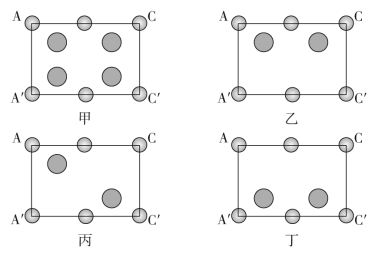
(1)Cr是第
(2)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是
(3)炭基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含
(4)砷化硼的晶胞结构如图a所示,图b中矩形AA′C′C是沿如图a放置的晶胞对角面取得的截图。

①若该晶体的密度为ag/cm3,设B和As的原子半径分别为rBpm和rAspm,则原子的空间占有率为
②晶胞中各原子在矩形AA′C′C中的位置为

您最近半年使用:0次
【推荐3】已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
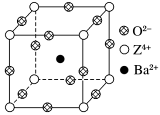
(1) Y在周期表中位于______________ ;Z4+的核外电子排布式为___________________ 。
(2)X的该种氢化物分子构型为________ ,X在该氢化物中以_______ 方式杂化。X和Y形成的化合物的熔点应该_______ (填“高于”或“低于”)X的氢化物的熔点。
(3)①制备M的化学方程式是_____________ 。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________ 。
③在M晶体中,Z4+的氧配位数为________ 。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____ m。

(1) Y在周期表中位于
(2)X的该种氢化物分子构型为
(3)①制备M的化学方程式是
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的
③在M晶体中,Z4+的氧配位数为
④已知O2-半径为1.40×10-10 m,则Z4+半径为
您最近半年使用:0次



