题型:解答题-结构与性质
难度:0.65
引用次数:852
题号:12192744
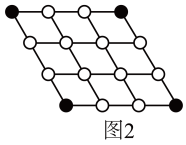
磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(图1)。 为大幅度提高锂电池的充电速率,科学家最近研发了黑磷-石墨复合负极材料,其单层结构俯视图如图2所示。
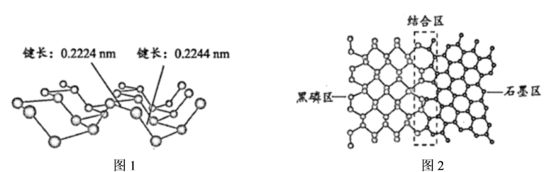
回答下列问题:
(1)Li、C、P三种元素中,电负性最小的是_________________ (用元素符号作答)。
(2)基态磷原子价电子排布式为________________ 。
(3)图2黑磷区中P原子的杂化方式为_________________ ,石墨区中C原子的杂化方式为____________ 。
(4)氢化物PH3、CH4、NH3的沸点由高到低顺序为________________ 。
(5)根据图1和图2的信息,下列说法正确的有________ (填字母)。
A. 黑磷区中P-P键的键能不完全相同
B. 黑磷与石墨都属于混合型晶体
C. 由石墨与黑磷制备该复合材料的过程,发生了化学反应
D. 石墨与黑磷的交界结合区域中,P原子与C原子共平面
E. 复合材料单层中,P原子与C原子之间的作用力属范德华力
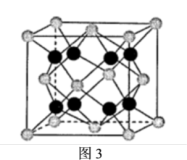
(6)贵金属磷化物Rh2P (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为___________________ , 晶体的密度为__________ g·cm-3(列出计算式)。

回答下列问题:
(1)Li、C、P三种元素中,电负性最小的是
(2)基态磷原子价电子排布式为
(3)图2黑磷区中P原子的杂化方式为
(4)氢化物PH3、CH4、NH3的沸点由高到低顺序为
(5)根据图1和图2的信息,下列说法正确的有
A. 黑磷区中P-P键的键能不完全相同
B. 黑磷与石墨都属于混合型晶体
C. 由石墨与黑磷制备该复合材料的过程,发生了化学反应
D. 石墨与黑磷的交界结合区域中,P原子与C原子共平面
E. 复合材料单层中,P原子与C原子之间的作用力属范德华力
(6)贵金属磷化物Rh2P (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为

更新时间:2021-01-25 12:48:16
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常为+3价,这些化合物在研究和生产中有许多重要用途。请回答下列问题。
(1)镓元素(Ga)的原子序数为__________ ,其外围电子排布式__________ 。
(2)由第二周期元素组成的与BCl3互为等电子体的阴离子为________ 。 硼元素具有缺电子性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]—。不考虑空间构型,[B(OH)4]—中原子的成键方式用结构简式表示为______________ 。1 mol [B(OH)4]—中σ键的数目为________ 。
(3)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因______________ 。
(4)磷化铝熔点为2000℃,空间结构与金刚石相似,磷化铝晶胞结构如图所示。

①磷化铝晶体中磷与铝微粒间的作用力为__________ 。
②磷化铝晶体的密度为ρ g·cm-3,用NA表示阿伏加 德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为__________ cm。
(1)镓元素(Ga)的原子序数为
(2)由第二周期元素组成的与BCl3互为等电子体的阴离子为
(3)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因
(4)磷化铝熔点为2000℃,空间结构与金刚石相似,磷化铝晶胞结构如图所示。

①磷化铝晶体中磷与铝微粒间的作用力为
②磷化铝晶体的密度为ρ g·cm-3,用NA表示阿伏加 德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】科学的进步离不开技术的突破。原子光谱核磁共振、X射线衍射、量子计算等技术的发展与应用都推进了结构的研究。如过渡元素原子结构、超分子结构、晶体结构、配合物结构研究等。
(1)过渡元素Cr原子的基态电子排布式为______ ,Cr 的核外电子由激发态跃迁至基态时产生的光谱是______ (填“吸收”或“发射”)光谱。
(2)胍鎓离子[C(NH2)3+ ]可以与甲基磺酸根( CH3SO3- )形成超分子晶体,其局部结构如图所示。
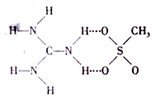
①组成该晶体的元素中电负性最大的是______ ,其中 S的杂化类型有_______ 。
②元素C、N、S的简单氢化物在水中的溶解度从小到大的顺序为______ ,原因是______ 。
(3)①将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液。该过程中微粒的变化是[Cu(H2O)4]2+→Cu(OH)2→[Cu(NH3)4]2+。[Cu(H2O)4]2+和[Cu(NH3)4]2+中共同含有的化学键类型有_________ 。
②已知:AlF63+在溶液中可稳定存在,CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_____ (用离子方程式表示)。
(4)近年研究人员通过量子化学计算预测并合成了化合物Na2He,经X射线衍射分析其晶胞结构如图所示。
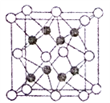
①晶胞中Na堆积形成___________ (填形状)空间结构,He占据一半空隙,另一半由e-占据。已知Na2He晶体不能导电,理由是__________ 。
②已知晶胞边长为a nm,晶胞中Na的半径为b nm,则He的半径为_____ nm(列出计算式即可)。
(1)过渡元素Cr原子的基态电子排布式为
(2)胍鎓离子[C(NH2)3+ ]可以与甲基磺酸根( CH3SO3- )形成超分子晶体,其局部结构如图所示。

①组成该晶体的元素中电负性最大的是
②元素C、N、S的简单氢化物在水中的溶解度从小到大的顺序为
(3)①将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液。该过程中微粒的变化是[Cu(H2O)4]2+→Cu(OH)2→[Cu(NH3)4]2+。[Cu(H2O)4]2+和[Cu(NH3)4]2+中共同含有的化学键类型有
②已知:AlF63+在溶液中可稳定存在,CaF2难溶于水,但可溶于含Al3+的溶液中,原因是
(4)近年研究人员通过量子化学计算预测并合成了化合物Na2He,经X射线衍射分析其晶胞结构如图所示。

①晶胞中Na堆积形成
②已知晶胞边长为a nm,晶胞中Na的半径为b nm,则He的半径为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子的2p能级有3个电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。回答下列问题:
(1)写出基态E+的价电子排布式:_________ 。基态A原子的第一电离能比B的大,其原因是__________ 。
(2)A5+由美国空军研究实验室推进科学与先进概念部Karl .O. Christed 于1999年成功合成,其结构呈‘V'形且该离子中各原子均达到8电子稳定结构,则A5+的结构式为________ 。
(3)B3分子的空间构型为______ ,其中B原子的杂化类型是______ ,与B3分子互为等电子体的微粒有_________ (写一种离子)。
(4)向E的硫酸盐溶液中通入A的气态氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。加入乙醇的目的___________ 。 写出该配合物中配离子的结构简式__________ 。
(5)由长周期元素组成的镧镍合金、铜钙合金有相同类型的晶体结构XYn,它们有很强的储氢能力,其中铜钙合金的晶体的部分结构如图所示。
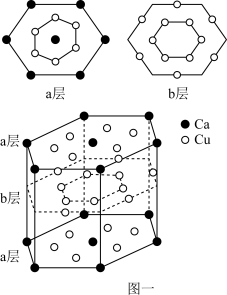
已知镧镍合金(LaNin)晶体中的重复结构单元如图一所示,该结构单元的体积为9.0×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶体空隙,体积不变),则LaNin中n=___ (填数值);氢在合金中的密度为_______ g/L。
(1)写出基态E+的价电子排布式:
(2)A5+由美国空军研究实验室推进科学与先进概念部Karl .O. Christed 于1999年成功合成,其结构呈‘V'形且该离子中各原子均达到8电子稳定结构,则A5+的结构式为
(3)B3分子的空间构型为
(4)向E的硫酸盐溶液中通入A的气态氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。加入乙醇的目的
(5)由长周期元素组成的镧镍合金、铜钙合金有相同类型的晶体结构XYn,它们有很强的储氢能力,其中铜钙合金的晶体的部分结构如图所示。

已知镧镍合金(LaNin)晶体中的重复结构单元如图一所示,该结构单元的体积为9.0×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶体空隙,体积不变),则LaNin中n=
您最近半年使用:0次
【推荐1】下表为元素周期表的一部分,编号分别代表对应的元素,回答下列问题:

(1)①~⑨原子半径最大的是_________ (填元素符号,下同),电负性最大的是_________ 。
(2)⑤的第一电离能比④小,结合价层电子排布式解释原因_________ 。
(3)⑦的单质能与碱反应,根据“对角线规则",③的单质与 溶液反应的方程式是
溶液反应的方程式是_________ 。
(4)⑨位于元素周期表第VIII族,按照核外电子排布,把元素周期表划分为5个区,⑨位于_________ 区。请在图中用“↑”或“↓”补全⑨三价离子 的价层电子排布图_________ 。
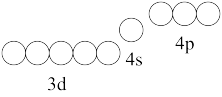

(1)①~⑨原子半径最大的是
(2)⑤的第一电离能比④小,结合价层电子排布式解释原因
(3)⑦的单质能与碱反应,根据“对角线规则",③的单质与
 溶液反应的方程式是
溶液反应的方程式是(4)⑨位于元素周期表第VIII族,按照核外电子排布,把元素周期表划分为5个区,⑨位于
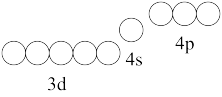
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】
翡翠的主要成分为 NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅。
(1) NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是___________ (写化学式)
(2)基态Cr3+的核外电子排布式为_____________________ 。
(3)配合物K[Cr(C2O4)2(H2O)中的配体是___________ ,C2O42-中碳原子的杂化轨道类型是___________ ,与H2O互为等电子体的离子是___________ (任写一种)
(4)一种铝镍合金的晶胞结构如图所示,与其结构相似的化合物是___________ (填标号)。

a.氟化钙 b.金刚石 c.钠 d.氯化铯
(5)Ca、O、Gr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+,O2-采用面心立方最密堆积方式。
①该晶体的化学式为___________ 。
②已知钙离子、氧离子半径分别为100pm、140pm,该晶胞的参数(边长)为___________ pm。
③阿伏伽德罗常数的值为NA,该晶体密度的计算表达式为___________ g·cm-3;晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为___________ pm。
翡翠的主要成分为 NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅。
(1) NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是
(2)基态Cr3+的核外电子排布式为
(3)配合物K[Cr(C2O4)2(H2O)中的配体是
(4)一种铝镍合金的晶胞结构如图所示,与其结构相似的化合物是

a.氟化钙 b.金刚石 c.钠 d.氯化铯
(5)Ca、O、Gr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+,O2-采用面心立方最密堆积方式。
①该晶体的化学式为
②已知钙离子、氧离子半径分别为100pm、140pm,该晶胞的参数(边长)为
③阿伏伽德罗常数的值为NA,该晶体密度的计算表达式为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】超分子在生命科学和物理学等领域中具有重要意义。由Fe将2个C60分子、2个p—甲酸丁酯吡啶及2个CO分子自组装的超分子结构如图所示。
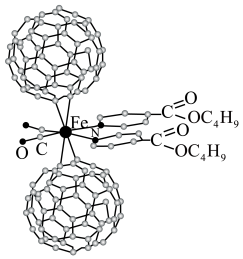
回答下列问题:
(1)基态Fe原子的核外有____ 种不同空间运动状态的电子。
(2)该超分子含有的第二周期元素中,电负性由大到小的顺序是____ 。
(3)该超分子中含有的微粒间作用力有____ (填标号)。
(4)p—甲酸丁酯吡啶配体中C原子的杂化方式是____ (吡啶可看作苯分子中的一个CH原子团被N取代的化合物)。
(5)已知:C60中存在碳碳单、双键,C60中每个碳原子只跟相邻的3个碳原子形成化学键,C60分子只含有五边形和六边形;多面体的顶点数V、面数F及棱边数E遵循欧拉定理:V+F-E=2。
①一个C60分子中,五边形的数目有____ 个、碳碳双键的数目有____ 个。
②固体C60与金刚石相比较,熔点较高的是____ ,理由是____ 。
(6)铁的一种立方晶系晶体结构中,每个晶胞平均含有2个Fe,Fe原子坐标是(0,0,0)和( ,
, ,
, )。根据以上信息,推断该晶体的原子堆积方式是
)。根据以上信息,推断该晶体的原子堆积方式是____ 。已知该晶体中距离最近的Fe原子核之间的距离为apm,阿伏加德罗常数是NA,则晶体的密度为____ g·cm-3。

回答下列问题:
(1)基态Fe原子的核外有
(2)该超分子含有的第二周期元素中,电负性由大到小的顺序是
(3)该超分子中含有的微粒间作用力有
| A.共价键 | B.氢键 | C.金属键 | D.配位键 |
(5)已知:C60中存在碳碳单、双键,C60中每个碳原子只跟相邻的3个碳原子形成化学键,C60分子只含有五边形和六边形;多面体的顶点数V、面数F及棱边数E遵循欧拉定理:V+F-E=2。
①一个C60分子中,五边形的数目有
②固体C60与金刚石相比较,熔点较高的是
(6)铁的一种立方晶系晶体结构中,每个晶胞平均含有2个Fe,Fe原子坐标是(0,0,0)和(
 ,
, ,
, )。根据以上信息,推断该晶体的原子堆积方式是
)。根据以上信息,推断该晶体的原子堆积方式是
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】钛(22Ti)铝合金在航空领域应用广泛,回答下列问题:
(1)基态Ti原子的核外电子排布式为[Ar]_____ ,其中s轨道上总共有______ 个电子。
(2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是____ ,配位体____ 。
(3)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应: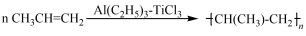 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有_______________ ;反应中涉及的元素中电负性最大的是_________ 。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是____________ 。
(4)钛与卤素形成的化合物的熔沸点如下表所示,

分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定规律的原因是___________________________ 。
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.295nm,c =0.469 nm,则该钛晶体的密度为__________________ g·cm-3(用NA 表示阿伏伽德罗常数的值,列出计算式即可)。

(1)基态Ti原子的核外电子排布式为[Ar]
(2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是
(3)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:
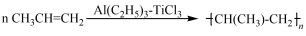 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有(4)钛与卤素形成的化合物的熔沸点如下表所示,

分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定规律的原因是
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.295nm,c =0.469 nm,则该钛晶体的密度为

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】乙炔是有机合成工业的一种重要原料。工业上曾用焦炭制备电石 (CaC2),再与水反应制备乙炔。
(1)焦炭、金刚石和 都是碳的单质。已知金刚石中碳碳键的键长为
都是碳的单质。已知金刚石中碳碳键的键长为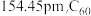 中碳碳键的键长为
中碳碳键的键长为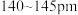 ,二者比较熔点高的是
,二者比较熔点高的是___________ ,理由是___________ 。
(2)乙炔与氢氰酸反应可得丙烯腈 。丙烯腈分子中碳原子轨道杂化类型是
。丙烯腈分子中碳原子轨道杂化类型是___________ ,该分子中 键与
键与 键个数比为
键个数比为___________ 。
(3)将乙炔通入 溶液生成
溶液生成 红棕色沉淀。
红棕色沉淀。 基态核外电子排布式为
基态核外电子排布式为___________ 。 的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:
的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:___________ 。
(4)CaC2中 与
与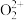 互为等电子体,
互为等电子体,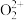 的电子式为
的电子式为___________ 。
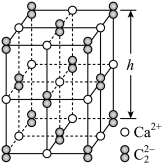
(5)CaC2晶体的晶胞结构与NaCl晶体相似,但CaC2晶体中哑铃形 的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的
的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的 有
有___________ 个。已知CaC2晶体密度为 ,晶胞中两个
,晶胞中两个 的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=
的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=___________ cm。
(1)焦炭、金刚石和
 都是碳的单质。已知金刚石中碳碳键的键长为
都是碳的单质。已知金刚石中碳碳键的键长为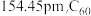 中碳碳键的键长为
中碳碳键的键长为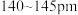 ,二者比较熔点高的是
,二者比较熔点高的是(2)乙炔与氢氰酸反应可得丙烯腈
 。丙烯腈分子中碳原子轨道杂化类型是
。丙烯腈分子中碳原子轨道杂化类型是 键与
键与 键个数比为
键个数比为(3)将乙炔通入
 溶液生成
溶液生成 红棕色沉淀。
红棕色沉淀。 基态核外电子排布式为
基态核外电子排布式为 的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:
的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:(4)CaC2中
 与
与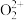 互为等电子体,
互为等电子体,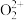 的电子式为
的电子式为(5)CaC2晶体的晶胞结构与NaCl晶体相似,但CaC2晶体中哑铃形
 的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的
的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的 有
有 ,晶胞中两个
,晶胞中两个 的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=
的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X的元素符号为_______ 。
(2)XZ2与YZ2分子的立体构型分别是_______ 和_______ ,相同条件下两者在水中的溶解度较大的是_______ (写分子式)。
(3)Q的元素符号为_______ ,属于第_______ 周期,它的核外电子排布式为_______ 。
(4)用氢键表示式写出E的氢化物溶液中存在的氢键:_______ 。
(1)X的元素符号为
(2)XZ2与YZ2分子的立体构型分别是
(3)Q的元素符号为
(4)用氢键表示式写出E的氢化物溶液中存在的氢键:
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】层状结构结构材料有着其他材料不可比拟的优势,包括高容量,高C-率性能和好的电导率。回答下列问题。
(1)氢化镁(h-MgH2)是一种单层的二维材料,二维晶胞俯视图如图1。

①h-MgH2中,Mg的配位数为_______ 。
②3×3×1的h-MgH2晶胞中,涂黑处的Mg被Mn替换,形成掺杂h-MgH2(晶胞如图2所示,H已省略)的化学式为_______ 。
(2)用石墨作电极处理黄铜矿可制得硫酸铜溶液和单质硫。石墨的晶体结构如图所示,虚线勾勒出的是其晶胞。则石墨晶胞中含碳原子数为_______ 个。已知石墨的密度为pg·cm-3,C-C键的键长为a cm,设阿伏加德罗常数的值为NA,则石墨晶体的层间距d=_______ cm。
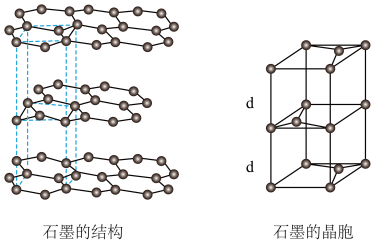
(3)黑磷是磷的一种稳定的同素异形体,黑磷具有正交晶系的晶体结构(图A)。黑磷烯是二维的单层黑磷(图B),黑磷烯与石墨烯结构相似,P的配位数为3。与石墨烯相比,黑磷烯具有半导体性质,更适合于制作电子器件。已知黑磷结构中只有一种等效的三配位P,所有P原子的成键环境一样。
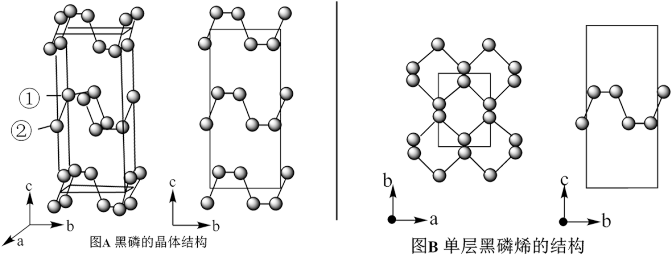
①黑磷中P原子杂化类型是_______ 。
②黑磷的晶胞中含有_______ 个P原子。
(1)氢化镁(h-MgH2)是一种单层的二维材料,二维晶胞俯视图如图1。

①h-MgH2中,Mg的配位数为
②3×3×1的h-MgH2晶胞中,涂黑处的Mg被Mn替换,形成掺杂h-MgH2(晶胞如图2所示,H已省略)的化学式为

(2)用石墨作电极处理黄铜矿可制得硫酸铜溶液和单质硫。石墨的晶体结构如图所示,虚线勾勒出的是其晶胞。则石墨晶胞中含碳原子数为

(3)黑磷是磷的一种稳定的同素异形体,黑磷具有正交晶系的晶体结构(图A)。黑磷烯是二维的单层黑磷(图B),黑磷烯与石墨烯结构相似,P的配位数为3。与石墨烯相比,黑磷烯具有半导体性质,更适合于制作电子器件。已知黑磷结构中只有一种等效的三配位P,所有P原子的成键环境一样。

①黑磷中P原子杂化类型是
②黑磷的晶胞中含有
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】根据已学知识,请回答下列问题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有______ 种。
(2)画出第四周期的第ⅠB族元素基态原子电子排布式:____________________ 。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________ 。
(4)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是_______________ (填化学式)。
(5)第ⅢA族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素。硼酸的结构式可表示为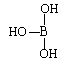 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:_______________________________ 。
(6)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式:(各写一种)正四面体分子_________ ,三角锥形分子 _________ 。
(7)钛被称为未来金属,已知某钛的化合物TiCl3·6H2O(相对分子质量为262.5)配位数为6,取该晶体26.25克配成溶液,加入足量硝酸银溶液,过滤,洗涤,烘干,称重,沉淀为28.70克,则该晶体的化学式可表示为______________________________ 。
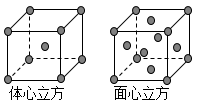
(8)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为_____________ ;若两种 晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为____________ 。
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有
(2)画出第四周期的第ⅠB族元素基态原子电子排布式:
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是
(4)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是
(5)第ⅢA族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素。硼酸的结构式可表示为
 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:(6)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式:(各写一种)正四面体分子
(7)钛被称为未来金属,已知某钛的化合物TiCl3·6H2O(相对分子质量为262.5)配位数为6,取该晶体26.25克配成溶液,加入足量硝酸银溶液,过滤,洗涤,烘干,称重,沉淀为28.70克,则该晶体的化学式可表示为
(8)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】已知A、B、C、D、E都属于元素周期表中前20号元素,原子序数依次增大。元素周期表中A的电负性最大,B是同周期元素中第一电离能最小的元素,A、D同主族,B、C、D同周期,E是人体的必需元素,缺乏时易引起佝偻病,B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题:
(1)A、D分别可形成简单气态氢化物,其中沸点较低的是____ (填化学式),原因是_____ 。
(2)C元素原子的价电子排布图为____ 。
(3)B能与氧气反应生成过氧化物,写出与O22-互为等电子体的一个分子和一个离子的化学式_____ 、________ 。
(4)CO能与B和Mn形成B[Mn(CO)5],配体是____ 。
(5)D和铯与不同价态的铜生成两种化合物,其阴离子均为无限长链结构如图所示,a位置上的D原子的杂化轨道类型为_________ 。已知其中一种化合物的化学式为CsCuD3,则另一种的化学式为_________ (用元素符号表示)。

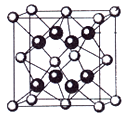
(6)EA2的晶胞如图所示,若晶胞边长为x pm,则晶胞密度为____ g/cm3(用NA和x表示)。
(1)A、D分别可形成简单气态氢化物,其中沸点较低的是
(2)C元素原子的价电子排布图为
(3)B能与氧气反应生成过氧化物,写出与O22-互为等电子体的一个分子和一个离子的化学式
(4)CO能与B和Mn形成B[Mn(CO)5],配体是
(5)D和铯与不同价态的铜生成两种化合物,其阴离子均为无限长链结构如图所示,a位置上的D原子的杂化轨道类型为

(6)EA2的晶胞如图所示,若晶胞边长为x pm,则晶胞密度为

您最近半年使用:0次



