题型:
难度:0.65
引用次数:1604
题号:12194283
以印刷线路板的碱性蚀刻废液(主要成分为[Cu(NH3)4]Cl2)或焙烧过的铜精炼炉渣(主要成分为CuO、SiO2少量Fe2O3)为原料均能制备CuSO4·5H2O晶体。

(1)取一定量蚀刻废液和稍过量的NaOH溶液加入到如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气,待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体;所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。
①写出用蚀刻废液制备CuO反应的化学方程式:_______ 。
②检验CuO固体是否洗净的实验操作是_______ 。
③装置图中装置X的作用是_______ 。
(2)以焙烧过的铜精炼炉渣为原料制备CuSO4·5H2O晶体时,请补充完整相应的实验方案:取一定量焙烧过的铜精炼炉渣,_______ ,加热浓缩、冷却结晶、过滤、晾干,得到CuSO4·5H2O晶体。
已知:①该实验中pH=3.2时,Fe3+完全沉淀;pH=4.7时,Cu2+开始沉淀。②实验中可选用的试剂:1.0 mol∙L−1 H2SO4、1.0 mol∙L−1HCl、1.0 mol∙L−1 NaOH。
(3)通过下列方法测定产品纯度:准确称取0.5000g CuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1000 mol∙L−1 Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.80mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2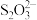 +I2=
+I2=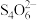 +2I-。计算CuSO4·5H2O样品的纯度(写出计算过程):
+2I-。计算CuSO4·5H2O样品的纯度(写出计算过程):_______ 。

(1)取一定量蚀刻废液和稍过量的NaOH溶液加入到如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气,待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体;所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。
①写出用蚀刻废液制备CuO反应的化学方程式:
②检验CuO固体是否洗净的实验操作是
③装置图中装置X的作用是
(2)以焙烧过的铜精炼炉渣为原料制备CuSO4·5H2O晶体时,请补充完整相应的实验方案:取一定量焙烧过的铜精炼炉渣,
已知:①该实验中pH=3.2时,Fe3+完全沉淀;pH=4.7时,Cu2+开始沉淀。②实验中可选用的试剂:1.0 mol∙L−1 H2SO4、1.0 mol∙L−1HCl、1.0 mol∙L−1 NaOH。
(3)通过下列方法测定产品纯度:准确称取0.5000g CuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1000 mol∙L−1 Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.80mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2
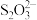 +I2=
+I2=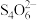 +2I-。计算CuSO4·5H2O样品的纯度(写出计算过程):
+2I-。计算CuSO4·5H2O样品的纯度(写出计算过程):
更新时间:2021-01-25 14:14:40
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法错误的是


| A.相对于途径①,途径②更好地体现了绿色化学思想 |
| B.Y可以是葡萄糖 |
| C.CuSO4在1100℃分解所得混合气体X可能是SO2和SO3 |
| D.CuSO4可用于配制农药 |
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】铜是生产和生活中用量较多的金属。
(1)下列有关铜元素的说法中,不正确的是__________ (填字母)
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.铜与O2反应生成黑色的CuO
D.CuSO4·5H2O是一种混合物,加热后变为白色固体
(2)某化学小组为测定某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物 测定剩余固体的质量
测定剩余固体的质量
①请写出方案Ⅰ中铜与稀硝酸反应的离子方程式:___________ ,该方案中稀硝酸表现出来的性质是___________ (填字母)。
A.挥发性 B.酸性 C.氧化性 D.还原性
②方案Ⅱ比方案Ⅰ更易于实施,理由是________________ 。请写出方案Ⅱ中发生反应的化学方程式:____________ ,该反应产生气体在标准状况下的体积为________ (铜铝混合物质量是m1g,反应后剩余固体的质量m2g,用含m1、m2的代数式表示)。
(1)下列有关铜元素的说法中,不正确的是
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.铜与O2反应生成黑色的CuO
D.CuSO4·5H2O是一种混合物,加热后变为白色固体
(2)某化学小组为测定某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物
 测定生成气体的体积
测定生成气体的体积方案Ⅱ:铜铝混合物
 测定剩余固体的质量
测定剩余固体的质量①请写出方案Ⅰ中铜与稀硝酸反应的离子方程式:
A.挥发性 B.酸性 C.氧化性 D.还原性
②方案Ⅱ比方案Ⅰ更易于实施,理由是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】硫酸铜是一种应用极其广泛的化工原料。实验中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示)。
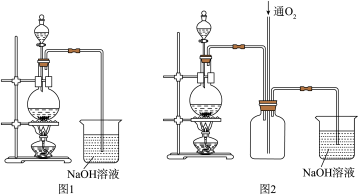
(1)配制质量分数20%的硫酸需要100mL98%的浓硫酸(密度为1.84g/cm3)和_____ mL蒸馏水。配制所需仪器除烧杯、量筒、胶头滴管外,还需要的仪器_____ 。
(2)图1烧瓶中发生的离子反应方程式为:_____ 。
(3)图2是图1的改进装置,其优点有:①_____ ;②_____ 。
为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案1:以空气为氧化剂。将铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。反应后,过滤、蒸发、结晶等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 晶体。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加Fe2(SO4)3,即发生反应。反应完全后向其中加物质甲、物质乙,取样检验后,过滤、蒸发、结晶,滤渣可循环使用。[已知Fe(OH)2、Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为9.6、3.7、6.4。]
(4)方案1中的A仪器名称是_____ 。晶体采用酒精淋洗的优点是_____ 。
(5)方案2中物质甲可以是_____ (选填答案编号,下同),物质乙可以是_____ 。
a.Cu b.CuCO3 c.CuO d.氨水 e.氯水 f 双氧水
取样检验是为了确认Fe3+是否除尽。有同学设计了以下两种方法:
方法①:取样于试管→滴加KSCN溶液;方法②:径向层析→喷KSCN溶液。
指出你认为不合理的方法及存在的问题_____ 。
(6)用铜粉制硫酸,上述方案1、方案2都不是十分理想,一种更符合绿色化学理念的是在氧气存在时用热稀硫酸与铜反应,其化学方程式是:_____ 。

(1)配制质量分数20%的硫酸需要100mL98%的浓硫酸(密度为1.84g/cm3)和
(2)图1烧瓶中发生的离子反应方程式为:
(3)图2是图1的改进装置,其优点有:①
为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案1:以空气为氧化剂。将铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。反应后,过滤、蒸发、结晶等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 晶体。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加Fe2(SO4)3,即发生反应。反应完全后向其中加物质甲、物质乙,取样检验后,过滤、蒸发、结晶,滤渣可循环使用。[已知Fe(OH)2、Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为9.6、3.7、6.4。]
(4)方案1中的A仪器名称是
(5)方案2中物质甲可以是
a.Cu b.CuCO3 c.CuO d.氨水 e.氯水 f 双氧水
取样检验是为了确认Fe3+是否除尽。有同学设计了以下两种方法:
方法①:取样于试管→滴加KSCN溶液;方法②:径向层析→喷KSCN溶液。
指出你认为不合理的方法及存在的问题
(6)用铜粉制硫酸,上述方案1、方案2都不是十分理想,一种更符合绿色化学理念的是在氧气存在时用热稀硫酸与铜反应,其化学方程式是:
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】以硫酸法钛白粉生产中排放的含锰废水(主要金属离子为Mn2+、Fe2+、Al3+,还含有少量Ca2+、Mg2+、Cu2+和Ni2+等离子)为原料,生产MnCO3的工艺流程如下:

已知:25 ℃时,Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11。
(1)流程中含锰废水经过前三步预处理,得到主要含有Mn2+的母液。
①除铁铝时,在搅拌条件下先加入H2O2溶液,再加入NaOH溶液调节pH。加入H2O2溶液时发生反应的离子方程式为__________________________________________ 。
②除钙镁步骤中,当Ca2+、Mg2+沉淀完全时,溶液中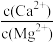 =
=________ 。
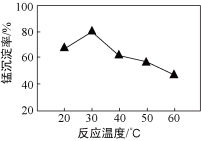
(2) 沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。
①沉锰过程发生反应的离子方程式为____________ 。该过程中加入适当过量的NH4HCO3的原因是________ 。
②当温度超过30 ℃,沉锰反应的锰沉淀率随温度升高而下降的原因是______________________________ 。
(3) 沉锰后过滤得到MnCO3粗产品,依次用去离子水和无水乙醇各洗涤2~3次,再低温干燥,得到纯净的MnCO3。用无水乙醇洗涤的目的是____________________________ 。

已知:25 ℃时,Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11。
(1)流程中含锰废水经过前三步预处理,得到主要含有Mn2+的母液。
①除铁铝时,在搅拌条件下先加入H2O2溶液,再加入NaOH溶液调节pH。加入H2O2溶液时发生反应的离子方程式为
②除钙镁步骤中,当Ca2+、Mg2+沉淀完全时,溶液中
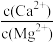 =
=
(2) 沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。
①沉锰过程发生反应的离子方程式为
②当温度超过30 ℃,沉锰反应的锰沉淀率随温度升高而下降的原因是
(3) 沉锰后过滤得到MnCO3粗产品,依次用去离子水和无水乙醇各洗涤2~3次,再低温干燥,得到纯净的MnCO3。用无水乙醇洗涤的目的是
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化,由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图。

下列说法不正确 的是

下列说法
A.步骤I中发生的反应可能为:2FeO+C CO2↑+2Fe CO2↑+2Fe |
| B.步骤II中碳单质被氧化 |
| C.用稀硫酸可以除去金属钛中少量的镁杂质 |
| D.步骤III中反应不能在空气中进行,可在氮气的保护下进行 |
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】碲被誉为“现代工业、国防与尖端技术的维生素”,工业上常用铜阳极泥 ( 主要成分是 Cu2Te, 含 Ag 、 Au 等杂质 ) 为原料提取碲并回收金属其工艺流程如下:
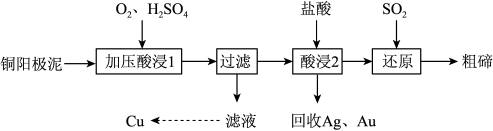
已知: TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)写出“加压酸浸 1”过程中 Cu2Te 发生反应的化学方程式_____________________ 。
(2)“酸浸 2”时温度过高会使碲的浸出率降低,原因为_______________ 。要从 Ag 和 Au 中分离出 Au ,可以向回收的 Ag 和 Au 中加入的试剂是 ______ 。
(3)写出“还原”反应中发生的离子方程式________________________ 。
(4)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧 , 使碲转化成 TeO2,再加NaOH 碱浸,以石墨为电极电解溶液获得 Te。 电解过程中阴极的电极反应式为__________ 。
(5)25 ℃时 , 向 1mol/L 的 Na2TeO3溶液中滴加盐酸 ,当溶液 pH 值约为 6 时 ,此时溶液中 c(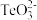 ):c(
):c( ) =
) = _________ ( 已知: H2TeO3:Ka1=1.0×10−3,Ka2=2.0×10−8)

已知: TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)写出“加压酸浸 1”过程中 Cu2Te 发生反应的化学方程式
(2)“酸浸 2”时温度过高会使碲的浸出率降低,原因为
(3)写出“还原”反应中发生的离子方程式
(4)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧 , 使碲转化成 TeO2,再加NaOH 碱浸,以石墨为电极电解溶液获得 Te。 电解过程中阴极的电极反应式为
(5)25 ℃时 , 向 1mol/L 的 Na2TeO3溶液中滴加盐酸 ,当溶液 pH 值约为 6 时 ,此时溶液中 c(
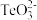 ):c(
):c( ) =
) =
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】电解精炼铜的阳极泥中含有大量的贵重金属和硒、碲等非金属元素。实验室从电解精炼铜的阳极泥中提取金、银、硒的流程如下:
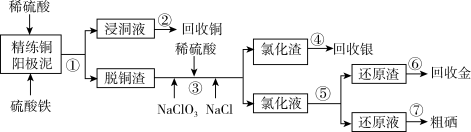
已知:单质金在酸性环境下与NaClO3、NaCl反应生成NaAuCl4;NaAuCl4可被Fe2+、SO2还原为单质金;硒的化合物不能被Fe2+还原,而能被SO2还原。
请回答下列问题:
(1)步骤①所得“浸铜液”中铜元素的存在形态为______ (用化学式表示);加入稀硫酸的目的是____________________ 。
(2)写出步骤③中金元素进入“氯化液”的离子反应方程式___________ ;银元素进入“氯化渣”中,则其存在的形态为_______ (用化学式表示)。
(3)步骤⑤需在氯化液中加入适当的试剂,可选择的试剂为______ (填代号)。
若“氯化液”中c(AuCl )为0.01mol·L-1,则处理500mL该“氯化液”需消耗该物质的质量为
)为0.01mol·L-1,则处理500mL该“氯化液”需消耗该物质的质量为_______ g。
(4)步骤②可以通过电解的方法得到单质铜,则电解时阴极的电极反应式为__________ ;在步骤③中,硒元素被氧化成亚硒酸,则步骤⑦制粗硒的化学反应方程式_____________ 。

已知:单质金在酸性环境下与NaClO3、NaCl反应生成NaAuCl4;NaAuCl4可被Fe2+、SO2还原为单质金;硒的化合物不能被Fe2+还原,而能被SO2还原。
请回答下列问题:
(1)步骤①所得“浸铜液”中铜元素的存在形态为
(2)写出步骤③中金元素进入“氯化液”的离子反应方程式
(3)步骤⑤需在氯化液中加入适当的试剂,可选择的试剂为
| A.FeSO4·7H2O | B.FeCl3 | C.SO2 | D.Na2SO3 |
 )为0.01mol·L-1,则处理500mL该“氯化液”需消耗该物质的质量为
)为0.01mol·L-1,则处理500mL该“氯化液”需消耗该物质的质量为(4)步骤②可以通过电解的方法得到单质铜,则电解时阴极的电极反应式为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
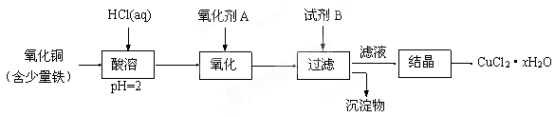
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解。
(1)加热酸溶过程中发生反应的化学方程式有:____________ 。
(2)氧化剂A可选用_________ (填编号,下同)。
A.KMnO4 B. HNO3 C. Cl2
(3)要得到较纯的产品,试剂B可选用_________ 。
A. NaOH B. CuO C.FeO
(4)试剂B的作用是__________ 。
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀
C. 降低溶液的pH D. 提高溶液的pH
(5)从滤液经过结晶得到氯化铜晶体的实验条件是___________ 。

已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解。
(1)加热酸溶过程中发生反应的化学方程式有:
(2)氧化剂A可选用
A.KMnO4 B. HNO3 C. Cl2
(3)要得到较纯的产品,试剂B可选用
A. NaOH B. CuO C.FeO
(4)试剂B的作用是
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀
C. 降低溶液的pH D. 提高溶液的pH
(5)从滤液经过结晶得到氯化铜晶体的实验条件是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】某化工厂将钛、氯碱工业和甲醇制备联合生产,大大提高原料利用率,并减少环境污染。流程如下:
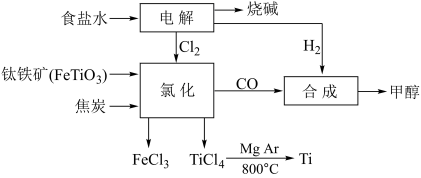
回答下列问题:
(1)写出以石墨为电极电解饱和食盐水的化学方程式___________________ 。
(2)写出钛铁矿在高温下与焦炭经氯化得四氯化钛的化学方程式__________________ ,生成1mol四氯化钛时转移电子的物质的量为________ mol。
(3)利用四氯化钛制备TiO2.xH2O时,需加入大量的水并加热的目的是____________ 。
(4)钛广泛用于航天领域。氩气在冶炼钛的流程中的作用是______________________ 。
(5)利用CO和H2制备甲醇。
①已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol。写出CO和H2制备甲醇的热化学方程式___________________________ 。
②假设联合生产中各原料利用率为100%,若得到6mol甲醇,则只需再补充标准状况下的H2________ L。

回答下列问题:
(1)写出以石墨为电极电解饱和食盐水的化学方程式
(2)写出钛铁矿在高温下与焦炭经氯化得四氯化钛的化学方程式
(3)利用四氯化钛制备TiO2.xH2O时,需加入大量的水并加热的目的是
(4)钛广泛用于航天领域。氩气在冶炼钛的流程中的作用是
(5)利用CO和H2制备甲醇。
①已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol。写出CO和H2制备甲醇的热化学方程式
②假设联合生产中各原料利用率为100%,若得到6mol甲醇,则只需再补充标准状况下的H2
您最近半年使用:0次
计算题
|
适中
(0.65)
【推荐1】过氧化钙晶体(CaO2·8H2O)可用于改善地表水质、处理含重金属粒子废水、应急供氧等。
(1)已知:I2+2 =2I-+
=2I-+ ,测定制备的过氧化钙晶体中CaO2的含量的实验步骤如下:
,测定制备的过氧化钙晶体中CaO2的含量的实验步骤如下:
第一步:准确称取a g产品放入锥形瓶中,再加入过量的b g KI晶体,加入适量蒸馏水溶解,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。第二步:向上述锥形瓶中加入几滴淀粉溶液。第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液发生反应,滴定达到终点时出现的现象是___________ 。若滴定消耗Na2S2O3溶液V mL,则样品中CaO2的质量分数为___________ (用字母表示)。
(2)已知过氧化钙加热至350 ℃左右开始分解放出氧气。将过氧化钙晶体(CaO2·8H2O)在坩埚中加热逐渐升高温度,测得样品质量随温度的变化如图所示,则350 ℃左右所得固体物质的化学式为___________ 。

(1)已知:I2+2
 =2I-+
=2I-+ ,测定制备的过氧化钙晶体中CaO2的含量的实验步骤如下:
,测定制备的过氧化钙晶体中CaO2的含量的实验步骤如下:第一步:准确称取a g产品放入锥形瓶中,再加入过量的b g KI晶体,加入适量蒸馏水溶解,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。第二步:向上述锥形瓶中加入几滴淀粉溶液。第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液发生反应,滴定达到终点时出现的现象是
(2)已知过氧化钙加热至350 ℃左右开始分解放出氧气。将过氧化钙晶体(CaO2·8H2O)在坩埚中加热逐渐升高温度,测得样品质量随温度的变化如图所示,则350 ℃左右所得固体物质的化学式为

您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐2】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到固体TiO2。实验室用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_________________________________ 。
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________________ 。
(3)NH4Fe(SO4)2标准溶液盛装在___________ (填“酸式”或“碱式”)滴定管中,滴定终点的现象是________________________ 。若在滴定终点读取滴定管刻度时,仰视标准液液面使测定结果________ (填“偏高”“偏低”或“无影响”)。
(4)滴定分析时,称取TiO2(摩尔质量为Mg·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数表达式为__________________________ 。
(1)TiCl4水解生成TiO2·xH2O的化学方程式为
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是
(3)NH4Fe(SO4)2标准溶液盛装在
(4)滴定分析时,称取TiO2(摩尔质量为Mg·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数表达式为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】无水AlCl3是一种重要的化工原料。某课外活动小组尝试制取无水AlCl3并进行相关探究。
资料信息:无水AlCl3在178℃升华,极易潮解,遇到潮湿空气会产生白色烟雾。
【探究一】无水AlCl3的实验室制备
利用下图装置,用干燥、纯净的氯气在加热条件下与纯铝粉反应制取无水AlCl3。供选择的药品:①铝粉②浓硫酸③稀盐酸④饱和食盐水⑤二氧化锰粉末⑥无水氯化钙⑦稀硫酸⑧浓盐酸⑨氢氧化钠溶液。
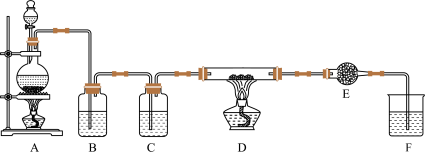
(1)写出装置A发生的反应方程式__________ 。
(2)装置E需用到上述供选药品中的________ (填数字序号),装置F的作用是__________ 。
(3)写出无水AlCl3遇到潮湿空气发生反应的化学方程式__________ 。
【探究二】离子浓度对氯气制备的影响
探究二氧化锰粉末和浓盐酸的反应随着盐酸的浓度降低,反应会停止的原因:
(4)提出假设:假设1.Cl-浓度降低影响氯气的生成;假设2.__________ 。
(5)设计实验方案:(限选试剂:浓H2SO4、NaCl固体、MnO2固体、稀盐酸)
【探究三】无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如下:
(6)根据表中数据,计算所得固体中无水AlCl3的质量分数_________ 。
(7)有人认为D中制得无水AlCl3的质量分数偏低,可能的一种原因是__________ 。
资料信息:无水AlCl3在178℃升华,极易潮解,遇到潮湿空气会产生白色烟雾。
【探究一】无水AlCl3的实验室制备
利用下图装置,用干燥、纯净的氯气在加热条件下与纯铝粉反应制取无水AlCl3。供选择的药品:①铝粉②浓硫酸③稀盐酸④饱和食盐水⑤二氧化锰粉末⑥无水氯化钙⑦稀硫酸⑧浓盐酸⑨氢氧化钠溶液。

(1)写出装置A发生的反应方程式
(2)装置E需用到上述供选药品中的
(3)写出无水AlCl3遇到潮湿空气发生反应的化学方程式
【探究二】离子浓度对氯气制备的影响
探究二氧化锰粉末和浓盐酸的反应随着盐酸的浓度降低,反应会停止的原因:
(4)提出假设:假设1.Cl-浓度降低影响氯气的生成;假设2.
(5)设计实验方案:(限选试剂:浓H2SO4、NaCl固体、MnO2固体、稀盐酸)
| 步骤 | 实验操作 | 预测现象和结论 |
| ① | 往不再产生氯气的装置中,加入 | 若有黄绿色气体生成,则假设1成立 |
| ② | 若有黄绿色气体生成,则假设2成立 |
【探究三】无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如下:
| 第一次实验 | 第二次实验 | 第三次实验 | |
| D中固体用量 | 2.0g | 2.0g | 2.0g |
| 氢气的体积 | 334.5mL | 336.0mL | 337.5mL |
(7)有人认为D中制得无水AlCl3的质量分数偏低,可能的一种原因是
您最近半年使用:0次



