某学习小组用如图所示A、B装置分别探究金属锌与稀硫酸的反应,实验过程中A装置烧杯内的溶液温度升高,B装置的电流计指针发生偏转。
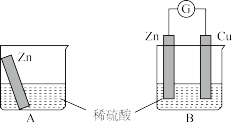
(1)装置B烧杯中发生反应的离子方程式为_______ 。
(2)B装置中锌做_______ 极, 铜做_______ 极 (填“正”或“负”)。电子由_______ 极流向_______ 极 (填“Zn”或“Cu”)
(3)Cu板上的现象是_______ ,发生的电极反应是_______ 。
(4)该小组同学反思原电池的原理,其中观点正确的是_______(填字母)。

(1)装置B烧杯中发生反应的离子方程式为
(2)B装置中锌做
(3)Cu板上的现象是
(4)该小组同学反思原电池的原理,其中观点正确的是_______(填字母)。
| A.原电池反应的过程中可能没有电子发生转移 |
| B.原电池装置需要2个电极 |
| C.电极一定不能参加反应 |
| D.氧化反应和还原反应可以拆开在两极发生 |
更新时间:2022/08/18 15:53:30
|
相似题推荐
填空题
|
较易
(0.85)
解题方法
【推荐1】根据氧化还原反应Cu + 2Ag+ = Cu2+ + 2Ag设计一个原电池?并判断正负极、写出各电极电极反应方程和反应的类型(在方框内画出原电池装置图)____
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】人们应用原电池原理制作了多种电池,以满足不同的需要。以下各种电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息填空:
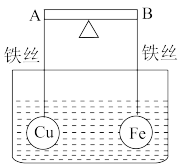
(1)如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央铁丝滴入浓CuSO4溶液,(实验过程中,不考虑铁丝反应及两球的浮力变化)一段时间后,当杠杆为绝缘体时,_______ (填 “A”或“B”,下同)端高;当杠杆为导体时, _______ 端高。
(2)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,反应过程的离子方程式为_______ ,若将此反应设计成原电池,则负极所用电极材料为_______ (填元素符号),正极反应式为_______ 。
(3)科学家利用下图所示电池装置可以将CO2转化为气体燃料CO。
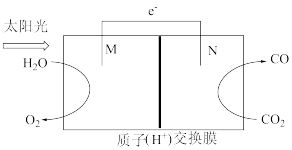
①该装置工作时,N电极为_______ (填“正极”或“负极)。
②外电路中,电子流向为_______ (填“M→N”或“N→M”)。
③理论上生成1mol O2的同时,流经导线的电子有_______ mol。
(1)如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央铁丝滴入浓CuSO4溶液,(实验过程中,不考虑铁丝反应及两球的浮力变化)一段时间后,当杠杆为绝缘体时,

(2)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,反应过程的离子方程式为
(3)科学家利用下图所示电池装置可以将CO2转化为气体燃料CO。

①该装置工作时,N电极为
②外电路中,电子流向为
③理论上生成1mol O2的同时,流经导线的电子有
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】如图所示,是原电池的装置图。请回答:
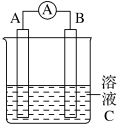
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极的材料是_________ (选锌或铜);反应进行一段时间后溶液C的浓度将________ (填“升高”“降低”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则正极电极反应式_________ ,溶液C是________ 。
(3)若C为CuCl2溶液,Zn是________ 极,Cu极发生________ 反应,电极反应为_________ 。反应过程溶液中c(Cu2+)________ (填“变大”“变小”或“不变”)。
(4)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
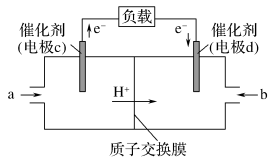
电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是_______ (填“正极”或“负极”),c电极的反应方程式为_______ 。d电极反应式______ ,若线路中转移6mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为________ L。

(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极的材料是
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则正极电极反应式
(3)若C为CuCl2溶液,Zn是
(4)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】由Zn—Cu—H2SO4组成的原电池,工作一段时间后,锌片的质量减少了6.5g。求:
(1)原电池的_______ 极生成氢气_______ L(标准状况)。
(2)已知:1mol氢气完全燃烧放出285.8kJ的热量。将(1)中获得的氢气燃烧,可以得到_________ kJ的热量。
(3)若将电解质溶液改为硫酸铜溶液,当电池输出相同的电量时,电池两极的质量差为_____________ 。
(1)原电池的
(2)已知:1mol氢气完全燃烧放出285.8kJ的热量。将(1)中获得的氢气燃烧,可以得到
(3)若将电解质溶液改为硫酸铜溶液,当电池输出相同的电量时,电池两极的质量差为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】电池的发展是化学对人类的一项重大贡献。用图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流计。请回答下列问题:
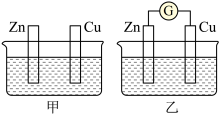
(1)以下叙述中,正确的是___________ (填选项字母)。
a.甲中锌片是负极,乙中铜片是正极 b.两烧杯中铜片表面均有气泡产生
c.两烧杯中溶液的 均减小 d.乙中电流从铜片经导线流向锌片
均减小 d.乙中电流从铜片经导线流向锌片
(2)乙装置中负极的电极反应式为:___________ ;当乙中产生1.12L(标准状况)气体时,通过导线的电子数为___________  。
。
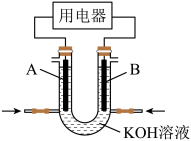
(3)将 与
与 的燃烧反应设计成燃料电池,装置如图所示(A、B为多孔碳棒)。实验测得
的燃烧反应设计成燃料电池,装置如图所示(A、B为多孔碳棒)。实验测得 定向移向A电极,则A电极入口通
定向移向A电极,则A电极入口通________ 气体(填“ ”或“
”或“ ”)。该装置中实现的能量转化关系为
”)。该装置中实现的能量转化关系为________ 。
(4)在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯中加水,则灯泡会亮起来。
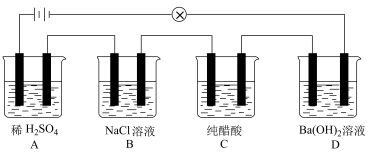
请问:①哪个烧杯中液体加水灯泡会亮起来?为什么?___________ ,___________ 。
②哪两个烧杯中液体混合后导电能力会显著减弱?为什么?___________ ,___________ 。

(1)以下叙述中,正确的是
a.甲中锌片是负极,乙中铜片是正极 b.两烧杯中铜片表面均有气泡产生
c.两烧杯中溶液的
 均减小 d.乙中电流从铜片经导线流向锌片
均减小 d.乙中电流从铜片经导线流向锌片(2)乙装置中负极的电极反应式为:
 。
。(3)将
 与
与 的燃烧反应设计成燃料电池,装置如图所示(A、B为多孔碳棒)。实验测得
的燃烧反应设计成燃料电池,装置如图所示(A、B为多孔碳棒)。实验测得 定向移向A电极,则A电极入口通
定向移向A电极,则A电极入口通 ”或“
”或“ ”)。该装置中实现的能量转化关系为
”)。该装置中实现的能量转化关系为
(4)在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯中加水,则灯泡会亮起来。

请问:①哪个烧杯中液体加水灯泡会亮起来?为什么?
②哪两个烧杯中液体混合后导电能力会显著减弱?为什么?
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】根据组成原电池的条件,试以反应:Fe+Cu2+=Fe2++Cu设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在方框中)。_________________
供选用的电解质溶液有:稀硫酸、硫酸铜溶液
供选用的电极材料有:锌片、铜片、铁片
电极材料及电极反应式:
负极材料:______________ ,电极反应式:___________________ ,
正极材料:______________ ,电极反应式:___________________ ,
电解质溶液:__________________ 。
供选用的电解质溶液有:稀硫酸、硫酸铜溶液
供选用的电极材料有:锌片、铜片、铁片
电极材料及电极反应式:
负极材料:
正极材料:
电解质溶液:
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】如图,将锌片、C棒通过导线相连,置于稀硫酸中。
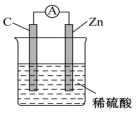
(1)该装置工作时,溶液中的SO 向①
向①____ 极(填“C”或“Zn”)移动;电子沿导线流入②____ 极(填“C”或“Zn”)。
(2)C电极为①____ (填“正极”或“负极”),其电极反应式为②____ ;Zn电极为③_____ (填“正极”或“负极”),其电极反应式为④____ 。总反应式为⑤_____ 。

(1)该装置工作时,溶液中的SO
 向①
向①(2)C电极为①
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】从某铝镁合金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象。(请依次写出)
(2)开始时产生气泡的速率较慢的原因是________________________________ 。后来的反应速率相当快的原因是___________________________________ 。
(3)写出所形成的原电池的负极材料名称:________________________________
电极反应式:____________________________________
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据:_______________________ (请逐一写出)
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象。(请依次写出)
(2)开始时产生气泡的速率较慢的原因是
(3)写出所形成的原电池的负极材料名称:
电极反应式:
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据:
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】据图回答下列问题:
(1)如甲图所示,若烧杯中溶液为氢氧化钠溶液,则负极为___________ (填Mg或Al),总反应离子方程式为___________ 。

(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如乙图所示:A、B两个电极均由多孔的碳块组成。该电池的负极反应式为:___________ 。该电池的正极反应式为:___________ 。

(3)如果将乙图装置中通入的H2改成CH4气体,也可以组成一个原电池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为:___________ 。
(4)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如丙图所示。根据图中数据,试填写下列空白:
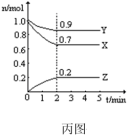
①该反应的化学方程式为___________ ;
②从开始至2min,Z的平均反应速率为___________ ;
③若X、Y、Z均为气体,反应达平衡时体系的压强是开始时的___________ 倍。
④下列叙述能说明该反应已达到化学平衡状态的是(填标号)___________ ;
A.容器内压强不再发生变化
B.X的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmol的Z的同时消耗nmol的Y
E.相同时间内消耗nmol的Y的同时消耗3nmol的X
(1)如甲图所示,若烧杯中溶液为氢氧化钠溶液,则负极为

(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如乙图所示:A、B两个电极均由多孔的碳块组成。该电池的负极反应式为:

(3)如果将乙图装置中通入的H2改成CH4气体,也可以组成一个原电池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为:
(4)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如丙图所示。根据图中数据,试填写下列空白:

①该反应的化学方程式为
②从开始至2min,Z的平均反应速率为
③若X、Y、Z均为气体,反应达平衡时体系的压强是开始时的
④下列叙述能说明该反应已达到化学平衡状态的是(填标号)
A.容器内压强不再发生变化
B.X的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmol的Z的同时消耗nmol的Y
E.相同时间内消耗nmol的Y的同时消耗3nmol的X
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
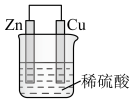
【推荐1】如图所示将锌、铜通过导线相连,置于硫酸溶液中。___________ 能转化为___________ 能。
(2)Zn电极为___________ 极,发生___________ (填“氧化”或“还原”)反应,电极方程式为___________ 。
(3)外电路电流由___________ (填“锌”或“铜”)电极经导线施向另一电极。
(4)标准状况下,若反应过程中溶解了6.5g锌,则生成的氢气的体积为___________ 。
(2)Zn电极为
(3)外电路电流由
(4)标准状况下,若反应过程中溶解了6.5g锌,则生成的氢气的体积为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】按要求回答下列问题
(1)①甲烷的电子式是___________ ,
②写出乙炔的结构式_____
(2)写出铜和稀硝酸反应的化学方程式_____
(3)写出由乙烷制一氯乙烷的化学方程式_____
(4)水的沸点比硫化氢的沸点高,原因是_____
(5) 燃料电池以KOH溶液为电解质溶液,其总反应式为
燃料电池以KOH溶液为电解质溶液,其总反应式为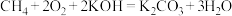 ,写出负极的电极反应式
,写出负极的电极反应式_____
(1)①甲烷的电子式是
②写出乙炔的结构式
(2)写出铜和稀硝酸反应的化学方程式
(3)写出由乙烷制一氯乙烷的化学方程式
(4)水的沸点比硫化氢的沸点高,原因是
(5)
 燃料电池以KOH溶液为电解质溶液,其总反应式为
燃料电池以KOH溶液为电解质溶液,其总反应式为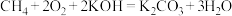 ,写出负极的电极反应式
,写出负极的电极反应式
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:
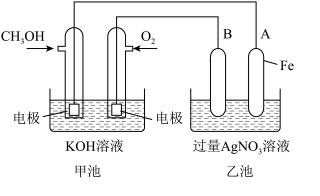
(1)充电时,原电池的负极与电源___ 极相连。乙池中阳极的电极反应为___ 。
(2)放电时:负极的电极反应式为___ 。
(3)在此过程中若完全反应,乙池中A极的质量增加648 g,则甲池中理论上消耗O2___ L(标准状况下)。
(4)若在常温常压下,1gCH3OH燃烧生成CO2和液态H2O时放热22.68kJ,表示甲醇燃烧热的热化学方程式为___ 。

(1)充电时,原电池的负极与电源
(2)放电时:负极的电极反应式为
(3)在此过程中若完全反应,乙池中A极的质量增加648 g,则甲池中理论上消耗O2
(4)若在常温常压下,1gCH3OH燃烧生成CO2和液态H2O时放热22.68kJ,表示甲醇燃烧热的热化学方程式为
您最近一年使用:0次



