元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,思考扇形元素周期表的填充规律,回答下列问题:
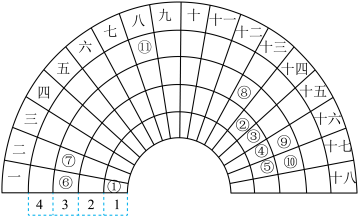
(1)写出⑪在长式周期表中的位置______________ 。
(2)在①~⑪元素中,金属性最强的是___ ,在元素④⑥⑨形成的简单离子半径由小到大的顺序是____ (用离子符号表示)。
(3)①~⑪中元素最高价氧化物对应水化物中酸性最强的是_____________ (填化学式)。写出⑥和⑧的最高价氧化物对应水化物反应的离子方程式______________________________ 。
(4)用电子式表示⑦和⑩形成的化合物的过程______________________________________ 。
(5)表中元素④和⑥可以形成一种淡黄色物质X,0.1 mol X与水反应转移电子数为______ 。
(6)表中元素③和⑤可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到8电子稳定结构,Y的电子式_________________________________ 。

(1)写出⑪在长式周期表中的位置
(2)在①~⑪元素中,金属性最强的是
(3)①~⑪中元素最高价氧化物对应水化物中酸性最强的是
(4)用电子式表示⑦和⑩形成的化合物的过程
(5)表中元素④和⑥可以形成一种淡黄色物质X,0.1 mol X与水反应转移电子数为
(6)表中元素③和⑤可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到8电子稳定结构,Y的电子式
更新时间:2019/06/04 08:32:45
|
【知识点】 元素非金属性强弱的比较方法解读
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如图所示。
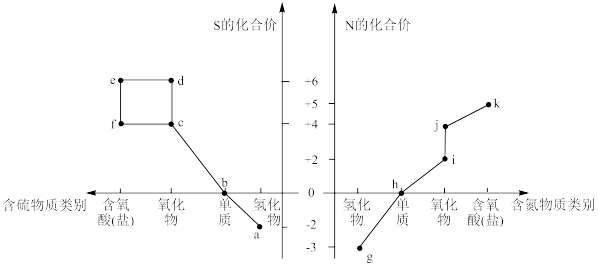
回答下列问题:
(1)h的电子式为_______ 。
(2)下列有关a和g的叙述中,能说明N的非金属性比S强的是_______ (填序号)。
A.物质a的水溶液为酸性,而物质g的水溶液为碱性
B.物质a在300℃左右分解生成b,而物质g分解生成h的温度高于300℃
C.物质a液化的温度为-60℃,而物质g液化的温度为-34℃
(3)将 的物质k的稀溶液倒入物质f的溶液中,会生成物质e,该反应的离子方程式是
的物质k的稀溶液倒入物质f的溶液中,会生成物质e,该反应的离子方程式是_______ 。
(4) (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质g通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质g通入 的
的 浓液中,可制得该物质:
浓液中,可制得该物质: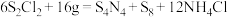 (已知
(已知 是硫单质中最稳定的)。
是硫单质中最稳定的)。
①上述制备反应中被氧化的元素是_______ (填元素符号),物质g体现的性质有_______ 。
② 在常温下较稳定,但撞击或加热时会引起爆炸,生成非常稳定的单质产物,该爆炸反应的化学方程式是
在常温下较稳定,但撞击或加热时会引起爆炸,生成非常稳定的单质产物,该爆炸反应的化学方程式是_______ 。

回答下列问题:
(1)h的电子式为
(2)下列有关a和g的叙述中,能说明N的非金属性比S强的是
A.物质a的水溶液为酸性,而物质g的水溶液为碱性
B.物质a在300℃左右分解生成b,而物质g分解生成h的温度高于300℃
C.物质a液化的温度为-60℃,而物质g液化的温度为-34℃
(3)将
 的物质k的稀溶液倒入物质f的溶液中,会生成物质e,该反应的离子方程式是
的物质k的稀溶液倒入物质f的溶液中,会生成物质e,该反应的离子方程式是(4)
 (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质g通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质g通入 的
的 浓液中,可制得该物质:
浓液中,可制得该物质: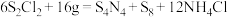 (已知
(已知 是硫单质中最稳定的)。
是硫单质中最稳定的)。①上述制备反应中被氧化的元素是
②
 在常温下较稳定,但撞击或加热时会引起爆炸,生成非常稳定的单质产物,该爆炸反应的化学方程式是
在常温下较稳定,但撞击或加热时会引起爆炸,生成非常稳定的单质产物,该爆炸反应的化学方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。

(1)Y的分子式________ 。
(2)图中X的电子式为_________ ;其水溶液长期在空气中放置容易变浑浊,原因是______________________ (用化学方程式表示)。该变化体现出:S非金属性比O__________ (填“强”或“弱”)。用原子结构解释原因:同主族元素最外层电子数相同,从上到下,__________ ,得电子能力逐渐减弱。
(3) Z与图表中某物质反应生成SO2的化学方程式_____________________________ 。

(1)Y的分子式
(2)图中X的电子式为
(3) Z与图表中某物质反应生成SO2的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】填空
(1)短周期元素 、
、 、
、 、
、 、
、 原子序数依次增大。基态
原子序数依次增大。基态 、
、 、
、 原子均有两个单电子,
原子均有两个单电子, 简单离子在同周期离子中半径最小,
简单离子在同周期离子中半径最小, 与
与 同主族。
同主族。
(ⅰ)基态 原子核外有
原子核外有_____ 种不同空间运动状态的电子。
(ⅱ) 、
、 、
、 三种元素中,电负性由大到小的顺序为
三种元素中,电负性由大到小的顺序为_____ (填元素符号)。
(ⅲ)关于元素 、
、 、
、 、
、 、
、 及其化合物,下列说法正确的是
及其化合物,下列说法正确的是_____ 。
a.第一电离能的大小可以作为判断以上元素金属性强弱的依据
b.电负性的大小可以作为判断以上元素非金属性强弱的依据
c.最高价氧化物的水化物分子中, 原子采取
原子采取 杂化
杂化
d. 原子为中心原子且
原子为中心原子且 杂化的,其分子的空间结构一定为直线形
杂化的,其分子的空间结构一定为直线形
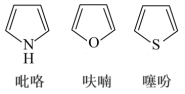
(2)杂环化合物构成环的原子除碳原子外,还至少含有一个杂原子。最常见的杂原子是氮原子、氧原子、硫原子。杂环化合物普遍存在于药物分子的结构之中。 键数目是
键数目是_____ 个。
(ⅱ)噻吩沸点低于吡咯的原因是_____ 。
(ⅲ)图 、
、 、
、 分别表示
分别表示 、
、 、
、 和
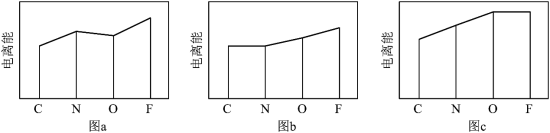
和 的逐级电离能
的逐级电离能 变化趋势(纵坐标的标度不同)。表示第一电离能的变化的是图
变化趋势(纵坐标的标度不同)。表示第一电离能的变化的是图_____ (填 、
、 或
或 )。
)。 的键角
的键角_____  的键角(填“大于”或“小于”)。
的键角(填“大于”或“小于”)。
(1)短周期元素
 、
、 、
、 、
、 、
、 原子序数依次增大。基态
原子序数依次增大。基态 、
、 、
、 原子均有两个单电子,
原子均有两个单电子, 简单离子在同周期离子中半径最小,
简单离子在同周期离子中半径最小, 与
与 同主族。
同主族。(ⅰ)基态
 原子核外有
原子核外有(ⅱ)
 、
、 、
、 三种元素中,电负性由大到小的顺序为
三种元素中,电负性由大到小的顺序为(ⅲ)关于元素
 、
、 、
、 、
、 、
、 及其化合物,下列说法正确的是
及其化合物,下列说法正确的是a.第一电离能的大小可以作为判断以上元素金属性强弱的依据
b.电负性的大小可以作为判断以上元素非金属性强弱的依据
c.最高价氧化物的水化物分子中,
 原子采取
原子采取 杂化
杂化d.
 原子为中心原子且
原子为中心原子且 杂化的,其分子的空间结构一定为直线形
杂化的,其分子的空间结构一定为直线形(2)杂环化合物构成环的原子除碳原子外,还至少含有一个杂原子。最常见的杂原子是氮原子、氧原子、硫原子。杂环化合物普遍存在于药物分子的结构之中。
 键数目是
键数目是(ⅱ)噻吩沸点低于吡咯的原因是
(ⅲ)图
 、
、 、
、 分别表示
分别表示 、
、 、
、 和
和 的逐级电离能
的逐级电离能 变化趋势(纵坐标的标度不同)。表示第一电离能的变化的是图
变化趋势(纵坐标的标度不同)。表示第一电离能的变化的是图 、
、 或
或 )。
)。
 的键角
的键角 的键角(填“大于”或“小于”)。
的键角(填“大于”或“小于”)。
您最近一年使用:0次



