大理石、石灰石中主要成分是CaCO3,碳酸钙在工业生产,生活及化学实验室中均有大量的应用。实验室利用大理石并采用下列装置来制取CO2
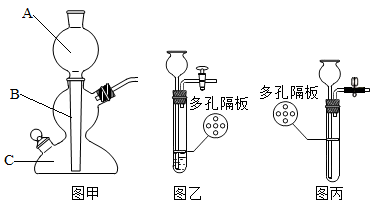
① 若采用图甲发生装置,则块状大理石应放在________ (填写A、B、C编号),若用图丙装置进行反应,使过程中不足之处是_____
② 某种大理石含CaCO3的质量分数为0.8,用该大理石100g与足量盐酸反应制取二氧化碳,(杂志不与盐酸反应,写出计算过程)
求:该大理石中含CaCO3多少克?________
反应中最多可得到的二氧化碳为多少摩尔?________
实验室利用石灰石(含有加热不分解的杂质)进行如下实验:
③ 实验室利用如图装置模拟工业上石灰石的分解,为了充分反应,实验选用_______ (填“块”或“粉末”)状的石灰石,分解得到的氧化钙的用途之一是_________
④ 实验过程中,为验证石灰石分解,可将导管伸入_______ 溶液中,发生的化学方程式是_____________
⑤ 实验完毕,待固体冷却后,为验证石灰石是否完全分解,切实可行的操作是___________ (选填编号)
A. 加入稀盐酸,观察是否有气泡产生
B. 加入大量水,观察是否放热
C. 称量固体,固体食量减少
D. 加大量水,观察是否有不溶物存在

① 若采用图甲发生装置,则块状大理石应放在
② 某种大理石含CaCO3的质量分数为0.8,用该大理石100g与足量盐酸反应制取二氧化碳,(杂志不与盐酸反应,写出计算过程)
求:该大理石中含CaCO3多少克?
反应中最多可得到的二氧化碳为多少摩尔?
实验室利用石灰石(含有加热不分解的杂质)进行如下实验:

③ 实验室利用如图装置模拟工业上石灰石的分解,为了充分反应,实验选用
④ 实验过程中,为验证石灰石分解,可将导管伸入
⑤ 实验完毕,待固体冷却后,为验证石灰石是否完全分解,切实可行的操作是
A. 加入稀盐酸,观察是否有气泡产生
B. 加入大量水,观察是否放热
C. 称量固体,固体食量减少
D. 加大量水,观察是否有不溶物存在
更新时间:2017/02/28 15:05:33
|
相似题推荐
【推荐1】纯碱(碳酸钠)和食盐悬厨房中常用物质,现有一包自色固体,可能由Na2CO3和NaCl中的一种或两种组成,某科学小组同学展开了系列拓展性研究。
(一)定性分析
(实验目的)确定自色固体的组成
(实验方案)
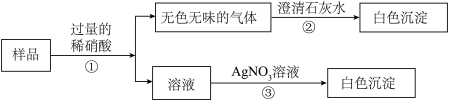
(1)实验结论:该白色固体由_______ 物质组成。
(2)实验步骤①中选用稀硝酸而不用稀盐酸的原因是:_______ 。
(二)定量分析
(实验目的)测定该白色固体中Na2CO3的质量分数
(实验方案)用气体法测定样品中Na2CO3的质量分数。称量E装置质量为50.00g,按下图组装后,将10.00g样品放入锥形瓶中,加入足量稀硫酸,待锥形瓶中不再产生气泡后,称量装置E质量为53.52g(不考虑原装置内空气对实验的影响),实验装置如下:信息资料:碱石灰的主要成分为NaOH和CaO固体,可以吸收H2O和CO2。
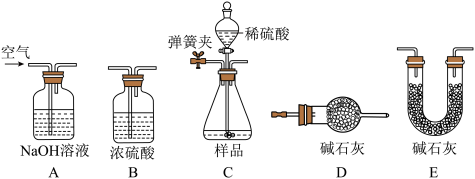
(3)用上述装置完成本实验的连接顺序是A→________ →_______ →_______ →D(填字母编号,不重复使用)
(4)若缺少D装置,则测得碳酸钠的质量分数将____________ (填“偏大”、“偏小”、“不变”)。
(5)C装置中不再产生气泡后,称量前,还需要进行的实验操作是____________ 。
(6)利用实验中测得的数据,计算白色固体中Na2CO3的质量分数为____________ 。
(一)定性分析
(实验目的)确定自色固体的组成
(实验方案)

(1)实验结论:该白色固体由
(2)实验步骤①中选用稀硝酸而不用稀盐酸的原因是:
(二)定量分析
(实验目的)测定该白色固体中Na2CO3的质量分数
(实验方案)用气体法测定样品中Na2CO3的质量分数。称量E装置质量为50.00g,按下图组装后,将10.00g样品放入锥形瓶中,加入足量稀硫酸,待锥形瓶中不再产生气泡后,称量装置E质量为53.52g(不考虑原装置内空气对实验的影响),实验装置如下:信息资料:碱石灰的主要成分为NaOH和CaO固体,可以吸收H2O和CO2。

(3)用上述装置完成本实验的连接顺序是A→
(4)若缺少D装置,则测得碳酸钠的质量分数将
(5)C装置中不再产生气泡后,称量前,还需要进行的实验操作是
(6)利用实验中测得的数据,计算白色固体中Na2CO3的质量分数为
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐2】化学是一门以实验为基础的科学,结合实验装置回答下列问题。______ ,b的名称是______ 。
(2)实验室用高锰酸钾制取氧气应选择的一套装置为______ (填字母代号);该反应的化学方程式为______ 。可用G装置采用排空气法收集氧气,气体从a管口通入。请将G装置内的导管补画完整______ 。
(4)实验室常用金属和稀硫酸制取氢气,应选择______ 。(写一套即可)
(5)称取12.5g石灰石(杂质不参与反应)放入烧杯中,再加入50g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质总质量为58.1g,由此计算石灰石中碳酸钙的质量。

(2)实验室用高锰酸钾制取氧气应选择的一套装置为

(4)实验室常用金属和稀硫酸制取氢气,应选择
(5)称取12.5g石灰石(杂质不参与反应)放入烧杯中,再加入50g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质总质量为58.1g,由此计算石灰石中碳酸钙的质量。
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐3】(本草纲目》记载了铜青的形成过程。铜青主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO3,溶于酸生成相应的铜盐。回答下列问题:
(1)铜青的形成过程中,涉及的反应为2Cu+CO2+H2O+X=Cu2(OH)2CO3,则物质X为______ (填化学式)。
(2)取100g铜青,加入稀硫酸至不再产生气体,收集到17.6g气体,反应后溶液总质量与加入稀硫酸的质量关系如图所示,反应的化学方程式为:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O(杂质不溶于水也不与酸反应)。___________ 。计算出铜青肖中Cu2(OH)2CO3的质量分数_______ 。(写出计算过程,结果保M一位小数)。
(3)写出一种保护铜制品的方法:_____________ 。
(1)铜青的形成过程中,涉及的反应为2Cu+CO2+H2O+X=Cu2(OH)2CO3,则物质X为
(2)取100g铜青,加入稀硫酸至不再产生气体,收集到17.6g气体,反应后溶液总质量与加入稀硫酸的质量关系如图所示,反应的化学方程式为:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O(杂质不溶于水也不与酸反应)。

(3)写出一种保护铜制品的方法:
您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐1】化学是以实验为基础的科学,实验是科学探究的重要手段。
Ⅰ.氧气的制备和性质是重要的化学实验。
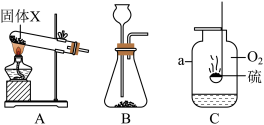
(1)装置A、B都可以用于实验室制备 ,固体X为
,固体X为_____ (填化学式)和 ,装置B中发生反应的化学方程式为
,装置B中发生反应的化学方程式为_________ 。
(2)装置C中仪器a的名称是____ ,该实验可观察到:发出蓝紫色火焰,同时生成一种有_______ 气味的气体。
Ⅱ.制备二氧化碳并探究其性质。
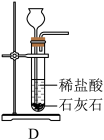
(3)用装置D制备二氧化碳。
①试管中发生反应的化学方程式为_______________ 。
②将块状石灰石放入试管的操作是______________ 。
(4)将二氧化碳通入水中一段时间,向所得溶液滴入紫色石蕊溶液,溶液变___ 色。
Ⅲ.制取氧气
(5)实验室用加热高锰酸钾的方法制取氧气,若要制取1.6g氧气,理论上需要高锰酸钾的质量是多少?(写出计算过程)
Ⅰ.氧气的制备和性质是重要的化学实验。

(1)装置A、B都可以用于实验室制备
 ,固体X为
,固体X为 ,装置B中发生反应的化学方程式为
,装置B中发生反应的化学方程式为(2)装置C中仪器a的名称是
Ⅱ.制备二氧化碳并探究其性质。

(3)用装置D制备二氧化碳。
①试管中发生反应的化学方程式为
②将块状石灰石放入试管的操作是
(4)将二氧化碳通入水中一段时间,向所得溶液滴入紫色石蕊溶液,溶液变
Ⅲ.制取氧气
(5)实验室用加热高锰酸钾的方法制取氧气,若要制取1.6g氧气,理论上需要高锰酸钾的质量是多少?(写出计算过程)
您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐2】采用适当的试剂,从石灰石(主要成分为CaCO3)获得高纯度CaCO3的流程如图1。
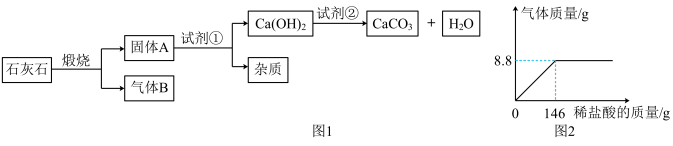
(1)写出石灰石煅烧的化学方程式_____ ;固体A 与试剂①发生的反应是___ (填“放热”或“吸热”)反应;
(2)图1中可以循环使用的物质是_______ 。
(3)为了测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放入烧杯中,加入稀盐酸进行反应(杂质不参加反应).随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图2所示:计算:样品中碳酸钙的质量分数是_____ 。(写出计算过程)

(1)写出石灰石煅烧的化学方程式
(2)图1中可以循环使用的物质是
(3)为了测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放入烧杯中,加入稀盐酸进行反应(杂质不参加反应).随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图2所示:计算:样品中碳酸钙的质量分数是
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐3】根据下列装置图回答问题:_______ ;②_______ 。
(2)实验室用氯酸钾和二氧化锰制取O2的反应方程式为________ 。
(3)①实验室制取CO2的反应方程式为_______ ,常选用_________ (填装置序号)收集CO2。
②用装置C制取CO2,连接装置C、G(竖直放置),当试管中发生反应一段时间后观察到______ (填“甲”或“乙”)处燃着的火柴先熄灭,由实验现象可推知CO2具有的物理性质是________ ;若要停止产生CO2,进行的操作是________ 。
(4)下图是以H2O2溶液为原料制备O2的改进装置,用铂丝(可上下抽动)作催化剂,安全管下端浸没于H2O2溶液中,完成相应的探究实验。将铂丝插入溶液,立即产生O2。________ 。
②均匀微热燃烧管,观察白磷燃烧而红磷不燃烧,由此说明燃烧需要的条件是_________ 。
③取100g H2O2溶液加入上述改进装置的烧瓶中,完全反应后,测得生成3.2gO2。计算100g H2O2溶液中H2O2的质量为______ (写出计算过程)。
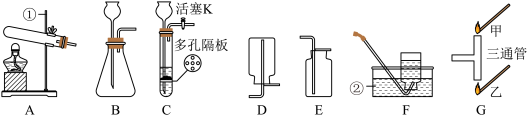
(2)实验室用氯酸钾和二氧化锰制取O2的反应方程式为
(3)①实验室制取CO2的反应方程式为
②用装置C制取CO2,连接装置C、G(竖直放置),当试管中发生反应一段时间后观察到
(4)下图是以H2O2溶液为原料制备O2的改进装置,用铂丝(可上下抽动)作催化剂,安全管下端浸没于H2O2溶液中,完成相应的探究实验。将铂丝插入溶液,立即产生O2。
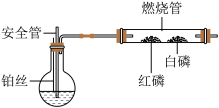
②均匀微热燃烧管,观察白磷燃烧而红磷不燃烧,由此说明燃烧需要的条件是
③取100g H2O2溶液加入上述改进装置的烧瓶中,完全反应后,测得生成3.2gO2。计算100g H2O2溶液中H2O2的质量为
您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐1】酸、碱、盐都是重要的化合物,请回答下列有关问题。
(1)简述怎样稀释浓硫酸________ 。
(2)家中的暖水瓶使用一段时间后,有一层厚厚的水垢,下列最适宜用来除去暖水瓶中水垢的是________ 。
A 食盐水 B 稀硫酸 C 食醋 D 小苏打
(3)酸还可以用于金属除锈,写出用稀硫酸除铁锈的化学方程式________ 。
(4)实验室选用以下装置制取纯净、干燥的 ,并验证其部分性质。
,并验证其部分性质。
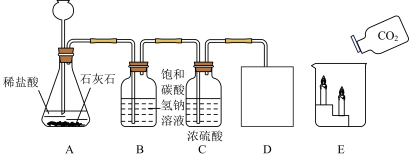
①B装置中发生反应的化学方程式为_____________ 。
②C装置中浓硫酸的作用是________ 。
③请在D中简要补画出 的收集装置图
的收集装置图________ 。
④要证明在E装置中 与NaOH溶液发生了反应,应选用的试剂是
与NaOH溶液发生了反应,应选用的试剂是________ 。
(5)某化学兴趣小组同学欲测定其配制的氯化钠溶液的溶质质量分数。取100g所配制氯化钠溶液,加入足量的硝酸银溶液,生成沉淀经洗涤、干燥后称量为14.35g,试计算该氯化钠溶液的溶质质量分数________ 。
(1)简述怎样稀释浓硫酸
(2)家中的暖水瓶使用一段时间后,有一层厚厚的水垢,下列最适宜用来除去暖水瓶中水垢的是
A 食盐水 B 稀硫酸 C 食醋 D 小苏打
(3)酸还可以用于金属除锈,写出用稀硫酸除铁锈的化学方程式
(4)实验室选用以下装置制取纯净、干燥的
 ,并验证其部分性质。
,并验证其部分性质。
①B装置中发生反应的化学方程式为
②C装置中浓硫酸的作用是
③请在D中简要补画出
 的收集装置图
的收集装置图④要证明在E装置中
 与NaOH溶液发生了反应,应选用的试剂是
与NaOH溶液发生了反应,应选用的试剂是(5)某化学兴趣小组同学欲测定其配制的氯化钠溶液的溶质质量分数。取100g所配制氯化钠溶液,加入足量的硝酸银溶液,生成沉淀经洗涤、干燥后称量为14.35g,试计算该氯化钠溶液的溶质质量分数
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐2】气体的制取是初中化学的重要内容。学校兴趣小组同学进行实验研究。
【活动一】研究氧气的制取____________ 。
(2)实验室用高锰酸钾制氧气选用的发生装置是____________ (填图1字母),反应的化学方程式为____________ ,用图D装置收集的氧气,判断收集满了的方法是____________ 。
(3)化学兴趣小组同学根据所学知识,自制一台“制氧器”,其装置如图3所示。该装置使用甲试剂为白色固体(Na2CO3·3H2O2),作制氧剂;乙试剂为二氧化锰,作催化剂。该制氧机的制氧原理有两步:
第一步:
第二步:____________ (用化学方程式表示)。
由上述资料信息可知,保存Na2CO3·3H2O2应注意_______________ 。
(4)下列有关该装置说法正确的是_______________(填字母)。
【活动二】研究二氧化碳的制取
(5)按如下表进行实验,取等质量的同种大理石加入足量酸中(杂质不与酸反应),产生二氧化碳的体积随时间变化曲线如图4所示。
______________ (选填“甲”、“乙”或“丙”)。小组同学决定用实验Ⅱ的药品制取二氧化碳气体,不用实验Ⅲ药品制备二氧化碳的原因是_______________ 。
(6)实验小组同学在制取二氧化碳时想要控制反应的发生和停止,应选择图1中的_______________ 作发生装置。选择图2为收集装置,检验二氧化碳已收集满的方法为_______________ 。
(7)小明同学将25g鸡蛋壳(鸡蛋壳的主要成分是碳酸钙)洗净、干燥并捣碎后放入锥形瓶里,加入足量的稀盐酸充分反应(假设其他杂质不与盐酸反应),收集到8.8g气体,请帮小明计算鸡蛋壳中碳酸钙的质量分数_______________ 。
【活动一】研究氧气的制取

(2)实验室用高锰酸钾制氧气选用的发生装置是
(3)化学兴趣小组同学根据所学知识,自制一台“制氧器”,其装置如图3所示。该装置使用甲试剂为白色固体(Na2CO3·3H2O2),作制氧剂;乙试剂为二氧化锰,作催化剂。该制氧机的制氧原理有两步:
第一步:

第二步:
由上述资料信息可知,保存Na2CO3·3H2O2应注意
(4)下列有关该装置说法正确的是_______________(填字母)。

| A.此仪器可用于医疗急救,也可用产生的氧气作燃料切割金属 |
| B.过滤仓利用氧气不易溶于水的性质,使氧气湿润 |
| C.过滤仓中气泡的多少可以判断氧气排出的快慢 |
| D.该装置可以随时调控产生氧气的速率 |
【活动二】研究二氧化碳的制取
(5)按如下表进行实验,取等质量的同种大理石加入足量酸中(杂质不与酸反应),产生二氧化碳的体积随时间变化曲线如图4所示。
| 实验编号 | 药品 |
| I | 块状大理石、10%稀硫酸 |
| II | 块状大理石、7%稀盐酸 |
| III | 粉状大理石、7%稀盐酸 |

(6)实验小组同学在制取二氧化碳时想要控制反应的发生和停止,应选择图1中的
(7)小明同学将25g鸡蛋壳(鸡蛋壳的主要成分是碳酸钙)洗净、干燥并捣碎后放入锥形瓶里,加入足量的稀盐酸充分反应(假设其他杂质不与盐酸反应),收集到8.8g气体,请帮小明计算鸡蛋壳中碳酸钙的质量分数
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐3】酸、碱、盐与人类生活和生产关系十分密切,它们是化学研究的重要内容。
(1)氢氧化钠和氢氧化钙等碱类物质具有一些相似的性质,是因为它们在水溶液中都能解离出_________ (填微粒符号)。
(2)某化学小组利用数字化设备,测定氢氧化钠溶液与稀硫酸反应时溶液pH的变化,实验结果如图所示。_________ (填氢氧化钠溶液或稀硫酸)滴入另一种溶液中。
②为区分a点和n点所对应溶液中的溶质,写出你选用的一种试剂(或实验用品)__________ ,但试剂不可选用BaCl2溶液,原因是_________ 。
(3)如图是实验室制取气体的常用实验装置,根据所学知识回答下列问题。_________ 。
②利用过氧化氢溶液和二氧化锰制取并收集一瓶干燥的氧气,A-F中所需装置从左到右的连接顺序为_________ 接_________ 接_________ (填字母序号)。
③装置G中,注入浓NaOH溶液后可观察到气球逐渐胀大,请用化学方程式分析原因_________ 。
(4)为了洗涤某石油产品中残留硫酸,化验室实验员用40g溶质质量分数的10%的氢 氧化钠溶液恰好与100g 硫酸溶液恰好完全反应。请计算该硫酸溶液中溶质的质量分数。
(1)氢氧化钠和氢氧化钙等碱类物质具有一些相似的性质,是因为它们在水溶液中都能解离出
(2)某化学小组利用数字化设备,测定氢氧化钠溶液与稀硫酸反应时溶液pH的变化,实验结果如图所示。
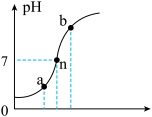
②为区分a点和n点所对应溶液中的溶质,写出你选用的一种试剂(或实验用品)
(3)如图是实验室制取气体的常用实验装置,根据所学知识回答下列问题。
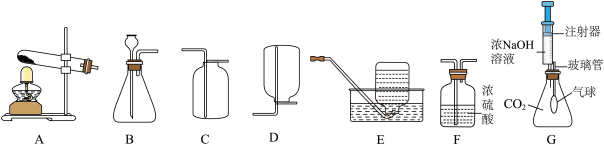
②利用过氧化氢溶液和二氧化锰制取并收集一瓶干燥的氧气,A-F中所需装置从左到右的连接顺序为
③装置G中,注入浓NaOH溶液后可观察到气球逐渐胀大,请用化学方程式分析原因
(4)为了洗涤某石油产品中残留硫酸,化验室实验员用40g溶质质量分数的10%的氢 氧化钠溶液恰好与100g 硫酸溶液恰好完全反应。请计算该硫酸溶液中溶质的质量分数。
您最近一年使用:0次



