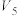名校
1 . 在生产和生活中,人们关注化学反应进行的快慢和程度,以提高生产效率和调控反应条件。
Ⅰ.合成氨的反应对人类解决粮食问题贡献巨大,反应为 。
。
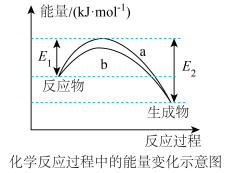
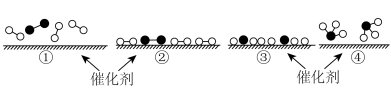
(1)德国化学家F·Haber利用 和
和 在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用
在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用 、
、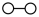 、
、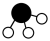 分别
分别 、
、 、
、 。
。_______ 。
A.氢气燃烧 B.氯化铵与 的反应
的反应
C.锌片与稀硫酸的反应 D.钠与冷水的反应
②下列说法正确的是_______ 。
A.使用催化剂,可以加快合成氨的反应速率
B.②→③过程,是吸热过程且只有H-H键断裂
C.③→④过程,N原子和H原子形成了含有极性键的
D.合成氨反应中,反应物断键吸收能量大于生成物成键释放的能量
(2)一定温度下,向恒容的密闭容器中充入一定量的 和
和 发生反应,测得各组分浓度随时间变化如图所示。
发生反应,测得各组分浓度随时间变化如图所示。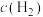 变化的曲线是
变化的曲线是_______ (填“A”“B”或“C”)。
②下列能说明该反应达到平衡状态的是_______ (填序号)。
a.容器中的压强不随时间变化
b.
c.容器中混合气体的密度不随时间变化
d.单位时间内生成3mol 的同时生成2mol
的同时生成2mol
e.容器内 的质量分数不变
的质量分数不变
(3)一定条件下,将2mol 和3mol
和3mol 通入2L的恒容密闭容器中,10min后达到化学平衡,测得
通入2L的恒容密闭容器中,10min后达到化学平衡,测得 的物质的量为2.4mol,则10min内
的物质的量为2.4mol,则10min内 的平均反应速率为
的平均反应速率为_______ , 的转化率是
的转化率是_______ ,混合气中 的物质的量分数是
的物质的量分数是_______ 。
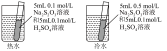
Ⅱ.探究一定条件下反应物浓度对硫代硫酸钠( )与硫酸反应速率的影响。
)与硫酸反应速率的影响。
【查阅资料】
a. 易溶于水,能与硫酸发生反应:
易溶于水,能与硫酸发生反应: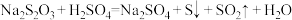
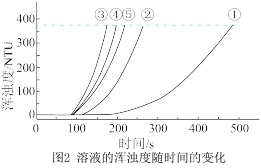
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】
实验数据:
(4)选用浊度计进行测量,原因是 溶液与
溶液与 溶液反应生成了
溶液反应生成了_______ 。
(5)实验③中,x=_______ 。
(6)实验①、②、③的目的是_______ 。
(7)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对 与硫酸反应的化学反应速率的影响,
与硫酸反应的化学反应速率的影响, 溶液浓度的改变影响更大。该推断的证据是
溶液浓度的改变影响更大。该推断的证据是_______ 。
Ⅰ.合成氨的反应对人类解决粮食问题贡献巨大,反应为
 。
。(1)德国化学家F·Haber利用
 和
和 在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用
在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用 、
、 、
、 分别
分别 、
、 、
、 。
。
A.氢气燃烧 B.氯化铵与
 的反应
的反应C.锌片与稀硫酸的反应 D.钠与冷水的反应
②下列说法正确的是
A.使用催化剂,可以加快合成氨的反应速率
B.②→③过程,是吸热过程且只有H-H键断裂
C.③→④过程,N原子和H原子形成了含有极性键的

D.合成氨反应中,反应物断键吸收能量大于生成物成键释放的能量
(2)一定温度下,向恒容的密闭容器中充入一定量的
 和
和 发生反应,测得各组分浓度随时间变化如图所示。
发生反应,测得各组分浓度随时间变化如图所示。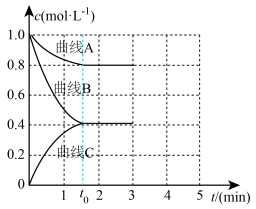
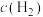 变化的曲线是
变化的曲线是②下列能说明该反应达到平衡状态的是
a.容器中的压强不随时间变化
b.

c.容器中混合气体的密度不随时间变化
d.单位时间内生成3mol
 的同时生成2mol
的同时生成2mol
e.容器内
 的质量分数不变
的质量分数不变(3)一定条件下,将2mol
 和3mol
和3mol 通入2L的恒容密闭容器中,10min后达到化学平衡,测得
通入2L的恒容密闭容器中,10min后达到化学平衡,测得 的物质的量为2.4mol,则10min内
的物质的量为2.4mol,则10min内 的平均反应速率为
的平均反应速率为 的转化率是
的转化率是 的物质的量分数是
的物质的量分数是Ⅱ.探究一定条件下反应物浓度对硫代硫酸钠(
 )与硫酸反应速率的影响。
)与硫酸反应速率的影响。【查阅资料】
a.
 易溶于水,能与硫酸发生反应:
易溶于水,能与硫酸发生反应: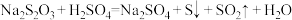
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】
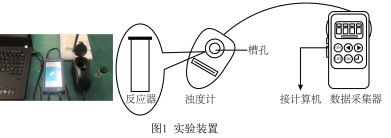
| 实验编号 |  溶液 溶液 |  溶液 溶液 | 蒸馏水 | ||
 | V/mL | 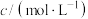 | V/mL | V/mL | |
| ① | 0.1 | 1.5 | 0.1 | 3.5 | 10 |
| ② | 0.1 | 2.5 | 0.1 | 3.5 | 9 |
| ③ | 0.1 | 3.5 | 0.1 | 3.5 | x |
| ④ | 0.1 | 3.5 | 0.1 | 2.5 | 9 |
| ⑤ | 0.1 | 3.5 | 0.1 | 1.5 | 10 |
(4)选用浊度计进行测量,原因是
 溶液与
溶液与 溶液反应生成了
溶液反应生成了(5)实验③中,x=
(6)实验①、②、③的目的是
(7)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对
 与硫酸反应的化学反应速率的影响,
与硫酸反应的化学反应速率的影响, 溶液浓度的改变影响更大。该推断的证据是
溶液浓度的改变影响更大。该推断的证据是
您最近半年使用:0次
名校
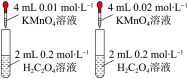
2 . 探究 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+l0CO2↑+8H2O 反应速率的影响因素,有关实验数据如下表所示:
下列说法不正确的是
| 编号 | 温度℃ | 催化剂(g) | 酸性KMnO4溶液 | H2C2O4溶液 | KMnO4溶液褪色平均时间(min) | ||
| 体积(mL) | 浓度(mol/L) | 体积(mL) | 浓度(mol/L) | ||||
| 1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
| 2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
| 3 | 25 | 0.5 | 4 | 0.01 | 8 | 0.2 | 6.7 |
| 4 | 25 | 0 | 4 | 0.01 | 8 | 0.2 | b |
| A.a<12.7,b>6.7 |
| B.可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢 |
| C.用H2C2O4表示该反应速率,v(实验1)约为6.6×l0-3 mol·L-1·min-1 |
| D.用KMnO4表示该反应速率,v(实验3)>v(实验1) |
您最近半年使用:0次
解题方法
3 . 某实验小组用酸性 溶液和
溶液和 (草酸)反应研究影响反应速率的因素,反应的方程式为
(草酸)反应研究影响反应速率的因素,反应的方程式为 。他们通过测定单位时间内生成
。他们通过测定单位时间内生成 的体积,探究某种影响化学反应速率的因素,设计方案如下(
的体积,探究某种影响化学反应速率的因素,设计方案如下( 溶液已酸化):
溶液已酸化):
(1)酸性 溶液中所加的酸应是(填字母序号)___________。
溶液中所加的酸应是(填字母序号)___________。
(2)该实验探究的是___________ 对化学反应速率的影响。
(3)实验停止前,相同时间内针筒中所得 体积较大是
体积较大是___________ (填实验序号)。
(4)若实验①在2min末注射器的活塞从最左端(刻度为20mL)向右移动到了V mL的位置,则这段时间内的平均反应速率可表示为
___________  。
。
(5)若实验②在t min收集了2.24mL (标准状况),则t min末
(标准状况),则t min末 的物质的量浓度为
的物质的量浓度为___________  。
。
(6)该小组同学发现反应速率总是如图,其中 ~
~ 时间内速率变快的主要原因可能是:①
时间内速率变快的主要原因可能是:①___________ ,②___________
 溶液和
溶液和 (草酸)反应研究影响反应速率的因素,反应的方程式为
(草酸)反应研究影响反应速率的因素,反应的方程式为 。他们通过测定单位时间内生成
。他们通过测定单位时间内生成 的体积,探究某种影响化学反应速率的因素,设计方案如下(
的体积,探究某种影响化学反应速率的因素,设计方案如下( 溶液已酸化):
溶液已酸化):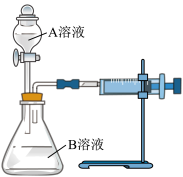
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.2  溶液 溶液 | 30mL 0.01  溶液 溶液 |
| ② | 20mL 0.1  溶液 溶液 | 30mL 0.01  溶液 溶液 |
(1)酸性
 溶液中所加的酸应是(填字母序号)___________。
溶液中所加的酸应是(填字母序号)___________。| A.硫酸 | B.盐酸 | C.硝酸 | D.以上三种酸都可 |
(2)该实验探究的是
(3)实验停止前,相同时间内针筒中所得
 体积较大是
体积较大是(4)若实验①在2min末注射器的活塞从最左端(刻度为20mL)向右移动到了V mL的位置,则这段时间内的平均反应速率可表示为

 。
。(5)若实验②在t min收集了2.24mL
 (标准状况),则t min末
(标准状况),则t min末 的物质的量浓度为
的物质的量浓度为 。
。(6)该小组同学发现反应速率总是如图,其中
 ~
~ 时间内速率变快的主要原因可能是:①
时间内速率变快的主要原因可能是:①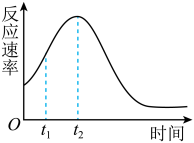
您最近半年使用:0次
名校
解题方法
4 . 下列有关化学反应速率、化学反应限度的说法中,正确的是
A.反应 ,其他条件不变时,增加碳的用量可加快反应速率 ,其他条件不变时,增加碳的用量可加快反应速率 |
| B.用铁片与稀硫酸反应制H2,改用98%的浓硫酸可加快生成H2的速率 |
| C.工业合成氨反应在密闭容器中进行,压缩容器体积,可使反应速率增大 |
D.当SO3的分子数等于SO2和O2分子数之和时,反应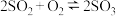 达到平衡 达到平衡 |
您最近半年使用:0次
名校
解题方法
5 . 下列实验方案或装置能达到目的的是
| 选项 | 目的 | 实验方案或装置 |
| A | 定量测量化学反应速率 |
|
| B | 测定酸碱中和热 |
|
| C | 探究浓度影响化学平衡移动的因素 | 水煤气的反应C(s)+H2O(g) CO(g)+ H2(g),增加碳的量,平衡向正反应方向移动。 CO(g)+ H2(g),增加碳的量,平衡向正反应方向移动。 |
| D | 探究浓度对反应速率的影响 | 分别向两支盛有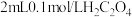 溶液的试管中分别加入 溶液的试管中分别加入 和 和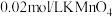 溶液,比较溶液褪色快慢 溶液,比较溶液褪色快慢 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
6 . 某小组利用硫代硫酸钠溶液与稀硫酸反应: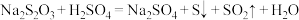 ,探究反应条件对速率的影响。下列有关说法正确的是
,探究反应条件对速率的影响。下列有关说法正确的是
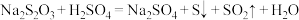 ,探究反应条件对速率的影响。下列有关说法正确的是
,探究反应条件对速率的影响。下列有关说法正确的是选项 | 反应温度/℃ |
| 稀 |
| ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
② | 25 | 5 | 0.1 | 10 | 0.1 | x |
③ | 50 | 10 | 0.1 | 5 | 0.2 | 5 |
④ | 50 | 10 | 0.1 | 10 | 0.1 | 0 |
| A.①③可探究硫酸浓度对反应速率的影响 |
| B.①④可探究温度对速率的影响,实验时将溶液混合后置于相应温度的水浴中 |
| C.实验可通过比较出现浑浊所用的时间判断反应的快慢 |
D. ,①②两组实验可探究 ,①②两组实验可探究 浓度对反应速率的影响 浓度对反应速率的影响 |
您最近半年使用:0次
名校
解题方法
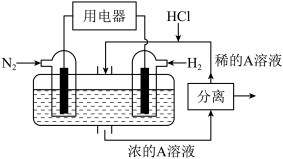
7 . 氢能是一种非常清洁的能源,氨分解制备氢气是一种技术先进和经济可行的工艺。恒温恒容密闭容器中,在某催化剂表面上发生氨的分解反应2NH3(g) N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下NH3的浓度随时间的变化如下表所示:
N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下NH3的浓度随时间的变化如下表所示:
(1)实验①中20~40min,v(NH3)=___________ 。
(2)为提高该反应的速率,下列措施可行的是___________(填标号)。
(3)关于上述实验,下列说法正确的是___________(填序号)。
(4)已知断裂1mol H-H、1mol N-H、1mol N≡N分别要吸收436kJ、391kJ、946kJ的能量。请在坐标图中,画出反应过程中体系的能量变化图__________ (进行必要的标注)。___________ 。
②电池正极的电极反应式为___________ 。
 N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下NH3的浓度随时间的变化如下表所示:
N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下NH3的浓度随时间的变化如下表所示:
(1)实验①中20~40min,v(NH3)=
(2)为提高该反应的速率,下列措施可行的是___________(填标号)。
| A.适当提高反应的温度 | B.恒温恒压充入He(g) |
| C.缩小容器的体积 | D.恒温恒容充入He(g)使压强增大 |
(3)关于上述实验,下列说法正确的是___________(填序号)。
| A.实验①,H2的反应速率:0~20min大于20~40min |
| B.实验②,x数值可能为0 |
| C.相同条件下,增加氨气的浓度,反应速率增大 |
| D.相同条件下,增加催化剂的表面积,反应速率增大 |
(4)已知断裂1mol H-H、1mol N-H、1mol N≡N分别要吸收436kJ、391kJ、946kJ的能量。请在坐标图中,画出反应过程中体系的能量变化图

②电池正极的电极反应式为
您最近半年使用:0次
名校
8 . Ⅰ.在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图: 时刻,正逆反应速率大小
时刻,正逆反应速率大小
___________  。(填“>”“=”或“<”)
。(填“>”“=”或“<”)
(2)若 min,计算反应开始至
min,计算反应开始至 时刻用M的浓度变化表示的平均反应速率
时刻用M的浓度变化表示的平均反应速率___________ 。
(3) 时刻化学反应达到平衡,反应物的转化率为
时刻化学反应达到平衡,反应物的转化率为___________ 。
(4)写出反应的化学方程式___________ 。
(5)如果升高温度,则
___________ (填“增大”“减小”或“不变”)。
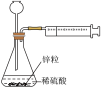
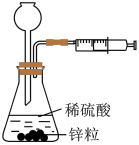
Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
(6)①本实验待测数据可以是___________ ,实验Ⅰ和实验Ⅱ可以探究___________ ,对锌与稀硫酸反应速率的影响。
②实验Ⅲ和实验Ⅳ的目的是___________ 。
(7)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中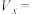
___________ 。
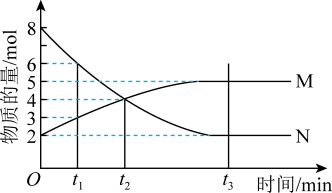
 时刻,正逆反应速率大小
时刻,正逆反应速率大小
 。(填“>”“=”或“<”)
。(填“>”“=”或“<”)(2)若
 min,计算反应开始至
min,计算反应开始至 时刻用M的浓度变化表示的平均反应速率
时刻用M的浓度变化表示的平均反应速率(3)
 时刻化学反应达到平衡,反应物的转化率为
时刻化学反应达到平衡,反应物的转化率为(4)写出反应的化学方程式
(5)如果升高温度,则

Ⅱ.某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
| 序号 | 纯锌粉/g | 2.0 硫酸溶液/mL 硫酸溶液/mL | 温度/℃ | 硫酸铜固体/g | 加入蒸馏水/mL |
| Ⅰ | 2.0 | 50.0 | 25 | 0 | 0 |
| Ⅱ | 2.0 | 40.0 | 25 | 0 | 10.0 |
| Ⅲ | 2.0 | 50.0 | 25 | 0.2 | 0 |
| Ⅳ | 2.0 | 50.0 | 25 | 4.0 | 0 |
(6)①本实验待测数据可以是
②实验Ⅲ和实验Ⅳ的目的是
(7)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
 溶液 溶液 | 水 | KI溶液 |  溶液 溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 |  | 4.0 | 4.0 | 2.0 |
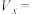
您最近半年使用:0次
解题方法
9 . Ⅰ.1mol  和1mol
和1mol  反应生成2mol NO的能量变化示意图如下:
反应生成2mol NO的能量变化示意图如下: 和2mol
和2mol  充分反应会
充分反应会___________ (填“吸收”或“放出”)___________ kJ能量。
Ⅱ.高炉炼铁中存在可逆反应: 。一定温度下,向1L密闭容器中加入足量铁粉并充入一定量的
。一定温度下,向1L密闭容器中加入足量铁粉并充入一定量的 气体,反应过程中气体的浓度与时间的关系如图所示。
气体,反应过程中气体的浓度与时间的关系如图所示。_____________ (填“>”“<”或“=”)逆反应速率。
(3)0~2min时间段内,
_____________  。反应达最大限度时,体系内混合气体的平均相对分子质量约为
。反应达最大限度时,体系内混合气体的平均相对分子质量约为_____________ (计算结果保留整数)。
(4)下列能判断反应达到平衡状态的是_____________ (填字母)。
a. b.
b.
c.容器内气体总压强不再变化 d.混合气体的密度不再发生改变
Ⅲ.某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需的时间。
(5)①完成此实验设计,其中:
_____________ mL。
②该同学最后得出的结论为:当加入少量 溶液时,生成氢气的速率会大大提高。但当加入的
溶液时,生成氢气的速率会大大提高。但当加入的 溶液超过一定量时,生成氢气的速率反而下降。请分析氢气生成速率下降的主要原因:
溶液超过一定量时,生成氢气的速率反而下降。请分析氢气生成速率下降的主要原因:___________ 。
 和1mol
和1mol  反应生成2mol NO的能量变化示意图如下:
反应生成2mol NO的能量变化示意图如下: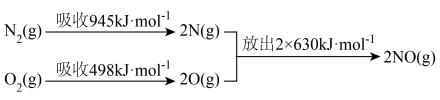
 和2mol
和2mol  充分反应会
充分反应会Ⅱ.高炉炼铁中存在可逆反应:
 。一定温度下,向1L密闭容器中加入足量铁粉并充入一定量的
。一定温度下,向1L密闭容器中加入足量铁粉并充入一定量的 气体,反应过程中气体的浓度与时间的关系如图所示。
气体,反应过程中气体的浓度与时间的关系如图所示。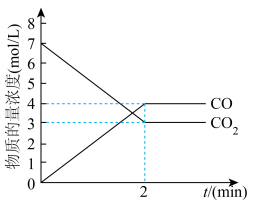
(3)0~2min时间段内,

 。反应达最大限度时,体系内混合气体的平均相对分子质量约为
。反应达最大限度时,体系内混合气体的平均相对分子质量约为(4)下列能判断反应达到平衡状态的是
a.
 b.
b.
c.容器内气体总压强不再变化 d.混合气体的密度不再发生改变
Ⅲ.某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需的时间。
混合溶液 | A | B | C | D | E | F |
4 | 30 | 30 |
| 30 |
| 30 |
饱和 | 0 | 0.5 | 2.5 | 5 | 10 | 20 |
|
|
| 17.5 |
| 10 | 0 |
(5)①完成此实验设计,其中:

②该同学最后得出的结论为:当加入少量
 溶液时,生成氢气的速率会大大提高。但当加入的
溶液时,生成氢气的速率会大大提高。但当加入的 溶液超过一定量时,生成氢气的速率反而下降。请分析氢气生成速率下降的主要原因:
溶液超过一定量时,生成氢气的速率反而下降。请分析氢气生成速率下降的主要原因:
您最近半年使用:0次
名校
解题方法
10 . 已知: 、
、 。下列装置或操作能达到目的的是
。下列装置或操作能达到目的的是
 、
、 。下列装置或操作能达到目的的是
。下列装置或操作能达到目的的是| 选项 | 装置或操作 | 目的 |
| A |
| 装置用于测定生成氢气的速率 |
| B |
| 装置依据出现浑浊的快慢比较温度对反应速率的影响 |
| C |
| 装置依据单位时间内颜色变化来比较浓度对反应速率的影响 |
| D |
| 装置依据U形管两边液面的高低判断钠和水反应的热效应 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次





 /mL
/mL