2024高三下·全国·专题练习
1 . 四氯化钛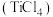 是生产金属钛及其化合物的重要中间体,工业上以高钛渣(主要成分为
是生产金属钛及其化合物的重要中间体,工业上以高钛渣(主要成分为 )为原料生产
)为原料生产 的化学反应原理为
的化学反应原理为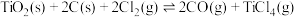

 。请回答下列问题:
。请回答下列问题:
(1)T℃时,将足量的 、C加入某恒容密闭容器中,并通入一定量的
、C加入某恒容密闭容器中,并通入一定量的 和
和 (
( 不参与反应)只发生反应:
不参与反应)只发生反应: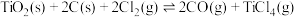 ,测得容器内总压强(
,测得容器内总压强(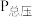 )和
)和 的转化率(
的转化率( )随时间的变化关系如图所示:
)随时间的变化关系如图所示:
___________ kPa( 为以各组分的平衡分压表示的平衡常数,分压=总压×物质的量分数)。
为以各组分的平衡分压表示的平衡常数,分压=总压×物质的量分数)。
②保持温度和起始总压相同,若向恒容密闭容器中通入的 中不含氮气,与含有氮气相比,
中不含氮气,与含有氮气相比, 的平衡转化率
的平衡转化率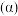
___________ (填“增大”“减小”或“不变”),其原因为___________ 。
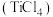 是生产金属钛及其化合物的重要中间体,工业上以高钛渣(主要成分为
是生产金属钛及其化合物的重要中间体,工业上以高钛渣(主要成分为 )为原料生产
)为原料生产 的化学反应原理为
的化学反应原理为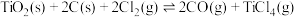

 。请回答下列问题:
。请回答下列问题:(1)T℃时,将足量的
 、C加入某恒容密闭容器中,并通入一定量的
、C加入某恒容密闭容器中,并通入一定量的 和
和 (
( 不参与反应)只发生反应:
不参与反应)只发生反应: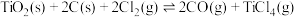 ,测得容器内总压强(
,测得容器内总压强(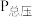 )和
)和 的转化率(
的转化率( )随时间的变化关系如图所示:
)随时间的变化关系如图所示:

 为以各组分的平衡分压表示的平衡常数,分压=总压×物质的量分数)。
为以各组分的平衡分压表示的平衡常数,分压=总压×物质的量分数)。②保持温度和起始总压相同,若向恒容密闭容器中通入的
 中不含氮气,与含有氮气相比,
中不含氮气,与含有氮气相比, 的平衡转化率
的平衡转化率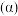
您最近半年使用:0次
2024高三下·全国·专题练习
2 . 雾霾主要成分为灰尘、SO2、NOx和有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一、
(1)以臭氧为烟气脱硝剂时,脱硝过程涉及的反应之一为:2NO2(g)+O3(g)⇌N2O5(g)+O2(g)。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:
①T1___________ T2(填“<"、“>”或“无法确定”),该反应的 H
H___________ 0(填“<”或“>”)。
②0~25min内乙容器中反应的平均速率:v(NO2)=___________ 。
③T1温度下,混合气体的起始总压为p,则达到平衡时,NO2的转化率为___________ ,平衡常数Kp=___________ (以分压表示,分压=总压×物质的量分数)。
(1)以臭氧为烟气脱硝剂时,脱硝过程涉及的反应之一为:2NO2(g)+O3(g)⇌N2O5(g)+O2(g)。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:

| 容器 | 甲 | 乙 |
| 温度/K | T1 | T2 |
| 容积/L | 2 | |
| 起始充入量 | 4molNO2和2molO3 | |
 H
H②0~25min内乙容器中反应的平均速率:v(NO2)=
③T1温度下,混合气体的起始总压为p,则达到平衡时,NO2的转化率为
您最近半年使用:0次
名校
3 . 氢能是一种绿色能源,研发新型制氢技术具有重要意义。
(1)甘油 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
反应I: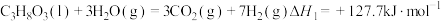
反应Ⅱ: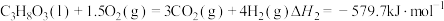
①
___________ 。
②除 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是___________ 。
(2)“表面改性铝粉分解水制氢”因 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。
①利用 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为___________ 。
② 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积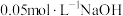 溶液和
溶液和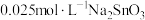 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是___________ 。 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为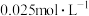 时,氢气产率接近
时,氢气产率接近 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是___________ 。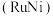 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用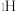 、
、 和
和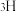 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为___________ ;步骤Ⅱ可描述为___________ 。
(1)甘油
 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:反应I:
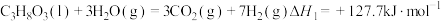
反应Ⅱ:
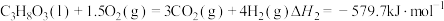
①

②除
 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是(2)“表面改性铝粉分解水制氢”因
 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。①利用
 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为②
 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积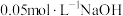 溶液和
溶液和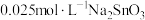 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是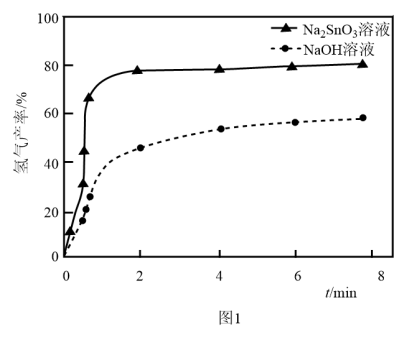
 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为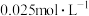 时,氢气产率接近
时,氢气产率接近 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是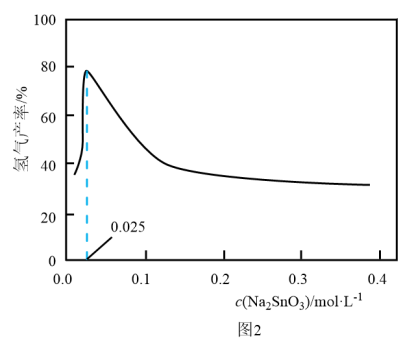
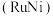 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用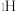 、
、 和
和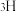 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为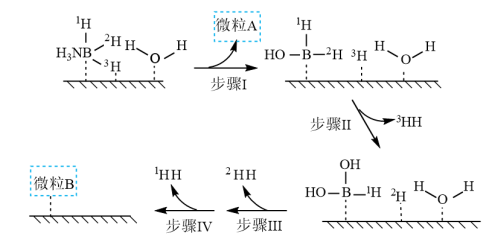
您最近半年使用:0次
4 . 目前生产钛的方法之一是先将TiO2转化为TiCl4,再进一步还原得到钛。以下是碳氯化法制备TiCl4:TiO2(s)+2Cl2(g)+2C(s) TiCl4(g)+2CO(g) ∆H
TiCl4(g)+2CO(g) ∆H kJ·mol−1。
kJ·mol−1。
(1)对于该反应:增大压强,平衡___________ 移动(填“正向”“不”或“逆向”);温度升高,平衡转化率___________ (填“增大”“减小”或“不变”)。
(2)恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是______。
(3)在某温度下,该恒容体系已经达到平衡,若向其中加入少量碳,TiCl4的体积分数将___________ (填选项);若加入少量氯气,TiCl4的体积分数将___________ (填选项)。
A.减小 B.不变 C.增大
 TiCl4(g)+2CO(g) ∆H
TiCl4(g)+2CO(g) ∆H kJ·mol−1。
kJ·mol−1。(1)对于该反应:增大压强,平衡
(2)恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是______。
| A.混合气体的压强保持不变 | B. |
| C.混合气体的密度保持不变 | D.Cl2和CO物质的量相等 |
A.减小 B.不变 C.增大
您最近半年使用:0次
5 . 氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。乙醇与水催化重整制氢发生以下反应:
反应Ⅰ: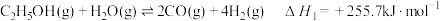
反应Ⅱ: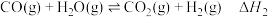
回答下列问题:
(1)①已知反应Ⅲ: ,则
,则
______ 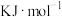 。
。
②反应I能自发进行的条件为______ 。
(2)压强为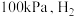 的平衡产率与温度、起始时
的平衡产率与温度、起始时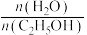 的关系如图所示,每条曲线表示
的关系如图所示,每条曲线表示
相同 的平衡产率。
______ 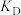 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
② 的产率:B点
的产率:B点______ C点(填“>”、“=”或“<”);
③A、B两点 产率相等的原因是
产率相等的原因是______ 。
(3)压强为 下,
下, 和
和 发生上述反应,平衡时
发生上述反应,平衡时 和
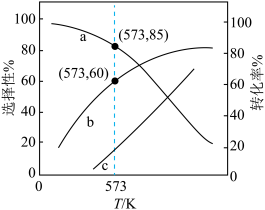
和 的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知:CO的选择性
的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知:CO的选择性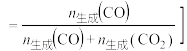
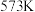 时,10分钟反应达到平衡,则乙醇的物质的量的变化量
时,10分钟反应达到平衡,则乙醇的物质的量的变化量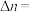
______ mol。
②表示 选择性的曲线是
选择性的曲线是______ (填标号)。
③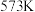 时,反应II的
时,反应II的
______ (保留三位有效数字)。
反应Ⅰ:
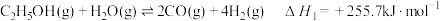
反应Ⅱ:
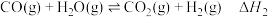
回答下列问题:
(1)①已知反应Ⅲ:
 ,则
,则
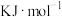 。
。②反应I能自发进行的条件为
(2)压强为
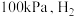 的平衡产率与温度、起始时
的平衡产率与温度、起始时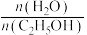 的关系如图所示,每条曲线表示
的关系如图所示,每条曲线表示
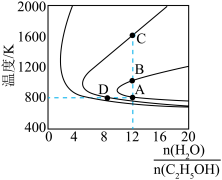

 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)②
 的产率:B点
的产率:B点③A、B两点
 产率相等的原因是
产率相等的原因是(3)压强为
 下,
下, 和
和 发生上述反应,平衡时
发生上述反应,平衡时 和
和 的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知:CO的选择性
的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知:CO的选择性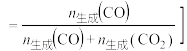
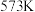 时,10分钟反应达到平衡,则乙醇的物质的量的变化量
时,10分钟反应达到平衡,则乙醇的物质的量的变化量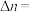
②表示
 选择性的曲线是
选择性的曲线是③
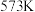 时,反应II的
时,反应II的
您最近半年使用:0次
6 . 2NO2(g)  N2O4(g),
N2O4(g),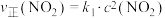 ,
,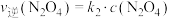 ,其中
,其中 、
、 只与温度有关,T0时,
只与温度有关,T0时, ,将一定量的
,将一定量的 充入注射器中,改变活塞位置,气体透光率随时间的变化如下图所示(气体颜色越深,透光率越低),下列说法错误的是
充入注射器中,改变活塞位置,气体透光率随时间的变化如下图所示(气体颜色越深,透光率越低),下列说法错误的是
 N2O4(g),
N2O4(g),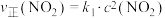 ,
,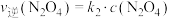 ,其中
,其中 、
、 只与温度有关,T0时,
只与温度有关,T0时, ,将一定量的
,将一定量的 充入注射器中,改变活塞位置,气体透光率随时间的变化如下图所示(气体颜色越深,透光率越低),下列说法错误的是
充入注射器中,改变活塞位置,气体透光率随时间的变化如下图所示(气体颜色越深,透光率越低),下列说法错误的是
A.d点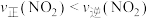 |
| B.T0时,K=0.5 |
C.T1时, ,则T1<T0 ,则T1<T0 |
D.保持容积不变,再充入一定量 气体, 气体, 的平衡转化率不变 的平衡转化率不变 |
您最近半年使用:0次
7 . 在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g) 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示。
2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示。
_____ (选填“>”或“<”)0.
(2)若容器Ⅰ的体积为2L,反应在370℃下进行,20s后达到平衡,则从起始到平衡过程中N2O反应速率为_____ 。
(3)容器Ⅱ中,反应在B点时对应的平衡常数K=_____ (保留两位有效数字)。
(4)根据题给信息,下列有关说法正确的是_____。
(5)若容器Ⅳ的体积为1L,反应在370℃下进行,则起始时反应_____
 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示。
2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示。

(2)若容器Ⅰ的体积为2L,反应在370℃下进行,20s后达到平衡,则从起始到平衡过程中N2O反应速率为
(3)容器Ⅱ中,反应在B点时对应的平衡常数K=
(4)根据题给信息,下列有关说法正确的是_____。
| A.体积之比:VⅠ>VⅡ>VⅢ |
| B.容器Ⅲ中,当N2与O2物质的量之比为2:1时反应达平衡状态 |
| C.图乙中A、C、D对应的容器中混合气体平均相对分子质量相等 |
| D.图乙中A、C、D三点由于转化率相等,因而平衡常数相等 |
| A.υ正>υ逆 | B.υ正<υ逆 | C.υ正=υ逆 |
您最近半年使用:0次
名校
8 . 中国积极推动技术创新,力争2060年实现碳中和。CO2催化还原的主要反应有:
①

②

向恒温恒压的密闭容器中通入1 mol CO2和3 mol H2进行上述反应。CH3OH的平衡产率、CO2的平衡转化率随温度变化关系如图。下列说法错误的是
①


②


向恒温恒压的密闭容器中通入1 mol CO2和3 mol H2进行上述反应。CH3OH的平衡产率、CO2的平衡转化率随温度变化关系如图。下列说法错误的是
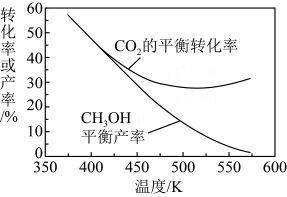
A.反应②的 |
| B.若气体密度不再变化,反应①和②均达到平衡状态 |
C.任一温度下的平衡转化率: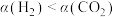 |
D.平衡时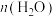 随温度升高先增大后减小 随温度升高先增大后减小 |
您最近半年使用:0次
7日内更新
|
357次组卷
|
4卷引用:东北三省2024届高三下学期三校二模联考化学试题
东北三省2024届高三下学期三校二模联考化学试题黑龙江省哈尔滨市三校联考2024届高三二模化学试题东北三省2024届高三下学期三校二模联考化学试题(已下线)题型7 化学反应速率与化学平衡 水溶液中的离子反应与平衡(25题)-2024年高考化学常考点必杀300题(新高考通用)
9 . 氨分解制氢是一种极具前景的便携式制氢方法,不同压强下氨的平衡转化率随温度变化如下。下列说法正确的是
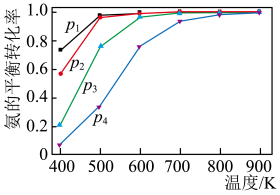
A.2NH3  3H2 + N2 ΔH < 0 3H2 + N2 ΔH < 0 |
| B.氢气和氮气的物质的量之比保持不变,说明氨分解反应达到平衡状态 |
| C.p1 < p2 < p3 < p4 |
| D.500 K时,p3压强下氨分解反应的平衡常数比p4压强下的大 |
您最近半年使用:0次
10 . 从烟道废气中回收硫的原理之一: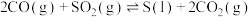
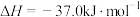 ,在恒压密闭容器中,平衡时SO2的转化率
,在恒压密闭容器中,平衡时SO2的转化率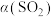 与起始充入的
与起始充入的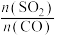 和温度(T)的关系如图所示。下列说法中正确的是
和温度(T)的关系如图所示。下列说法中正确的是
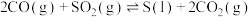
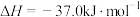 ,在恒压密闭容器中,平衡时SO2的转化率
,在恒压密闭容器中,平衡时SO2的转化率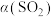 与起始充入的
与起始充入的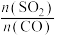 和温度(T)的关系如图所示。下列说法中正确的是
和温度(T)的关系如图所示。下列说法中正确的是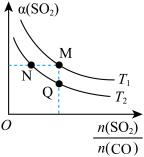
A.正反应的活化能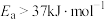 |
B.CO的转化率 :M>N :M>N |
C.正反应速率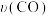 :M>Q :M>Q |
D.该反应的化学平衡常数表达式: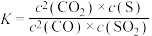 |
您最近半年使用:0次
7日内更新
|
273次组卷
|
4卷引用:2024届河北省张家口市高三下学期一模化学试题
2024届河北省张家口市高三下学期一模化学试题河北省沧州市2024届高三下学期一模化学试卷(已下线)通关练08 聚焦反应热、速率及化学平衡-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)题型7 化学反应速率与化学平衡 水溶液中的离子反应与平衡(25题)-2024年高考化学常考点必杀300题(新高考通用)



