2024高三下·全国·专题练习
1 . 硫氰化钾( )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示: 不溶于水,密度比水的大;
不溶于水,密度比水的大;
② 不溶于
不溶于 ;
;
③三颈烧瓶内盛放有 、水和催化剂。
、水和催化剂。
回答下列问题:
制备 溶液:
溶液:
测定晶体中 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴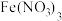 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。
(1)滴定时发生的反应: (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是_______ 。
(2)晶体中 的质量分数为
的质量分数为_______ (结果精确至0.1%)。
 )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示: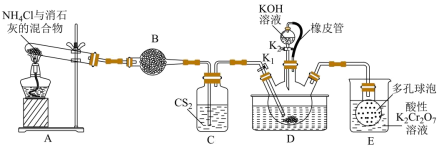
 不溶于水,密度比水的大;
不溶于水,密度比水的大;②
 不溶于
不溶于 ;
;③三颈烧瓶内盛放有
 、水和催化剂。
、水和催化剂。回答下列问题:
制备
 溶液:
溶液:测定晶体中
 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴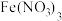 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。(1)滴定时发生的反应:
 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是(2)晶体中
 的质量分数为
的质量分数为
您最近半年使用:0次
2024高三下·全国·专题练习
2 .  作为绿色氧化剂应用广泛,氢醌法制备
作为绿色氧化剂应用广泛,氢醌法制备 原理及装置如下:
原理及装置如下: 、
、 等杂质易使
等杂质易使 催化剂中毒。回答下列问题:
催化剂中毒。回答下列问题:
(1)取 产品,加蒸馏水定容至
产品,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、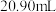 、
、 。假设其他杂质不干扰结果,产品中
。假设其他杂质不干扰结果,产品中 质量分数为
质量分数为_______ 。
 作为绿色氧化剂应用广泛,氢醌法制备
作为绿色氧化剂应用广泛,氢醌法制备 原理及装置如下:
原理及装置如下: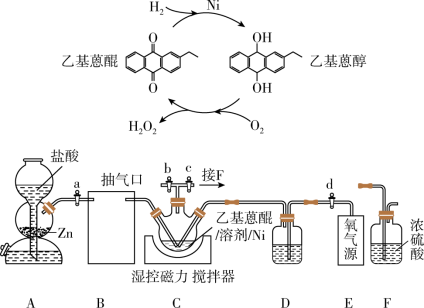
 、
、 等杂质易使
等杂质易使 催化剂中毒。回答下列问题:
催化剂中毒。回答下列问题:(1)取
 产品,加蒸馏水定容至
产品,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、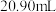 、
、 。假设其他杂质不干扰结果,产品中
。假设其他杂质不干扰结果,产品中 质量分数为
质量分数为
您最近半年使用:0次
3 . 工业上使用氯化粗五氧化二钒(杂质为Ti、Al的氧化物)的方法制备三氯氧钒( ),其装置如图所示(加热及夹持装置略)。已知:
),其装置如图所示(加热及夹持装置略)。已知: 熔点为−77℃,沸点为126℃,易水解(装置A为制备氯气的装置,未画出)。
熔点为−77℃,沸点为126℃,易水解(装置A为制备氯气的装置,未画出)。
(1)常温下,装置A中氯酸钾固体与浓盐酸发生反应,该反应中氧化剂和还原剂物质的量之比为________ ,装置A与实验室制取下列气体的装置相同的是________ (选填标号)。
a.铜与浓硫酸反应制二氧化硫 b.石灰石与盐酸反应制二氧化碳
c.熟石灰与氯化铵反应制氨气 d.过氧化钠和水反应制氧气
(2)装置C中盛装的试剂可以是________ ;实验开始先打开K,通入 一段时间后,加热
一段时间后,加热 装置,可产生一种还原性气体,则D装置中反应生成
装置,可产生一种还原性气体,则D装置中反应生成 的化学方程式为
的化学方程式为________ 。
(3)当D中反应结束后,停止加热,停止通氯气,此时杂质以氯化物的形式溶解在产物中,关闭开关K后,接下来进行的操作是________ (填操作名称)。
(4)装置H的作用为________ 。
(5)经检测,G所得的 中还含有
中还含有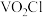 杂质,为测定其中
杂质,为测定其中 的质量分数,做如下实验:
的质量分数,做如下实验:
①取下锥形瓶,称量产品和锥形瓶的质量为 ;
;
②加入超纯水形成钒溶液,再向该钒溶液中加入氨水, 和
和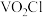 都会与氨水反应产生
都会与氨水反应产生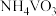 沉淀和
沉淀和 ;
;
③过滤洗涤后,将洗涤液与滤液合并后配制成250mL溶液,取25mL用浓度为 的
的 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 溶液
溶液 ;
;
④将锥形瓶洗涤干燥后称量其质量为 。
。
则 的质量分数表达式为
的质量分数表达式为________ ,下列情况会导致 的质量分数偏低的是
的质量分数偏低的是________ (选填标号)。
a.操作③过滤洗涤后,未将洗涤液与滤液合并
b.产品中残留少量 杂质
杂质
c.滴定读取标准液数据时,开始仰视,结束俯视
 ),其装置如图所示(加热及夹持装置略)。已知:
),其装置如图所示(加热及夹持装置略)。已知: 熔点为−77℃,沸点为126℃,易水解(装置A为制备氯气的装置,未画出)。
熔点为−77℃,沸点为126℃,易水解(装置A为制备氯气的装置,未画出)。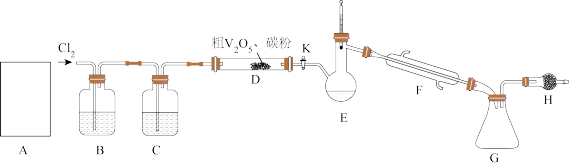
(1)常温下,装置A中氯酸钾固体与浓盐酸发生反应,该反应中氧化剂和还原剂物质的量之比为
a.铜与浓硫酸反应制二氧化硫 b.石灰石与盐酸反应制二氧化碳
c.熟石灰与氯化铵反应制氨气 d.过氧化钠和水反应制氧气
(2)装置C中盛装的试剂可以是
 一段时间后,加热
一段时间后,加热 装置,可产生一种还原性气体,则D装置中反应生成
装置,可产生一种还原性气体,则D装置中反应生成 的化学方程式为
的化学方程式为(3)当D中反应结束后,停止加热,停止通氯气,此时杂质以氯化物的形式溶解在产物中,关闭开关K后,接下来进行的操作是
(4)装置H的作用为
(5)经检测,G所得的
 中还含有
中还含有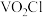 杂质,为测定其中
杂质,为测定其中 的质量分数,做如下实验:
的质量分数,做如下实验:①取下锥形瓶,称量产品和锥形瓶的质量为
 ;
;②加入超纯水形成钒溶液,再向该钒溶液中加入氨水,
 和
和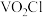 都会与氨水反应产生
都会与氨水反应产生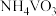 沉淀和
沉淀和 ;
;③过滤洗涤后,将洗涤液与滤液合并后配制成250mL溶液,取25mL用浓度为
 的
的 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 溶液
溶液 ;
;④将锥形瓶洗涤干燥后称量其质量为
 。
。则
 的质量分数表达式为
的质量分数表达式为 的质量分数偏低的是
的质量分数偏低的是a.操作③过滤洗涤后,未将洗涤液与滤液合并
b.产品中残留少量
 杂质
杂质c.滴定读取标准液数据时,开始仰视,结束俯视
您最近半年使用:0次
4 . 碘是生物必需的一种微量元素,海带、海藻等食物含碘量最为丰富。某小组通过实验提取并测定干海带中碘的含量。回答下列问题:
Ⅰ.从海带中提取碘。
该小组同学按如图实验流程进行实验。
干海带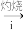 海带灰
海带灰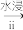 海带浸出液
海带浸出液 的水溶液
的水溶液
(1)步骤i中需要用到含硅酸盐材质的仪器有________ (填仪器名称)。________ (用离子方程式表示)。
Ⅱ.滴定法测海带中碘的含量。
用 滴定
滴定 的水溶液,淀粉溶液作指示剂。原理为
的水溶液,淀粉溶液作指示剂。原理为 。
。
(3)用酸式滴定管量取 的水溶液时常需要排出气泡,操作是
的水溶液时常需要排出气泡,操作是________ 。
(4)小组同学进行了实验测定,在滴定终点附近,反复变回蓝色,一直测不到终点。
待测液 无色
无色 蓝色
蓝色 无色
无色 蓝色……
蓝色……
①提出猜想
猜想1:碘离子被________ 氧化。
猜想2:碘离子被步骤iii中过量的 氧化。
氧化。
②验证猜想
③查阅资料 小组同学认为可能是反应速率不同造成的, 氧化
氧化 的速率
的速率________ (填“快于”或“慢于”) 还原
还原 的速率,导致待测液反复变为蓝色。
的速率,导致待测液反复变为蓝色。
④优化设计 鉴于反应终点无法到达的问题,请提出合理的修正方案:________ 。
⑤完成实验 小组同学修正方案后,取5.000g干海带进行测定,消耗 溶液﹐则干海带中碘的含量为
溶液﹐则干海带中碘的含量为________  (保留2位有效数字)。
(保留2位有效数字)。
Ⅰ.从海带中提取碘。
该小组同学按如图实验流程进行实验。
干海带
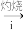 海带灰
海带灰 海带浸出液
海带浸出液 的水溶液
的水溶液(1)步骤i中需要用到含硅酸盐材质的仪器有
Ⅱ.滴定法测海带中碘的含量。
用
 滴定
滴定 的水溶液,淀粉溶液作指示剂。原理为
的水溶液,淀粉溶液作指示剂。原理为 。
。(3)用酸式滴定管量取
 的水溶液时常需要排出气泡,操作是
的水溶液时常需要排出气泡,操作是(4)小组同学进行了实验测定,在滴定终点附近,反复变回蓝色,一直测不到终点。
待测液
 无色
无色 蓝色
蓝色 无色
无色 蓝色……
蓝色……①提出猜想
猜想1:碘离子被
猜想2:碘离子被步骤iii中过量的
 氧化。
氧化。②验证猜想
序号 | 实验操作 | 实验现象 | 结论 |
1 | 取少量原海带浸出液﹐加入硫酸酸化,再滴加几滴淀粉溶液,鼓入空气 | 待测液始终保持无色 | 猜想1不成立 |
2 | 将 溶液、2滴 溶液、2滴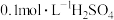 溶液、2滴淀粉溶液和1滴 溶液、2滴淀粉溶液和1滴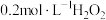 溶液混合配制待测液,用 溶液混合配制待测液,用 溶液滴定 溶液滴定 | 猜想2不成立 |
 氧化
氧化 的速率
的速率 还原
还原 的速率,导致待测液反复变为蓝色。
的速率,导致待测液反复变为蓝色。④优化设计 鉴于反应终点无法到达的问题,请提出合理的修正方案:
⑤完成实验 小组同学修正方案后,取5.000g干海带进行测定,消耗
 溶液﹐则干海带中碘的含量为
溶液﹐则干海带中碘的含量为 (保留2位有效数字)。
(保留2位有效数字)。
您最近半年使用:0次
5 . 利用碘量法测定某纯净水样中溶解 的含量,实验如下(加入的试剂已除去
的含量,实验如下(加入的试剂已除去 )。
)。
步骤1 水样中 的固定:用
的固定:用 的水瓶盛满水样,加入
的水瓶盛满水样,加入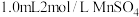 溶液,再加入含
溶液,再加入含 溶液和
溶液和 溶液的混合液
溶液的混合液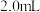 ,部分水样溢出,立即盖好瓶盖,翻转摇匀,生成白色沉淀
,部分水样溢出,立即盖好瓶盖,翻转摇匀,生成白色沉淀 ,随即有棕色沉淀
,随即有棕色沉淀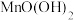 生成。
生成。
步骤2 生成 :当水样中的沉淀沉降到距瓶口三分之一以下时,缓缓加入适量稀
:当水样中的沉淀沉降到距瓶口三分之一以下时,缓缓加入适量稀 至液面下,部分溶液溢出,立即盖好瓶盖,翻转摇动,至沉淀完全溶解,得到黄色溶液。
至液面下,部分溶液溢出,立即盖好瓶盖,翻转摇动,至沉淀完全溶解,得到黄色溶液。
步骤3 测定及计算:用碘量法测出步骤2中生成的 为
为 ,进而计算出纯净水样中溶解
,进而计算出纯净水样中溶解 的含量。
的含量。
已知: 直接氧化
直接氧化 的反应速率很慢。
的反应速率很慢。
下列说法不正确 的是
 的含量,实验如下(加入的试剂已除去
的含量,实验如下(加入的试剂已除去 )。
)。步骤1 水样中
 的固定:用
的固定:用 的水瓶盛满水样,加入
的水瓶盛满水样,加入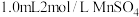 溶液,再加入含
溶液,再加入含 溶液和
溶液和 溶液的混合液
溶液的混合液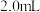 ,部分水样溢出,立即盖好瓶盖,翻转摇匀,生成白色沉淀
,部分水样溢出,立即盖好瓶盖,翻转摇匀,生成白色沉淀 ,随即有棕色沉淀
,随即有棕色沉淀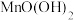 生成。
生成。步骤2 生成
 :当水样中的沉淀沉降到距瓶口三分之一以下时,缓缓加入适量稀
:当水样中的沉淀沉降到距瓶口三分之一以下时,缓缓加入适量稀 至液面下,部分溶液溢出,立即盖好瓶盖,翻转摇动,至沉淀完全溶解,得到黄色溶液。
至液面下,部分溶液溢出,立即盖好瓶盖,翻转摇动,至沉淀完全溶解,得到黄色溶液。步骤3 测定及计算:用碘量法测出步骤2中生成的
 为
为 ,进而计算出纯净水样中溶解
,进而计算出纯净水样中溶解 的含量。
的含量。已知:
 直接氧化
直接氧化 的反应速率很慢。
的反应速率很慢。下列说法
| A.步骤1中,用注射器加入试剂时应将细长针头插到液面下一定距离 |
B.步骤2中,生成 的反应: 的反应: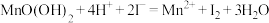 |
C.步骤2中,部分溶液溢出不影响测定纯净水样中溶解 的含量 的含量 |
D.步骤3中,经计算,该纯净水样中含有 的浓度为 的浓度为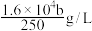 |
您最近半年使用:0次
名校
6 . 工业废水中常含有一定量氧化性较强的 ,利用滴定原理测定
,利用滴定原理测定 含量的方法如下:
含量的方法如下:
步骤Ⅰ:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应,其中 转化为
转化为 。
。
步骤Ⅲ:向锥形瓶中滴加几滴淀粉溶液。用滴定管量取0.1000
 ,溶液进行滴定,数据记录如下:(
,溶液进行滴定,数据记录如下:( )
)
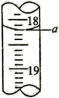
(1)步骤Ⅰ量取30.00mL废水,选择的仪器名称是_________ 。
(2)步骤Ⅲ中滴定达到终点时的实验现象是____________________ 。
(3)写出步骤Ⅱ的离子方程式___________________ 。
(4)步骤Ⅲ中a的读数如上图所示,则 的含量为
的含量为_________  (写出计算过程)。
(写出计算过程)。
(5)以下操作会造成废水中 含量测定值偏高的是 (填字母)。
含量测定值偏高的是 (填字母)。
 ,利用滴定原理测定
,利用滴定原理测定 含量的方法如下:
含量的方法如下:步骤Ⅰ:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应,其中
 转化为
转化为 。
。步骤Ⅲ:向锥形瓶中滴加几滴淀粉溶液。用滴定管量取0.1000

 ,溶液进行滴定,数据记录如下:(
,溶液进行滴定,数据记录如下:( )
)| 滴定次数 | 起始读数/mL | 终点读数/mL |
| 第一次 | 1.02 | 19.14 |
| 第二次 | 2.00 | 21.80 |
| 第三次 | 0.20 | a |

(1)步骤Ⅰ量取30.00mL废水,选择的仪器名称是
(2)步骤Ⅲ中滴定达到终点时的实验现象是
(3)写出步骤Ⅱ的离子方程式
(4)步骤Ⅲ中a的读数如上图所示,则
 的含量为
的含量为 (写出计算过程)。
(写出计算过程)。(5)以下操作会造成废水中
 含量测定值偏高的是 (填字母)。
含量测定值偏高的是 (填字母)。| A.滴定终点读数时,俯视滴定管的刻度 |
| B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
D.量取 溶液的滴定管用蒸馏水洗后未用标准液润洗 溶液的滴定管用蒸馏水洗后未用标准液润洗 |
您最近半年使用:0次
7 . 亚硝酰硫酸(NOSO4H)主要用重氮化反应。实验室将二氧化硫通入到硫酸和硝酸中发生氧化还原反应,硝酸被还原为亚硝酸,二氧化硫被氧化为三氧化硫(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。

(1)装置A制取SO2
①A中反应的化学方程式为_______ 。
②导管b的作用是_______ 。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是_______ (只写1种)。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快_______ 。
(3)C装置的作用是_______ (用离子方程式表示)。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷和改进措施是_______ 。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol•L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol•L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①写出Na2C2O4溶液与酸性KMnO4溶液反应的离子方程式:_______ 。
②滴定终点时的现象为_______ 。
③亚硝酰硫酸的纯度=_______ 。(精确到0.1%)[M(NOSO4H)=127g•mol-1]

(1)装置A制取SO2
①A中反应的化学方程式为
②导管b的作用是
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快
(3)C装置的作用是
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷和改进措施是
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol•L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol•L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①写出Na2C2O4溶液与酸性KMnO4溶液反应的离子方程式:
②滴定终点时的现象为
③亚硝酰硫酸的纯度=
您最近半年使用:0次
8 . 碳资源的合理利用和控制储存具有重要意义。
(1)工业上制备甲醇的主要反应有:
反应Ⅰ. 平衡常数K1
平衡常数K1
反应Ⅱ.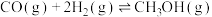 平衡常数K2
平衡常数K2
反应Ⅲ. 平衡常数K3
平衡常数K3
K3=___________ 。(用K1、K2表示)
(2)乙烷直接热解脱氢制乙烯。热化学方程式为: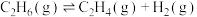 △H
△H
△H=___________ kJ∙mol-1 (填数值,相关键能数据如下表)。
(3)已知草酸( )为二元弱酸,
)为二元弱酸, 、
、 、
、 三种微粒的物质的量分数(
三种微粒的物质的量分数( )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。
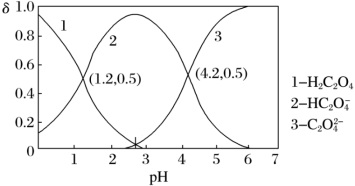
①用已知浓度的酸性KMnO4溶液滴定未知浓度草酸溶液,终点判断:当滴入最后半滴KMnO4溶液时,___________ ,停止滴定,并记录KMnO4溶液的体积,重复操作2~3次。
②硫酸酸化的KMnO4溶液滴定H2C2O4溶液的离子方程式为___________ 。
③结合图中信息,pH=2.7的溶液中: =
=___________ 。(填数值)
(1)工业上制备甲醇的主要反应有:
反应Ⅰ.
 平衡常数K1
平衡常数K1反应Ⅱ.
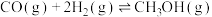 平衡常数K2
平衡常数K2反应Ⅲ.
 平衡常数K3
平衡常数K3K3=
(2)乙烷直接热解脱氢制乙烯。热化学方程式为:
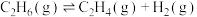 △H
△H△H=
| 化学键 |  |  |  |  |
键能/ | 348 | 615 | 413 | 436 |
(3)已知草酸(
 )为二元弱酸,
)为二元弱酸, 、
、 、
、 三种微粒的物质的量分数(
三种微粒的物质的量分数( )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。
①用已知浓度的酸性KMnO4溶液滴定未知浓度草酸溶液,终点判断:当滴入最后半滴KMnO4溶液时,
②硫酸酸化的KMnO4溶液滴定H2C2O4溶液的离子方程式为
③结合图中信息,pH=2.7的溶液中:
 =
=
您最近半年使用:0次
9 . 下列实验操作及所选实验装置均正确的是
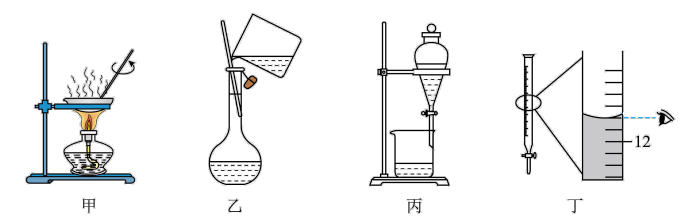

| A.海带提碘实验中使用装置甲将海带灼烧成灰 |
| B.配制NaOH溶液过程中使用装置乙将NaOH固体溶解 |
| C.用NaOH溶液分离乙醇和乙酸乙酯的混合物使用装置丙 |
D. 标准溶液滴定亚铁盐实验,滴定结束时如图丁所示读数 标准溶液滴定亚铁盐实验,滴定结束时如图丁所示读数 |
您最近半年使用:0次
10 . 冶炼金属产生的酸泥属于有价值危险物。从某酸泥(含Se单质,HgSe及锌、铜的化合物等)中回收汞和硒的一种工艺如下:

(1)“氧化浸出”时,酸泥中硒、汞、锌、铜分别以H2SeO3、Hg2+、Zn2+、Cu2+形式进入溶液。
①分离氧化浸出液和浸出渣的操作是___________ 。
②不溶于水的HgSe被氧化的离子方程式为___________ 。
③浸出时间等其他条件相同时,不同的NaClO3投加量对汞、硒浸出率的影响如图所示。选择最佳NaClO3投加量并说明理由___________ 。

(2)沉汞后液中磷以最高价形式存在。“还原沉汞”的主要反应中,氧化剂和还原剂的物质的量之比为___________ 。
(3)已知Se(s) + Na2SO3(aq) Na2SeSO3(aq),粗硒中的杂质不溶于Na2SO3溶液。利用该原理对粗硒进行提纯,实验操作是
Na2SeSO3(aq),粗硒中的杂质不溶于Na2SO3溶液。利用该原理对粗硒进行提纯,实验操作是___________ 。
(4)粗硒中硒的纯度测定
i.取0.1 g 粗硒于锥形瓶中,加入15 mL浓盐酸和1mL浓硝酸,沸水浴加热,使Se全部转化为H2SeO3;
ii.除去过量的HNO3和溶解的NO2;
iii.加入2 mL KI溶液、5 mL淀粉溶液,然后用c mol·L-1 Na2S2O3标准溶液进行滴定,到达滴定终点时,消耗Na2S2O3标准溶液V mL。
已知:H2SeO3 + 4KI + 4HCl = Se + 2I2 + 4KCl + 3H2O
H2SeO3 + 4Na2S2O3 + 4HCl = Se + 2Na2S4O6 + 4NaCl + 3H2O
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
①到达滴定终点时的现象为___________ 。
②依据现有数据能否计算出粗硒中硒的纯度?若能,请写出计算式;若不能,请写出还需要的数据。___________ 。

(1)“氧化浸出”时,酸泥中硒、汞、锌、铜分别以H2SeO3、Hg2+、Zn2+、Cu2+形式进入溶液。
①分离氧化浸出液和浸出渣的操作是
②不溶于水的HgSe被氧化的离子方程式为
③浸出时间等其他条件相同时,不同的NaClO3投加量对汞、硒浸出率的影响如图所示。选择最佳NaClO3投加量并说明理由

(2)沉汞后液中磷以最高价形式存在。“还原沉汞”的主要反应中,氧化剂和还原剂的物质的量之比为
(3)已知Se(s) + Na2SO3(aq)
 Na2SeSO3(aq),粗硒中的杂质不溶于Na2SO3溶液。利用该原理对粗硒进行提纯,实验操作是
Na2SeSO3(aq),粗硒中的杂质不溶于Na2SO3溶液。利用该原理对粗硒进行提纯,实验操作是(4)粗硒中硒的纯度测定
i.取0.1 g 粗硒于锥形瓶中,加入15 mL浓盐酸和1mL浓硝酸,沸水浴加热,使Se全部转化为H2SeO3;
ii.除去过量的HNO3和溶解的NO2;
iii.加入2 mL KI溶液、5 mL淀粉溶液,然后用c mol·L-1 Na2S2O3标准溶液进行滴定,到达滴定终点时,消耗Na2S2O3标准溶液V mL。
已知:H2SeO3 + 4KI + 4HCl = Se + 2I2 + 4KCl + 3H2O
H2SeO3 + 4Na2S2O3 + 4HCl = Se + 2Na2S4O6 + 4NaCl + 3H2O
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
①到达滴定终点时的现象为
②依据现有数据能否计算出粗硒中硒的纯度?若能,请写出计算式;若不能,请写出还需要的数据。
您最近半年使用:0次



