1 . 已知 为二元弱酸,且
为二元弱酸,且 ,向
,向 溶液中逐滴加入一元弱酸HB溶液,溶液中的离子浓度变化关系如图所示:
溶液中逐滴加入一元弱酸HB溶液,溶液中的离子浓度变化关系如图所示:
 为二元弱酸,且
为二元弱酸,且 ,向
,向 溶液中逐滴加入一元弱酸HB溶液,溶液中的离子浓度变化关系如图所示:
溶液中逐滴加入一元弱酸HB溶液,溶液中的离子浓度变化关系如图所示:
A. 为 为 随 随 的变化关系 的变化关系 |
B.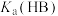 的数量级为 的数量级为 |
C.NaHA溶液中: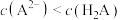 |
D.向 溶液中滴入足量HB溶液的离子方程式为 溶液中滴入足量HB溶液的离子方程式为 |
您最近半年使用:0次
2 . 盐与碱的反应是水溶液中常见的反应,某学习小组展开相关探究。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=
①步骤a需要称量NaOH固体为______ g(保留一位小数)
②步骤b需要用到下图所示仪器中的______ (填名称)。______ mol·g-1
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关
(2)NH4Cl溶液显酸性,用离子方程式解释原因:______ 。
(3)小组同学设计实验探究[c )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
①实验结果显示,NaCl溶液不具备抗碱能力,即曲线______ (填曲线标号)表示溶液1.
②实验结果显示,当[c( )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液______ (填溶液组号)
③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=______ (精确至小数点后1位)。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=

①步骤a需要称量NaOH固体为
②步骤b需要用到下图所示仪器中的
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与
 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关(2)NH4Cl溶液显酸性,用离子方程式解释原因:
(3)小组同学设计实验探究[c
 )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示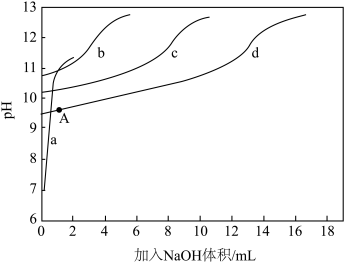
| 溶液组号 | 组成 | 体积/mL |
| 1 | 0.2mol·L-1NaCl溶液 | 15 |
| 2 | 0.1mol·L-1NH4Cl | 3 |
| 0.1mol·L-1氨水 | 12 | |
| 3 | 0.1mol·L-1NH4Cl | 7.5 |
| 0.1mol·L-1氨水 | 7.5 | |
| 4 | 0.1mol·L-1NH4Cl | 12 |
| 0.1mol·L-1氨水 | 3 |
②实验结果显示,当[c(
 )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=
您最近半年使用:0次
3 . 二元有机酸(H2X)的电离常数Kal=1.67×10﹣8、Ka2=3.34×10﹣17。BaX难溶于水,常温下,将BaX溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中c2(H+)与c2(Ba2+)的关系如图所示。下列说法不正确的是
已知:HY是一元强酸,BaY2易溶于水。0.382=0.1444,0.192=0.0361
已知:HY是一元强酸,BaY2易溶于水。0.382=0.1444,0.192=0.0361

| A.NaHX溶液显碱性 |
| B.溶度积Ksp(BaX)=6.18×10﹣23mol2⋅L﹣2 |
| C.b点:2c(Ba2+)+c(H+)=2c(X2﹣)+c(HX﹣)+c(OH﹣) |
| D.若0.1 mol BaX溶于25 mLx mol⋅L﹣1HY溶液中得到c点溶液,则x≈8.38 |
您最近半年使用:0次
解题方法
4 . 草酸 是一种白色粉末,
是一种白色粉末,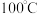 左右开始少量升华,熔点为
左右开始少量升华,熔点为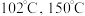 左右分解产生
左右分解产生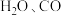 和
和 ;可与酸性
;可与酸性 溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为
溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为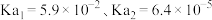 。
。
1.草酸可用于实验室制备少量 气体,应选择的发生装置为
气体,应选择的发生装置为___________ 。
常温下,向某浓度的草酸溶液中加入一定量等浓度的 溶液。
溶液。
3.当 时,溶液呈___________。
时,溶液呈___________。
A.酸性 B.碱性 C.中性 D.无法判断
此时,溶液中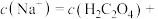
___________ 。
4.当 时,计算该溶液的
时,计算该溶液的
___________ 。(结果保留两位小数)计算过程。
 是一种白色粉末,
是一种白色粉末,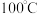 左右开始少量升华,熔点为
左右开始少量升华,熔点为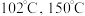 左右分解产生
左右分解产生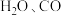 和
和 ;可与酸性
;可与酸性 溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为
溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为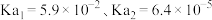 。
。1.草酸可用于实验室制备少量
 气体,应选择的发生装置为
气体,应选择的发生装置为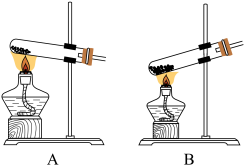
A.用足量的 溶液充分吸收后,可收集得到纯净的 溶液充分吸收后,可收集得到纯净的 |
| B.通过灼热的氧化铜,若出现黑色变红色现象,则产生的气体中一定有CO |
C.通入足量的澄清石灰水中,若能产生白色沉淀,则产生的气体中一定有 |
D.通入酸性 溶液中,若能使溶液褪色,说明草酸具有还原性 溶液中,若能使溶液褪色,说明草酸具有还原性 |
常温下,向某浓度的草酸溶液中加入一定量等浓度的
 溶液。
溶液。3.当
 时,溶液呈___________。
时,溶液呈___________。A.酸性 B.碱性 C.中性 D.无法判断
此时,溶液中
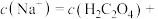
4.当
 时,计算该溶液的
时,计算该溶液的
您最近半年使用:0次
名校
5 . 25℃时,用 溶液分别滴定一元酸
溶液分别滴定一元酸 溶液和
溶液和 溶液,pM[p表示负对数,M表示
溶液,pM[p表示负对数,M表示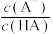 ,
, ]与溶液
]与溶液 的变化关系如图所示。已知:①
的变化关系如图所示。已知:① 易溶于水,②平衡常数
易溶于水,②平衡常数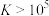 时反应进行完全。下列说法错误的是
时反应进行完全。下列说法错误的是
 溶液分别滴定一元酸
溶液分别滴定一元酸 溶液和
溶液和 溶液,pM[p表示负对数,M表示
溶液,pM[p表示负对数,M表示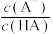 ,
, ]与溶液
]与溶液 的变化关系如图所示。已知:①
的变化关系如图所示。已知:① 易溶于水,②平衡常数
易溶于水,②平衡常数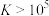 时反应进行完全。下列说法错误的是
时反应进行完全。下列说法错误的是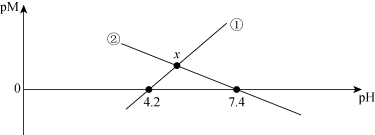
A.该温度下, 的 的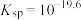 |
B.滴定 溶液至x点时,改为滴加HA溶液,沉淀逐渐完全溶解 溶液至x点时,改为滴加HA溶液,沉淀逐渐完全溶解 |
C.25℃,NaA溶液中, 水解常数的数量级为 水解常数的数量级为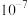 |
D.滴定HA溶液至x点时,溶液中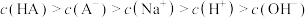 |
您最近半年使用:0次
2024-04-12更新
|
390次组卷
|
2卷引用:2024届河北省部分高三下学期一模化学试题
名校
6 . I.常温下磷酸溶液中,平衡时含磷微粒(H3PO4、 、
、 、
、 )浓度占含磷微粒总浓度的比值δ随pH变化的情况如图所示。
)浓度占含磷微粒总浓度的比值δ随pH变化的情况如图所示。
(1)0.01 mol/L的Na2HPO4(aq)呈___________ 性(选填“酸”或“碱”),与同浓度的NaH2PO3(aq)相比,其中水的电离程度更大的是___________ 溶液(选填“Na2HPO4”或“NaH2PO3”),通过计算说明理由___________ 。
(2)常温下,NaH2PO4(aq)中微粒浓度关系为:2c( )+c(
)+c( )-c(H3PO4)=
)-c(H3PO4)=___________ 。
(3)将过量H3PO4(aq)加入0.01 mol/L的Na2HPO3(aq)中反应的离子方程式为___________ 。将H3PO4(ag)逐滴滴入Na2CO3(aq)溶液中,发生反应的离子方程式表示错误的是___________ 。
A.H3PO4+ =
= +
+ B.H3PO4+3
B.H3PO4+3 =3
=3 +
+
C.H3PO4+2 =2
=2 +
+ D.2H3PO4+
D.2H3PO4+ =CO2↑+2
=CO2↑+2 +H2O
+H2O
II.某研究小组用磷酸吸收氨气制NH4H2PO4,装置如下图所示(夹持和搅拌装置已省略)。___________ (选填“K1”或“K2”,下同),打开___________ ,当上述现象消失后,继续通入氨气。
(5)本实验不选用pH传感器,还可选用___________ 作指示剂,当溶液颜色发生相应变化时,停止通NH3。
 、
、 、
、 )浓度占含磷微粒总浓度的比值δ随pH变化的情况如图所示。
)浓度占含磷微粒总浓度的比值δ随pH变化的情况如图所示。 
| 25℃ | H3PO3 | H2CO3 |
| 电离平衡常数(Ka) | Ka1=5.1×10-2 Ka2=1.8×10-7 | Ka2=4.5×10-7 Ka2=4.7×10-11 |
(1)0.01 mol/L的Na2HPO4(aq)呈
(2)常温下,NaH2PO4(aq)中微粒浓度关系为:2c(
 )+c(
)+c( )-c(H3PO4)=
)-c(H3PO4)=(3)将过量H3PO4(aq)加入0.01 mol/L的Na2HPO3(aq)中反应的离子方程式为
A.H3PO4+
 =
= +
+ B.H3PO4+3
B.H3PO4+3 =3
=3 +
+
C.H3PO4+2
 =2
=2 +
+ D.2H3PO4+
D.2H3PO4+ =CO2↑+2
=CO2↑+2 +H2O
+H2OII.某研究小组用磷酸吸收氨气制NH4H2PO4,装置如下图所示(夹持和搅拌装置已省略)。
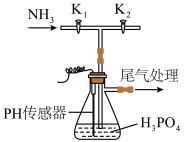
(5)本实验不选用pH传感器,还可选用
您最近半年使用:0次
名校
7 . 电离平衡常数和电离度(电离度是指已电离的电解质分子数占原来总分子数的百分比)均可衡量弱电解质的电离,下表是常温下几种弱酸的电离平衡常数( )和弱碱的电离平衡常数(
)和弱碱的电离平衡常数( ),回答下列问题∶
),回答下列问题∶
(1) 的水溶液呈
的水溶液呈______ (填“酸性”、“中性”或“碱性”),理由是______ 。
(2)现测得溶解了 的某盐酸的pH=4,则该溶液中
的某盐酸的pH=4,则该溶液中 的电离度约为
的电离度约为______ 。
(3)常温下,浓度相同的三种溶液NaF、 、
、 ,pH由大到小的顺序是
,pH由大到小的顺序是______ 。
(4)将过量 通入
通入 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为______ 。
 )和弱碱的电离平衡常数(
)和弱碱的电离平衡常数( ),回答下列问题∶
),回答下列问题∶| 弱酸或弱碱 | HF |  |  |  |  |
| 电离平衡常数 | 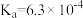 |  | 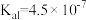 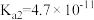 |  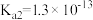 | 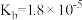 |
 的水溶液呈
的水溶液呈(2)现测得溶解了
 的某盐酸的pH=4,则该溶液中
的某盐酸的pH=4,则该溶液中 的电离度约为
的电离度约为(3)常温下,浓度相同的三种溶液NaF、
 、
、 ,pH由大到小的顺序是
,pH由大到小的顺序是(4)将过量
 通入
通入 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为
您最近半年使用:0次
8 . 根据实验目的,下列实验操作及现象与结论均正确的是
| 选项 | 实验目的 | 实验操作及现象 | 结论 |
| A | 比较CH3COO-和 的水解常数 的水解常数 | 分别测浓度均为0.1mol·L-1的CH3COONH4和NaHCO3溶液的pH, 后者大于前者 | Kh(CH3COO-)<Kh( ) ) |
| B | 验证Cl2与H2O的反应存在限度 | 取两份新制氯水,分别滴加AgNO3溶液和淀粉-KI溶液,前者有白色沉淀,后者溶液变蓝色 | 氯气与水的反应存在限度 |
| C | 探究氢离子浓度对 (黄色)。 (黄色)。 (橙红色)相互转化的影响 (橙红色)相互转化的影响 | 向K2CrO4溶液中缓慢滴加硫酸溶液,黄色变为橙红色 | 增大c(H+),转化平衡向生成 的方向移动 的方向移动 |
| D | 比较AgCl与AgI的溶度积大小 | 向2mL0.1 AgNO3溶液中先滴加4滴0.1 AgNO3溶液中先滴加4滴0.1 KCl溶液,再滴加4滴0.1 KCl溶液,再滴加4滴0.1 KI溶液,先产生白色沉淀,再产生黄色沉淀 KI溶液,先产生白色沉淀,再产生黄色沉淀 | AgCl转化为AgI,AgI的溶度积小于AgCl的 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
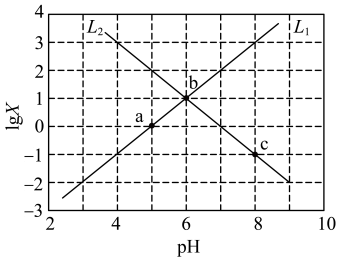
9 . 已知MR为易溶的弱酸弱碱盐,常温下,调节0.1 的MR溶液的pH(忽略温度和溶液体积变化),溶液pH与
的MR溶液的pH(忽略温度和溶液体积变化),溶液pH与 变化情况如图所示。
变化情况如图所示。
下列说法正确的是
A. 表示 表示 |
B. 的水解平衡常数 的水解平衡常数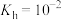 |
C.b点溶液中: |
D.两条直线上任意点均满足: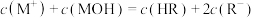 |
您最近半年使用:0次
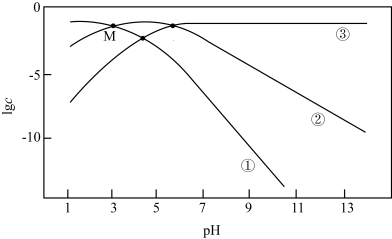
10 . 25℃时,用HCl气体和KOH固体改变 的邻苯二甲酸氢钾溶液的pH(邻苯二甲酸
的邻苯二甲酸氢钾溶液的pH(邻苯二甲酸 的
的 ,
,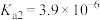 ),
), 、
、 和
和 随pH变化的关系如图所示。下列说法错误的是
随pH变化的关系如图所示。下列说法错误的是
 的邻苯二甲酸氢钾溶液的pH(邻苯二甲酸
的邻苯二甲酸氢钾溶液的pH(邻苯二甲酸 的
的 ,
,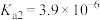 ),
), 、
、 和
和 随pH变化的关系如图所示。下列说法错误的是
随pH变化的关系如图所示。下列说法错误的是
A.曲线②代表 ,曲线③代表 ,曲线③代表 |
B.M点时,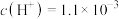 |
C. KHA溶液中, KHA溶液中,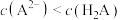 |
D.用KOH固体改变KHA溶液pH至13过程中, 一直增大 一直增大 |
您最近半年使用:0次



