1 . 化学与生产、生活息息相关。回答下列问题:
(1)小苏打在面包行业,不仅可以做膨松剂,还可以调节酸度。写出用小苏打调节酸度时发生反应的离子方程式:___________ 。
(2)沾有水的铁锅在高温火焰上灼烧会发黑,该反应的化学方程式为___________ 。
(3)补铁剂中的铁元素化合价为___________ ,常和维生素 C 一起服用,说明维 C 具有 ___________ 性。
(4)我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为 。该反应中被还原的元素是
。该反应中被还原的元素是___________ (填元素符号)。
(5)安全气囊弹出时发生反应: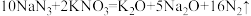 ,该反应中氧化产物与还原产物的物质的量之比为
,该反应中氧化产物与还原产物的物质的量之比为___________ 。标准状况下生成 44.8LN2时转移电子个数为 ___________ NA ( NA为阿伏加德罗常数的值)。
(1)小苏打在面包行业,不仅可以做膨松剂,还可以调节酸度。写出用小苏打调节酸度时发生反应的离子方程式:
(2)沾有水的铁锅在高温火焰上灼烧会发黑,该反应的化学方程式为
(3)补铁剂中的铁元素化合价为
(4)我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为
 。该反应中被还原的元素是
。该反应中被还原的元素是(5)安全气囊弹出时发生反应:
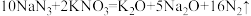 ,该反应中氧化产物与还原产物的物质的量之比为
,该反应中氧化产物与还原产物的物质的量之比为
您最近半年使用:0次
名校
解题方法
2 . 铜和三氧化二铁在工农业生产中用途广泛,用黄铜矿(主要成分为 ,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:___________ 。
(2)高温焙烧时发生的反应方程式为 ,1mol
,1mol  参加反应时,反应中转移电子
参加反应时,反应中转移电子___________ mol。
(3)操作a使用的玻璃仪器除了烧杯、漏斗、还有___________ 。
(4)向滤液A中通入 的目的是
的目的是___________ 。
(5)向溶液B中通入 时反应的离子方程式为
时反应的离子方程式为___________ 。
(6)工业上用生物法处理 的原理为(硫杆菌作催化剂):
的原理为(硫杆菌作催化剂): 、
、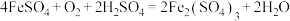 ,由图甲和图乙判断使用硫杆菌的最佳条件为
,由图甲和图乙判断使用硫杆菌的最佳条件为___________ ,若反应温度过高,反应速率下降,其原因是___________ 。
 ,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示: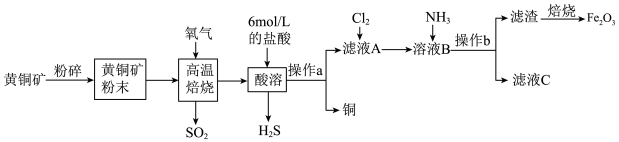
(2)高温焙烧时发生的反应方程式为
 ,1mol
,1mol  参加反应时,反应中转移电子
参加反应时,反应中转移电子(3)操作a使用的玻璃仪器除了烧杯、漏斗、还有
(4)向滤液A中通入
 的目的是
的目的是(5)向溶液B中通入
 时反应的离子方程式为
时反应的离子方程式为(6)工业上用生物法处理
 的原理为(硫杆菌作催化剂):
的原理为(硫杆菌作催化剂): 、
、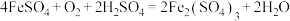 ,由图甲和图乙判断使用硫杆菌的最佳条件为
,由图甲和图乙判断使用硫杆菌的最佳条件为
您最近半年使用:0次
3 . 在Pt-BaO催化下,NO的“储存-还原”过程如图1所示。其中“还原”过程依次发生反应Ⅰ和反应Ⅱ,各气体的物质的量变化如图2所示。
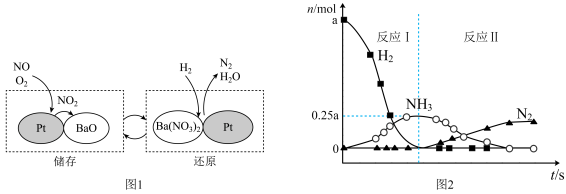
A. 与BaO的反应中, 与BaO的反应中, 既是氧化剂,又是还原剂 既是氧化剂,又是还原剂 |
B.反应Ⅰ为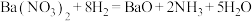 |
C.反应Ⅱ中,最终生成 的物质的量为0.2a mol 的物质的量为0.2a mol |
D.反应Ⅰ和Ⅱ中消耗的 的质量比是3∶5 的质量比是3∶5 |
您最近半年使用:0次
名校
解题方法
4 . 以焙烧黄铁矿(FeS2,杂质为石英等)产生的红渣为原料制备铵铁蓝 颜料,工艺流程如图。
颜料,工艺流程如图。
(1)写出两种能够提高酸浸率的措施___________ 。
(2)红渣的主要成分是___________ (填化学式),焙烧黄铁矿过程中若产生8.96 L(标准状况)SO2,则反应中转移电子的数目为___________ 。
(3)若“滤渣②”的成分中含有S单质,则生成S单质的离子方程式为___________ 。
(4)“一系列操作”包括___________ 、___________ 、过滤。
(5)简述洗涤铵铁蓝沉淀的操作:___________ 。
 颜料,工艺流程如图。
颜料,工艺流程如图。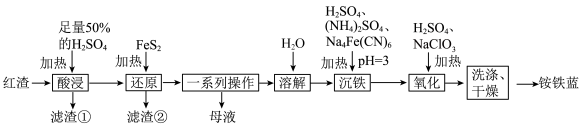
(1)写出两种能够提高酸浸率的措施
(2)红渣的主要成分是
(3)若“滤渣②”的成分中含有S单质,则生成S单质的离子方程式为
(4)“一系列操作”包括
(5)简述洗涤铵铁蓝沉淀的操作:
您最近半年使用:0次
解题方法
5 . 设 代表阿伏加德罗常数的值。臭氧能氧化
代表阿伏加德罗常数的值。臭氧能氧化 ,通常用于处理电镀工业含氰废水,其化学原理为
,通常用于处理电镀工业含氰废水,其化学原理为 。下列叙述正确的是
。下列叙述正确的是
 代表阿伏加德罗常数的值。臭氧能氧化
代表阿伏加德罗常数的值。臭氧能氧化 ,通常用于处理电镀工业含氰废水,其化学原理为
,通常用于处理电镀工业含氰废水,其化学原理为 。下列叙述正确的是
。下列叙述正确的是A.处理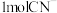 时生成还原产物 时生成还原产物 的分子数为 的分子数为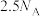 |
B.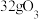 和 和 的混合气体中含氧原子数为 的混合气体中含氧原子数为 |
C.每生成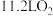 的同时生成 的同时生成 数为 数为 |
D.由离子方程式知每生成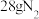 时转移电子数为 时转移电子数为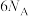 |
您最近半年使用:0次
6 . 可用Al与NaOH溶液反应来疏通下水管道。下列说法错误的是
| A.Al是还原剂,发生氧化反应 |
B.每生成1mol  ,转移2mol电子 ,转移2mol电子 |
| C.可用NaOH溶液除去镁粉中混有的少量Al粉 |
D.等量的铝与足量NaOH溶液反应生成的 比与足量盐酸反应生成的多 比与足量盐酸反应生成的多 |
您最近半年使用:0次
名校
解题方法
7 . 人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:
(1)某小组在实验室模拟以 为原料,制备少量硝态氮肥
为原料,制备少量硝态氮肥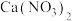 ,转化途径如下(转化所需试剂及条件已略去)。
,转化途径如下(转化所需试剂及条件已略去)。
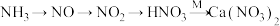
①工业合成氨是制取氮肥的基础。写出工业合成氨的化学反应方程式______ 。
②写出实验室用 和消石灰共热制备氨气的化学反应方程式
和消石灰共热制备氨气的化学反应方程式______ 。
③写出 发生催化氧化反应生成NO的化学方程式
发生催化氧化反应生成NO的化学方程式______ 。
向装置中通入4mol 和2mol
和2mol  ,转移的电子数
,转移的电子数______ 。
④工业上为了提高NO的转化率,可以适当增加 的量,理论上在一定的温度和压强下将2L NO完全转化成
的量,理论上在一定的温度和压强下将2L NO完全转化成 ,至少应该通入空气(空气中氧气体积约20%)的体积为
,至少应该通入空气(空气中氧气体积约20%)的体积为______ 。
(2)过渡施用氮肥将导致大气中 含量增高,加剧雾霾的形成。
含量增高,加剧雾霾的形成。 是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去) 或
或______ 。
②尿素 是一种常用有机氮肥,缓慢与
是一种常用有机氮肥,缓慢与 发生非氧化还原反应释放出
发生非氧化还原反应释放出 和另外一种气体,该反应的化学方程式为
和另外一种气体,该反应的化学方程式为______ 。
(1)某小组在实验室模拟以
 为原料,制备少量硝态氮肥
为原料,制备少量硝态氮肥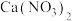 ,转化途径如下(转化所需试剂及条件已略去)。
,转化途径如下(转化所需试剂及条件已略去)。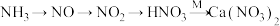
①工业合成氨是制取氮肥的基础。写出工业合成氨的化学反应方程式
②写出实验室用
 和消石灰共热制备氨气的化学反应方程式
和消石灰共热制备氨气的化学反应方程式③写出
 发生催化氧化反应生成NO的化学方程式
发生催化氧化反应生成NO的化学方程式向装置中通入4mol
 和2mol
和2mol  ,转移的电子数
,转移的电子数④工业上为了提高NO的转化率,可以适当增加
 的量,理论上在一定的温度和压强下将2L NO完全转化成
的量,理论上在一定的温度和压强下将2L NO完全转化成 ,至少应该通入空气(空气中氧气体积约20%)的体积为
,至少应该通入空气(空气中氧气体积约20%)的体积为(2)过渡施用氮肥将导致大气中
 含量增高,加剧雾霾的形成。
含量增高,加剧雾霾的形成。 是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)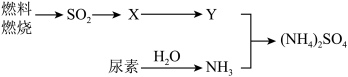
 或
或②尿素
 是一种常用有机氮肥,缓慢与
是一种常用有机氮肥,缓慢与 发生非氧化还原反应释放出
发生非氧化还原反应释放出 和另外一种气体,该反应的化学方程式为
和另外一种气体,该反应的化学方程式为
您最近半年使用:0次
名校
8 . “马氏试砷法”原理中的“砷镜”可溶于 的碱性溶液,发生的反应为
的碱性溶液,发生的反应为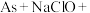
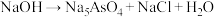 (末配平)。下列说法正确的是
(末配平)。下列说法正确的是
 的碱性溶液,发生的反应为
的碱性溶液,发生的反应为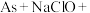
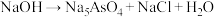 (末配平)。下列说法正确的是
(末配平)。下列说法正确的是A.配平后 的化学计量数为5 的化学计量数为5 |
| B.该反应的氧化剂与还原剂的物质的量之比为5:2 |
C. 的电子式为 的电子式为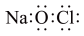 |
D.该反应每生成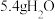 ,转移 ,转移 电子 电子 |
您最近半年使用:0次
9 . 铁是人类较早使用的金属之一,回答下列问题。
(1)下列所含铁元素只有还原性的物质是___________ (填字母)。
A.Fe B.FeCl3 C.FeSO4
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性,能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是___________ (填字母)。
A.药品美蓝发生还原反应 B.药品美蓝是还原剂 C.药品美蓝被还原
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:___________ 。
(4)请设计实验检验在空气中放置的硫酸亚铁溶液已部分变质:___________ 。
(5)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。写出并配平该反应的离子方程式
、Cl-、H2O。写出并配平该反应的离子方程式___________ ;若反应过程中转移了0.3 mol电子,则还原产物的物质的量为___________ mol。
(1)下列所含铁元素只有还原性的物质是
A.Fe B.FeCl3 C.FeSO4
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性,能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是
A.药品美蓝发生还原反应 B.药品美蓝是还原剂 C.药品美蓝被还原
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:
(4)请设计实验检验在空气中放置的硫酸亚铁溶液已部分变质:
(5)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。写出并配平该反应的离子方程式
、Cl-、H2O。写出并配平该反应的离子方程式
您最近半年使用:0次
10 . NA代表阿伏加德罗常数,下列说法中正确的是
| A.1molFeCl3完全水解生成NA个Fe(OH)3胶体 |
B. 在 在 中充分燃烧,转移电子数目为0.3NA 中充分燃烧,转移电子数目为0.3NA |
C.在标准状况下, 和CO的混合气体中含C、O原子共0.2mol 和CO的混合气体中含C、O原子共0.2mol |
| D.1L0.5mol·L-1Na2SO4溶液中,含有的氧原子总数为2NA |
您最近半年使用:0次



