解题方法
1 . 已知短周期元素 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示:
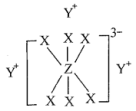
回答下列问题:
(1) 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是___________ ,写出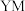 的电子式:
的电子式:___________ 。
(2) 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)在 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:___________ 。
(4)镓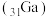 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓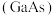 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是___________ 。
a. 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族
b. 为新型无机非金属材料
为新型无机非金属材料
c. 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强
d.酸性: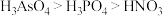
②废弃的含 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为___________ 。
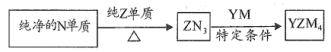
(5) 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
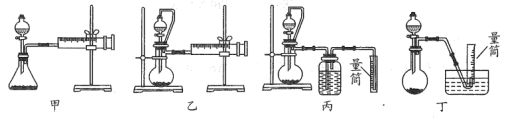
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品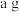 ,若实验测得氢气的体积为
,若实验测得氢气的体积为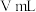 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为___________ (用代数式表示)。
 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示: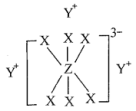
回答下列问题:
(1)
 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是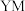 的电子式:
的电子式:(2)
 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):(3)在
 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓
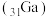 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。①下列有关说法正确的是
a.
 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族b.
 为新型无机非金属材料
为新型无机非金属材料c.
 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强d.酸性:
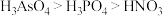
②废弃的含
 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品
 ,若实验测得氢气的体积为
,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为
您最近一年使用:0次
解题方法
2 . 铁及其化合物在生产、生活中有着重要作用。按要求回答下列问题。
(1)基态Fe原子的价层电子排布式为___________ ;铁元素在元素周期表中的位置是___________ ,属于___________ 区。
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:___________ 。
②预测物质E中铁元素具有___________ (填“氧化性”或“还原性”)。
③写出反应Ⅱ的化学方程式:___________ 。
④实现反应Ⅲ的转化,可选择含N元素的试剂为___________ 。
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)___________ 。
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为___________ 。
③C溶液呈黄色,不可能是因其体系中含有的___________ 、___________ 、___________ 、___________ (填离子符号)所致;
而可能是因其体系中含有的___________ 、___________ (填粒子的化学式)等所致。
④由步骤iv、v及其现象,体系中与 结合能力最强的离子是
结合能力最强的离子是___________ 。
(1)基态Fe原子的价层电子排布式为
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:
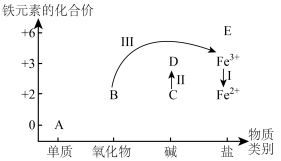
②预测物质E中铁元素具有
③写出反应Ⅱ的化学方程式:
④实现反应Ⅲ的转化,可选择含N元素的试剂为
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)
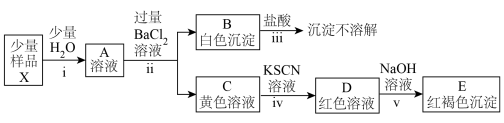
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为
③C溶液呈黄色,不可能是因其体系中含有的
而可能是因其体系中含有的
④由步骤iv、v及其现象,体系中与
 结合能力最强的离子是
结合能力最强的离子是
您最近一年使用:0次
2023-11-10更新
|
411次组卷
|
2卷引用:天津市河西区2023-2024学年高三上学期11月期中考试化学试题
解题方法
3 . 铜碘杂化团簇化合物具有优异的光学性能,可用于制备发光二极管、发光墨水、生物成像仪器等。一种铜碘杂化团簇的合成路线如下:
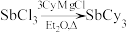 (
( 代表
代表 )
)

(1)已知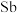 的原子序数为51,则它在元素周期表中的位置是
的原子序数为51,则它在元素周期表中的位置是______ ,属于______ (填“s”、“p”、“d”或“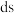 ”)区元素。
”)区元素。
(2) 中
中 的价电子排布图为
的价电子排布图为______ ;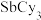 只能与一个
只能与一个 配位的原因是
配位的原因是_______ 。
(3)比较F和I的第一电离能大小,并说明理由:_______ 。
(4)已知 (三氯化锑)是易挥发的物质,由此判断
(三氯化锑)是易挥发的物质,由此判断 是
是_____ 晶体,预测 的
的 模型名称为
模型名称为______ 。
(5)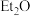 (即
(即 ,乙醚)中氧原子以及
,乙醚)中氧原子以及 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是_____ 、_____ 。
(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为 ,棱间夹角为
,棱间夹角为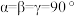 ,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为
,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为_______ ;设阿伏加德罗常数的值为 ,已知
,已知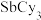 的相对分子质量是371,则该铜碘杂化团簇的密度是
的相对分子质量是371,则该铜碘杂化团簇的密度是_______  (列计算式)。
(列计算式)。
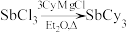 (
(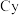 代表
代表 )
)
(1)已知
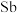 的原子序数为51,则它在元素周期表中的位置是
的原子序数为51,则它在元素周期表中的位置是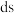 ”)区元素。
”)区元素。(2)
 中
中 的价电子排布图为
的价电子排布图为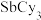 只能与一个
只能与一个 配位的原因是
配位的原因是(3)比较F和I的第一电离能大小,并说明理由:
(4)已知
 (三氯化锑)是易挥发的物质,由此判断
(三氯化锑)是易挥发的物质,由此判断 是
是 的
的 模型名称为
模型名称为(5)
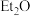 (即
(即 ,乙醚)中氧原子以及
,乙醚)中氧原子以及 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为
 ,棱间夹角为
,棱间夹角为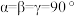 ,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为
,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式为 ,已知
,已知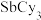 的相对分子质量是371,则该铜碘杂化团簇的密度是
的相对分子质量是371,则该铜碘杂化团簇的密度是 (列计算式)。
(列计算式)。
您最近一年使用:0次
2021-02-01更新
|
280次组卷
|
3卷引用:山西省太原市2021届高三上学期期末考试化学试题
解题方法
4 . A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。

请针对以下三种不同情况回答:
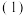 若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
 中含有的金属元素在元素周期表中的位置为
中含有的金属元素在元素周期表中的位置为_______________________ ,向水中加入X物质,X对水的电离平衡的影响是_________  填“促进”、“抑制”或“无影响”
填“促进”、“抑制”或“无影响” 。
。
 与C的水溶液混合后生成B,反应的离子方程式为
与C的水溶液混合后生成B,反应的离子方程式为___________________________ 。
 若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成
若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成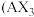 和
和 白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
 若A为该元素的白色固体单质,其结构为正四面体,分子式为
若A为该元素的白色固体单质,其结构为正四面体,分子式为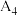 ,则
,则 单质中含共价键数目为
单质中含共价键数目为_________  ,B的电子式为
,B的电子式为_________ 。
 与水反应的离子方程式为
与水反应的离子方程式为_______________________________________________ 。
 若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。
若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。
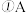 中所含有的化学键类型是
中所含有的化学键类型是_________ 。
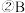 溶液中离子浓度由小到大的顺序是
溶液中离子浓度由小到大的顺序是_________ 。

请针对以下三种不同情况回答:
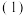 若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。 中含有的金属元素在元素周期表中的位置为
中含有的金属元素在元素周期表中的位置为 填“促进”、“抑制”或“无影响”
填“促进”、“抑制”或“无影响” 。
。 与C的水溶液混合后生成B,反应的离子方程式为
与C的水溶液混合后生成B,反应的离子方程式为 若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成
若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成 和
和 白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。 若A为该元素的白色固体单质,其结构为正四面体,分子式为
若A为该元素的白色固体单质,其结构为正四面体,分子式为 ,则
,则 单质中含共价键数目为
单质中含共价键数目为 ,B的电子式为
,B的电子式为 与水反应的离子方程式为
与水反应的离子方程式为 若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。
若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。 中所含有的化学键类型是
中所含有的化学键类型是 溶液中离子浓度由小到大的顺序是
溶液中离子浓度由小到大的顺序是
您最近一年使用:0次
解题方法
5 . A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂。
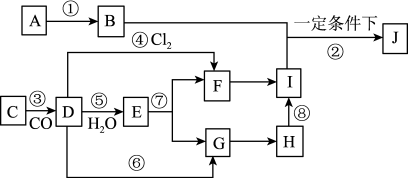
(1) (1)写出物质B的电子式_______ ;D元素在元素周期表中的位置为_______
(填写哪个周期和哪个族),写出物质B与水反应的化学方程式_______
(2) (2)写出下列反应的化学反应方程式:
⑤__________________________________________________________
⑧________________________________________________________________
(3) (3)写出反应的离子方程式:⑦_______
(4) (4)在①−⑧的所有反应中,属于非氧化还原反应的有(填序号)_______
(5) (5)根据Na2FeO4元素的价态及反应前后的产物推测Na2FeO4杀菌消毒做净水剂的原因_______________________________________

(1) (1)写出物质B的电子式
(填写哪个周期和哪个族),写出物质B与水反应的化学方程式
(2) (2)写出下列反应的化学反应方程式:
⑤
⑧
(3) (3)写出反应的离子方程式:⑦
(4) (4)在①−⑧的所有反应中,属于非氧化还原反应的有(填序号)
(5) (5)根据Na2FeO4元素的价态及反应前后的产物推测Na2FeO4杀菌消毒做净水剂的原因
您最近一年使用:0次
解题方法
6 . 甲、乙、丙是三种常见的单质,A、B、C是三种常见的二元无机化合物,它们之间的转化关系如右图所示。请回答下列有关问题:
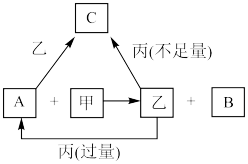
(1)若甲为常见气态非金属单质,丙为金属单质,三种单质中只有甲由短周期元素组成;甲与乙同主族、乙与丙同周期;它们的转化关系均在溶液中进行。则:
①甲物质的名称为___________ 。
②丙元素在元素周期表中的位置是___________ 。
③反应A+甲→乙+B的离子方程式为______________________ 。
④请简述B中阳离子的检验方法__________________________________ 。
(2)若甲为常见金属单质,乙为常见固态非金属单质,且所有物质组成元素均为短周期元素。则:
①乙的化学式为___________ 。
②A的电子式为___________ 。
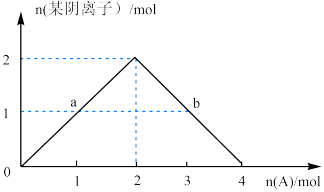
③将A缓慢通入氢氧化钠溶液中,所得溶液中的某种阴离子的物质的量随n(A)的通入转化关系如右图所示。图中a、b两点的溶液中水的电离程度的大小关系为a_______ b(填“>”、“=”或“<")。若溶液X为图中曲线上任意一点,则向溶液X中逐滴加入盐酸至反应完全,消耗盐酸的物质的量最大为___________ 。

(1)若甲为常见气态非金属单质,丙为金属单质,三种单质中只有甲由短周期元素组成;甲与乙同主族、乙与丙同周期;它们的转化关系均在溶液中进行。则:
①甲物质的名称为
②丙元素在元素周期表中的位置是
③反应A+甲→乙+B的离子方程式为
④请简述B中阳离子的检验方法
(2)若甲为常见金属单质,乙为常见固态非金属单质,且所有物质组成元素均为短周期元素。则:
①乙的化学式为
②A的电子式为
③将A缓慢通入氢氧化钠溶液中,所得溶液中的某种阴离子的物质的量随n(A)的通入转化关系如右图所示。图中a、b两点的溶液中水的电离程度的大小关系为a

您最近一年使用:0次
名校
解题方法
7 . A、B、C、X是中学化学常见化合物或单质,均由短周期元素组成,转化关系如图。请据图回答下列问题:

(1)若A、B、C中均含同一种常见金属元素R,R在C中以阴离子形式存在,B为白色胶状沉淀。
①R在元素周期表中的位置为______________ 。
②若A的溶液中混有Fe3+,当向该混合液中加入氨水,生成R(OH)n及Fe(OH)3共沉淀时,溶液中c(Fe3+)/ c(Rn+)=____ 。[已知:Fe(OH)3的 Ksp=4.00×10-38,沉淀B的Ksp=1.32×10-33 ]
(2)若A、B、C的焰色反应均为黄色,水溶液均呈碱性。
①A中含有的化学键是________________________ 。
②将672 mL(标准状况下)X通入100 mL 0.4mol·L- 1 A的溶液后,溶液中离子浓度由大到小的顺序为_______________________ 。
③自然界中存在B、C和H2O按一定比例形成的固体。取一定量该固体制成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol·L-1。若取相同质量的固体加热至恒重,剩余固体的质量为_______ 。
(3)若A、B、C中均含同一种常见非金属元素,其中A为黑色固体单质。已知298K下,1mol A、1 mol B完全燃烧生成稳定氧化物放出的热量分别为393.5 kJ,283 kJ。写出该温度下A与C反应生成B的热化学方程式:______________________ 。

(1)若A、B、C中均含同一种常见金属元素R,R在C中以阴离子形式存在,B为白色胶状沉淀。
①R在元素周期表中的位置为
②若A的溶液中混有Fe3+,当向该混合液中加入氨水,生成R(OH)n及Fe(OH)3共沉淀时,溶液中c(Fe3+)/ c(Rn+)=
(2)若A、B、C的焰色反应均为黄色,水溶液均呈碱性。
①A中含有的化学键是
②将672 mL(标准状况下)X通入100 mL 0.4mol·L- 1 A的溶液后,溶液中离子浓度由大到小的顺序为
③自然界中存在B、C和H2O按一定比例形成的固体。取一定量该固体制成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol·L-1。若取相同质量的固体加热至恒重,剩余固体的质量为
(3)若A、B、C中均含同一种常见非金属元素,其中A为黑色固体单质。已知298K下,1mol A、1 mol B完全燃烧生成稳定氧化物放出的热量分别为393.5 kJ,283 kJ。写出该温度下A与C反应生成B的热化学方程式:
您最近一年使用:0次
名校
解题方法
8 . 元素X、Y、Z、M、N均为原子序数依次增大的短周期主族元素;R在地壳金属元素中的含量仅次于Z。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4;N-、Z3+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)R在元素周期表中的位置是____________ ;Z3+的离子结构示意图是____________ 。
(2)写出X、Y、N按原子个数之比1:1:1:形成的化合物的电子式__________ ;M和N气态氢化物的稳定性大小比较为________ (用化学式和“>”“<”或“=”表示)。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式__________________________________ .
(4)Z元素的单质能与Y和R形成的化合物在一定条件下发生反应,同时放出大量的热,其反应的化学方程式为_____________________________ 。
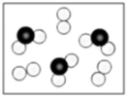
(5)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,在该转化关系中还原剂是__________ (填化学式),示意图中转移电子的数目为______ 。


(6)由X、Y、M三种元素组成的离子,在水溶液中与H+和OH-均不能大量共存,还能和氯水反应,写出其与新制氯水反应的离子方程式_______________________ 。
(1)R在元素周期表中的位置是
(2)写出X、Y、N按原子个数之比1:1:1:形成的化合物的电子式
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式
(4)Z元素的单质能与Y和R形成的化合物在一定条件下发生反应,同时放出大量的热,其反应的化学方程式为
(5)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,在该转化关系中还原剂是



(6)由X、Y、M三种元素组成的离子,在水溶液中与H+和OH-均不能大量共存,还能和氯水反应,写出其与新制氯水反应的离子方程式
您最近一年使用:0次
2017-12-08更新
|
238次组卷
|
3卷引用:【优等生百日捷进提升系列】专题06 物质结构(必修)
9 . 砷(33As)在元素周期表中与氮、磷同主族,其在自然界存在的主要化合物有砒霜(As2O3)、雄黄( As4S4)、雌黄(As2S3)等。
(1)砷在元素周期表中的位置为________ 。
(2)在一定条件下,雄黄(As4S4(雄黄中As元素化合价为+2)和雌黄As2S3之间的转化关系如图所示。
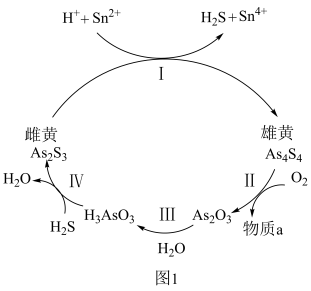
①H3AsO3中砷元素呈_______ 价;则在转化关系I中,被还原的元素名称是____________ 。
②反应Ⅱ中,若1mol As4S4参加反应时,转移12mole-,则物质a为______ (填化学式);将As2O3(俗称砒霜)在高温下用焦炭还原可制备砷,同时产生一种无毒气体,写出用焦炭还原As2O3时的化学方程式:_________ 。
③在转化关系Ⅲ中,将As2O3溶于热水生成亚砷酸(H3AsO3),已知H3AsO3是两性偏酸性的化合物,Na3AsO3溶液呈碱性,原因是_________ (用水解离子方程式表示)。
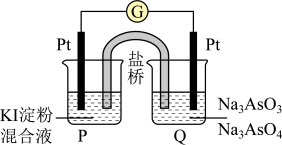
(3)某原电池装置如图,电池总反应为AsO +2I-+H2O
+2I-+H2O AsO
AsO +I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为
+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为___________ 。
(1)砷在元素周期表中的位置为
(2)在一定条件下,雄黄(As4S4(雄黄中As元素化合价为+2)和雌黄As2S3之间的转化关系如图所示。

①H3AsO3中砷元素呈
②反应Ⅱ中,若1mol As4S4参加反应时,转移12mole-,则物质a为
③在转化关系Ⅲ中,将As2O3溶于热水生成亚砷酸(H3AsO3),已知H3AsO3是两性偏酸性的化合物,Na3AsO3溶液呈碱性,原因是
(3)某原电池装置如图,电池总反应为AsO
 +2I-+H2O
+2I-+H2O AsO
AsO +I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为
+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为
您最近一年使用:0次
2022高三·全国·专题练习
10 . 化合物F是制备某种改善睡眠药物的中间体,其合成路线如下:
(1) 的反应类型是
的反应类型是___________ 。
(2)化合物B核磁共振氢谱的吸收峰有___________ 组。
(3)化合物C的结构简式为___________ 。
(4) 的过程中,被还原的官能团是
的过程中,被还原的官能团是___________ ,被氧化的官能团是___________ 。
(5)若只考虑氟的位置异构,则化合物F的同分异构体有___________ 种。
(6)已知 、
、 和
和 的产率分别为70%、82%和80%,则
的产率分别为70%、82%和80%,则 的总产率为
的总产率为___________ 。
(7) 配合物可催化
配合物可催化 转化中
转化中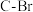 键断裂,也能催化反应①:
键断裂,也能催化反应①: (结构如下图所示)。在合成
(结构如下图所示)。在合成 的过程中,甲组使用了
的过程中,甲组使用了 催化剂,并在纯化过程中用沉淀剂除
催化剂,并在纯化过程中用沉淀剂除 ;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。 产品催化性能出现差异的原因是
产品催化性能出现差异的原因是___________ 。

(1)
 的反应类型是
的反应类型是(2)化合物B核磁共振氢谱的吸收峰有
(3)化合物C的结构简式为
(4)
 的过程中,被还原的官能团是
的过程中,被还原的官能团是(5)若只考虑氟的位置异构,则化合物F的同分异构体有
(6)已知
 、
、 和
和 的产率分别为70%、82%和80%,则
的产率分别为70%、82%和80%,则 的总产率为
的总产率为(7)
 配合物可催化
配合物可催化 转化中
转化中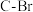 键断裂,也能催化反应①:
键断裂,也能催化反应①:反应①:
 (结构如下图所示)。在合成
(结构如下图所示)。在合成 的过程中,甲组使用了
的过程中,甲组使用了 催化剂,并在纯化过程中用沉淀剂除
催化剂,并在纯化过程中用沉淀剂除 ;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
 产品催化性能出现差异的原因是
产品催化性能出现差异的原因是
您最近一年使用:0次
2022-07-12更新
|
9606次组卷
|
16卷引用:专题18 有机化学基础(综合题)-2022年高考真题模拟题分项汇编
(已下线)专题18 有机化学基础(综合题)-2022年高考真题模拟题分项汇编(已下线)考点45 有机化合物的合成-备战2023年高考化学一轮复习考点帮(全国通用)湖北省武汉市第一中学2022-2023学年高三上学期9月开学考试化学试题陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题陕西师范大学附属中学、渭北中学等2023届高三上学期期初检测联考化学试题(已下线)第35讲 生物大分子与合成高分子(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)热点情景汇编-专题十一 有机推断中的新发展(已下线)第一部分 二轮专题突破 大题突破5 有机综合推断(选考)(已下线)专题21 有机推断题(已下线)专题21 有机推断题(已下线)专题16 有机合成与推断-2023年高考化学真题题源解密(新高考专用)(已下线)考点39 有机推断(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)新疆乌鲁木齐市第四十中学2023-2024学年高三上学期11月月考化学试题2022年湖北省高考真题化学试题(已下线)2022年湖北省高考真题变式题16-19(已下线)专题13 有机推断与合成综合题-【好题汇编】3年(2022-2024)高考1年模拟化学真题分类汇编(湖北专用)



