解题方法
1 . 一种新型化合物的结构如图所示,W、X、Y、Z是原子序数依次增大的短周期主族元素,基态X原子核外未成对电子数为1.下列说法错误的是
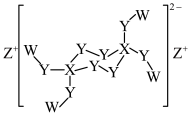
| A.基态Z原子核外电子的空间运动状态有6种 |
| B.该化合物中Y元素的化合价只有一种 |
| C.X的最高价氧化物对应的水化物是一种一元弱酸 |
| D.W、X、Z三种元素组成的强还原剂中含有离子键、共价键和配位键 |
您最近一年使用:0次
解题方法
2 . 尿素[ ]是一种白色晶体,是目前含氮量最高的氮肥。下列说法错误的是
]是一种白色晶体,是目前含氮量最高的氮肥。下列说法错误的是
 ]是一种白色晶体,是目前含氮量最高的氮肥。下列说法错误的是
]是一种白色晶体,是目前含氮量最高的氮肥。下列说法错误的是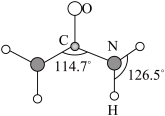
A. 键与 键与 键的数目之比为7:1 键的数目之比为7:1 | B.C、N原子的杂化方式均为 |
| C.尿素分子间存在范德华力和氢键 | D.第一电离能: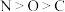 |
您最近一年使用:0次
3 .  为阿伏伽德罗常数的值。下列说法正确的是
为阿伏伽德罗常数的值。下列说法正确的是
 为阿伏伽德罗常数的值。下列说法正确的是
为阿伏伽德罗常数的值。下列说法正确的是A.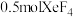 中Xe的价层电子对数为 中Xe的价层电子对数为 |
B.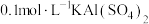 溶液中 溶液中 的数目为 的数目为 |
C.已知 ,每生成 ,每生成 转移电子的数目为 转移电子的数目为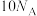 |
D.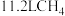 和 和 (均为标准状况)在光照下充分反应后的分子数为 (均为标准状况)在光照下充分反应后的分子数为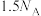 |
您最近一年使用:0次
4 . 路易斯提出一种酸碱理论:将能接受电子对的物质称为路易斯酸。三卤化硼( )是一种路易斯酸,可用作有机合成催化剂,
)是一种路易斯酸,可用作有机合成催化剂, 中存在大
中存在大 键。下列说法错误的是
键。下列说法错误的是
 )是一种路易斯酸,可用作有机合成催化剂,
)是一种路易斯酸,可用作有机合成催化剂, 中存在大
中存在大 键。下列说法错误的是
键。下列说法错误的是A. 是路易斯酸 是路易斯酸 |
B. 可与 可与 形成化合物 形成化合物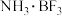 |
C.卤素原子半径越大,越容易与B形成大 键 键 |
D.热稳定性: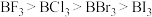 |
您最近一年使用:0次
解题方法
5 . 废水中的氨氮是水体富营养化和环境污染的重要物质,工业上可采取加入生物菌以及化学试剂等多种工艺进行无害化处理,反应机理如图所示。若该酸性废水中 浓度为
浓度为 ,回答下列问题:
,回答下列问题:
②氧化性: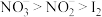 ;
;
③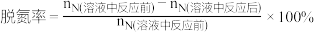 。
。
(1)由图可知,处理 的工艺有
的工艺有__________ 种,“反硝化”过程中,还可选用 代替
代替 进行绿色处理,发生反应的离子方程式为
进行绿色处理,发生反应的离子方程式为__________ 。
(2)“硝化与反硝化”脱氮工艺中,若外加试剂量不足,会有 剩余。已知该过程脱氮率为
剩余。已知该过程脱氮率为 ,取
,取 脱氮后溶液加入足量
脱氮后溶液加入足量 溶液,测得生成
溶液,测得生成 2与
2与 (标准状况,下同),则脱氮后溶液中剩余
(标准状况,下同),则脱氮后溶液中剩余 浓度为
浓度为__________  ,每升原酸性废液中通入
,每升原酸性废液中通入 的体积为
的体积为__________  。
。
(3)折点加氯法是将次氯酸钠投入酸性废水中的脱氮工艺。向酸性废水中投入 溶液时,
溶液时, 浓度、氯胺
浓度、氯胺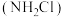 浓度与投入的
浓度与投入的 溶液体积的关系如图所示。实验证明,酸性有助于提高废水脱氮率,其原因是
溶液体积的关系如图所示。实验证明,酸性有助于提高废水脱氮率,其原因是__________ 。在酸性废水中,投入的 在
在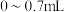 过程中发生反应:
过程中发生反应: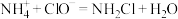 ,投入量在
,投入量在 的过程中发生反应的离子方程式为
的过程中发生反应的离子方程式为__________ 。某酸性条件下,当投入的 与溶液中
与溶液中 的物质的量比为
的物质的量比为 时,脱氮率降低.从氧化还原反应的角度分析可能的原因是
时,脱氮率降低.从氧化还原反应的角度分析可能的原因是__________ 。
 浓度为
浓度为 ,回答下列问题:
,回答下列问题: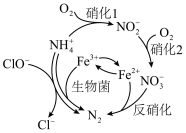
②氧化性:
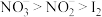 ;
;③
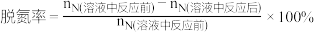 。
。(1)由图可知,处理
 的工艺有
的工艺有 代替
代替 进行绿色处理,发生反应的离子方程式为
进行绿色处理,发生反应的离子方程式为(2)“硝化与反硝化”脱氮工艺中,若外加试剂量不足,会有
 剩余。已知该过程脱氮率为
剩余。已知该过程脱氮率为 ,取
,取 脱氮后溶液加入足量
脱氮后溶液加入足量 溶液,测得生成
溶液,测得生成 2与
2与 (标准状况,下同),则脱氮后溶液中剩余
(标准状况,下同),则脱氮后溶液中剩余 浓度为
浓度为 ,每升原酸性废液中通入
,每升原酸性废液中通入 的体积为
的体积为 。
。(3)折点加氯法是将次氯酸钠投入酸性废水中的脱氮工艺。向酸性废水中投入
 溶液时,
溶液时, 浓度、氯胺
浓度、氯胺 浓度与投入的
浓度与投入的 溶液体积的关系如图所示。实验证明,酸性有助于提高废水脱氮率,其原因是
溶液体积的关系如图所示。实验证明,酸性有助于提高废水脱氮率,其原因是 在
在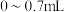 过程中发生反应:
过程中发生反应: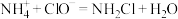 ,投入量在
,投入量在 的过程中发生反应的离子方程式为
的过程中发生反应的离子方程式为 与溶液中
与溶液中 的物质的量比为
的物质的量比为 时,脱氮率降低.从氧化还原反应的角度分析可能的原因是
时,脱氮率降低.从氧化还原反应的角度分析可能的原因是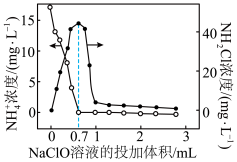
您最近一年使用:0次
2024-08-21更新
|
54次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一上学期12月学科素养测试化学试题
6 .  表示阿伏伽德罗常数的值,下列说法正确的是
表示阿伏伽德罗常数的值,下列说法正确的是
 表示阿伏伽德罗常数的值,下列说法正确的是
表示阿伏伽德罗常数的值,下列说法正确的是A.Na2Sx发生氧化反应生成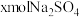 失去电子数为 失去电子数为 |
B.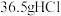 和 和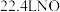 气体所含原子数均为 气体所含原子数均为 |
C.足量铁粉与 氯气反应转移电子数为 氯气反应转移电子数为 |
D. 锌与适量浓硫酸恰好反应生成 锌与适量浓硫酸恰好反应生成 与 与 的分子总数为 的分子总数为 |
您最近一年使用:0次
解题方法
7 .  (雌黄)可转化为用于治疗白血病的亚砷酸(
(雌黄)可转化为用于治疗白血病的亚砷酸( )。亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示:
)。亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示:
(1)人体血液的pH为7.35~7.45,用药后血液中所含砷元素的主要微粒是___________ 。
(2)pH小于6时, 物质的量分数接近1.0的原因是
物质的量分数接近1.0的原因是___________ 。
(3) 的电离平衡常数
的电离平衡常数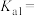
___________ 。
(4)将KOH溶液滴入 溶液中发生反应。
溶液中发生反应。
①在pH为11~12时,发生反应的离子方程式为___________ 。 时,溶液中
时,溶液中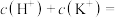
___________ 。
②a点时溶液中离子浓度由大到小的顺序为___________ 。
 (雌黄)可转化为用于治疗白血病的亚砷酸(
(雌黄)可转化为用于治疗白血病的亚砷酸( )。亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示:
)。亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示: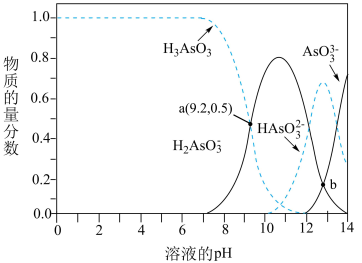
(1)人体血液的pH为7.35~7.45,用药后血液中所含砷元素的主要微粒是
(2)pH小于6时,
 物质的量分数接近1.0的原因是
物质的量分数接近1.0的原因是(3)
 的电离平衡常数
的电离平衡常数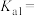
(4)将KOH溶液滴入
 溶液中发生反应。
溶液中发生反应。①在pH为11~12时,发生反应的离子方程式为
 时,溶液中
时,溶液中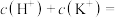
②a点时溶液中离子浓度由大到小的顺序为
您最近一年使用:0次
解题方法
8 . 以菱镁矿(主要成分为 ,含少量
,含少量 、
、 和
和 )为原料制备高纯镁砂(MgO)的工艺流程如下:
)为原料制备高纯镁砂(MgO)的工艺流程如下: 、
、 和
和 ;相关物质的平衡常数见下表。
;相关物质的平衡常数见下表。
回答下列问题:
(1)“浸出”操作中发生主要反应的化学方程式为___________ 。
(2)常温下,当某种离子浓度小于 mol⋅L
mol⋅L 时,认为该离子已完全沉淀。浸出液的pH最小值为
时,认为该离子已完全沉淀。浸出液的pH最小值为___________ 时, 、
、 已完全沉淀到废渣中;若认为“浸出”前后溶液pH不变,则氯化铵溶液的最小浓度应不低于
已完全沉淀到废渣中;若认为“浸出”前后溶液pH不变,则氯化铵溶液的最小浓度应不低于___________ mol·L 。
。
(3)上述流程中可循环使用的物质有___________ (用化学式表示)。
(4)“浸出”所需的温度比“沉镁”___________ (填“高”、“低”或“相同”),请说明理由:___________ 。
 ,含少量
,含少量 、
、 和
和 )为原料制备高纯镁砂(MgO)的工艺流程如下:
)为原料制备高纯镁砂(MgO)的工艺流程如下: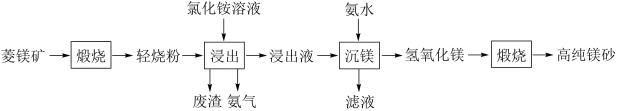
 、
、 和
和 ;相关物质的平衡常数见下表。
;相关物质的平衡常数见下表。| 物质 |  |  |  |  |
| 平衡常数 |  | 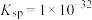 | 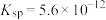 |  |
(1)“浸出”操作中发生主要反应的化学方程式为
(2)常温下,当某种离子浓度小于
 mol⋅L
mol⋅L 时,认为该离子已完全沉淀。浸出液的pH最小值为
时,认为该离子已完全沉淀。浸出液的pH最小值为 、
、 已完全沉淀到废渣中;若认为“浸出”前后溶液pH不变,则氯化铵溶液的最小浓度应不低于
已完全沉淀到废渣中;若认为“浸出”前后溶液pH不变,则氯化铵溶液的最小浓度应不低于 。
。(3)上述流程中可循环使用的物质有
(4)“浸出”所需的温度比“沉镁”
您最近一年使用:0次
9 .  为无色液体,是一种常见的溶剂,在化工生产中有重要作用。天然气法合成
为无色液体,是一种常见的溶剂,在化工生产中有重要作用。天然气法合成 相关反应如下:
相关反应如下:
反应 .
.
 kJ·mol-1
kJ·mol-1
反应 .
.
 kJ·mol-1
kJ·mol-1
(1)反应 的正反应活化能
的正反应活化能___________ (填“>”、“<”或“=”)逆反应活化能;某温度下若 完全分解成
完全分解成 ,在密闭容器中,以
,在密闭容器中,以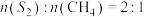 开始反应,当
开始反应,当 体积分数为10%时,
体积分数为10%时, 转化率为
转化率为___________ 。
(2)利用工业废气 生产
生产 的反应为
的反应为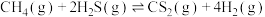 。向某密闭容器充入1 mol
。向某密闭容器充入1 mol  、2 mol
、2 mol  ,维持体系压强不变,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。
,维持体系压强不变,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。___________ (填“放热”或“吸热”)反应。
②图中表示 的曲线是
的曲线是___________ (填“a”、“b”、“c”或“d”)。
③780℃时, 的物质的量是
的物质的量是___________ mol;维持m点温度不变,向容器中再通入 、
、 、
、 、
、 各1 mol,此时速率关系为v(正)
各1 mol,此时速率关系为v(正)___________ v(逆)(填“>”、“<”或“=”)。
 为无色液体,是一种常见的溶剂,在化工生产中有重要作用。天然气法合成
为无色液体,是一种常见的溶剂,在化工生产中有重要作用。天然气法合成 相关反应如下:
相关反应如下:反应
 .
.
 kJ·mol-1
kJ·mol-1反应
 .
.
 kJ·mol-1
kJ·mol-1(1)反应
 的正反应活化能
的正反应活化能 完全分解成
完全分解成 ,在密闭容器中,以
,在密闭容器中,以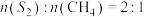 开始反应,当
开始反应,当 体积分数为10%时,
体积分数为10%时, 转化率为
转化率为(2)利用工业废气
 生产
生产 的反应为
的反应为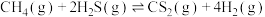 。向某密闭容器充入1 mol
。向某密闭容器充入1 mol  、2 mol
、2 mol  ,维持体系压强不变,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。
,维持体系压强不变,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。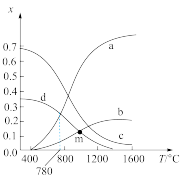
②图中表示
 的曲线是
的曲线是③780℃时,
 的物质的量是
的物质的量是 、
、 、
、 、
、 各1 mol,此时速率关系为v(正)
各1 mol,此时速率关系为v(正)
您最近一年使用:0次
解题方法
10 . 乙酸(HAc)是一种重要的化学试剂,其性质与电离平衡密切相关。实验小组同学研究25℃时HAc电离平衡的影响因素。
提出假设:稀释HAc溶液或改变 浓度,HAc电离平衡会发生移动。
浓度,HAc电离平衡会发生移动。
用浓度均为0.1 moL·L 的HAc和NaAc溶液,按下表配制总体积相同的系列溶液,测定pH,记录数据。(已知:25℃时,HAc的
的HAc和NaAc溶液,按下表配制总体积相同的系列溶液,测定pH,记录数据。(已知:25℃时,HAc的 )
)
回答下列问题:
(1)根据表中信息,
___________ ,
___________ 。
(2)由实验 和
和 可知,稀释HAc溶液,电离平衡将
可知,稀释HAc溶液,电离平衡将___________ (填“正向移动”、“逆向移动”或“不移动”),理由是___________ ;由实验 ~
~ 可知,增大
可知,增大 浓度,HAc电离平衡逆向移动。提出的假设成立。
浓度,HAc电离平衡逆向移动。提出的假设成立。
(3)小组分析上表数据发现:随着 的增加,
的增加, 的值逐渐接近HAc的
的值逐渐接近HAc的 。查阅资料获悉:一定条件下,按
。查阅资料获悉:一定条件下,按 配制的溶液中,
配制的溶液中, 的值等于HAc的
的值等于HAc的 。对比数据发现,实验
。对比数据发现,实验 中
中 与资料数据
与资料数据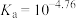 存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定HAc溶液的浓度再验证。
存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定HAc溶液的浓度再验证。
①移取20.00 mL HAc溶液,加入2滴酚酞溶液,用0.1000 mol·L NaOH溶液滴定至终点,消耗体积为22.08 mL,则该HAc溶液的浓度为
NaOH溶液滴定至终点,消耗体积为22.08 mL,则该HAc溶液的浓度为___________ moL·L 。
。
②用上述HAc溶液和0.1000 mol·L NaOH溶液,配制等物质的量的HAc与NaAc混合溶液,测定pH,结果与资料数据相符。
NaOH溶液,配制等物质的量的HAc与NaAc混合溶液,测定pH,结果与资料数据相符。
(4)小组进一步提出:利用浓度均约为0.1 mol·L 的HAc和NaOH溶液,可测定HAc的
的HAc和NaOH溶液,可测定HAc的 。小组同学设计方案并进行实验,请完成下表中
。小组同学设计方案并进行实验,请完成下表中 的内容。
的内容。
实验结论:得到的结果与资料数据相符,方案可行。
提出假设:稀释HAc溶液或改变
 浓度,HAc电离平衡会发生移动。
浓度,HAc电离平衡会发生移动。用浓度均为0.1 moL·L
 的HAc和NaAc溶液,按下表配制总体积相同的系列溶液,测定pH,记录数据。(已知:25℃时,HAc的
的HAc和NaAc溶液,按下表配制总体积相同的系列溶液,测定pH,记录数据。(已知:25℃时,HAc的 )
)| 序号 | V(HAc)/mL | V(NaAc)/mL |  /mL /mL |  | pH |
 | 40.00 | / | / | 0 | 2.86 |
 | 4.00 | / | 36.00 | 0 | 3.36 |
| … | |||||
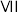 | 4.00 | a | b | 3:4 | 4.53 |
 | 4.00 | 4.00 | 32.00 | 1:1 | 4.65 |
(1)根据表中信息,


(2)由实验
 和
和 可知,稀释HAc溶液,电离平衡将
可知,稀释HAc溶液,电离平衡将 ~
~ 可知,增大
可知,增大 浓度,HAc电离平衡逆向移动。提出的假设成立。
浓度,HAc电离平衡逆向移动。提出的假设成立。(3)小组分析上表数据发现:随着
 的增加,
的增加, 的值逐渐接近HAc的
的值逐渐接近HAc的 。查阅资料获悉:一定条件下,按
。查阅资料获悉:一定条件下,按 配制的溶液中,
配制的溶液中, 的值等于HAc的
的值等于HAc的 。对比数据发现,实验
。对比数据发现,实验 中
中 与资料数据
与资料数据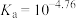 存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定HAc溶液的浓度再验证。
存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定HAc溶液的浓度再验证。①移取20.00 mL HAc溶液,加入2滴酚酞溶液,用0.1000 mol·L
 NaOH溶液滴定至终点,消耗体积为22.08 mL,则该HAc溶液的浓度为
NaOH溶液滴定至终点,消耗体积为22.08 mL,则该HAc溶液的浓度为 。
。②用上述HAc溶液和0.1000 mol·L
 NaOH溶液,配制等物质的量的HAc与NaAc混合溶液,测定pH,结果与资料数据相符。
NaOH溶液,配制等物质的量的HAc与NaAc混合溶液,测定pH,结果与资料数据相符。(4)小组进一步提出:利用浓度均约为0.1 mol·L
 的HAc和NaOH溶液,可测定HAc的
的HAc和NaOH溶液,可测定HAc的 。小组同学设计方案并进行实验,请完成下表中
。小组同学设计方案并进行实验,请完成下表中 的内容。
的内容。 | 移取20.00 mL HAc溶液,用NaOH溶液滴定至终点,消耗NaOH溶液 mL。 mL。 |
 |
您最近一年使用:0次



