名校
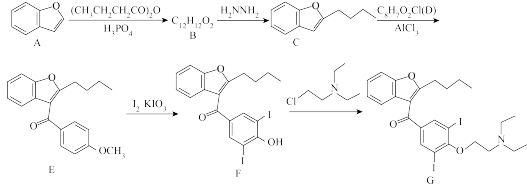
1 . 胺碘酮(G),属Ⅲ类抗心律失常药物,以有机物A为原料,其合成路线如下:
(1)A中官能团名称为__________ 。
(2)化合物B的结构简式是__________ 。
(3)B生成C的反应类型为__________ 。
(4)写出C生成E的反应方程式__________________ 。
(5)请写出满足以下条件的D的同分异构体__________ 。
①含有苯环且苯环上只有一个取代基
②1mol该物质水解消耗3molNaOH
(6)由苯和乙酸酐 合成苯乙烯的路线如下,反应条件已省略。
合成苯乙烯的路线如下,反应条件已省略。____________________ ;N____________________ 。
已知: +(RCO)2O
+(RCO)2O
 +RCOOH。
+RCOOH。
(1)A中官能团名称为
(2)化合物B的结构简式是
(3)B生成C的反应类型为
(4)写出C生成E的反应方程式
(5)请写出满足以下条件的D的同分异构体
①含有苯环且苯环上只有一个取代基
②1mol该物质水解消耗3molNaOH
(6)由苯和乙酸酐
 合成苯乙烯的路线如下,反应条件已省略。
合成苯乙烯的路线如下,反应条件已省略。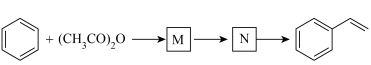
您最近一年使用:0次
2024-07-18更新
|
172次组卷
|
2卷引用:吉林省辽宁省实验中学联考2023-2024学年高二下学期7月期末考试化学试题
名校
2 . 抗癌药托瑞米芬的前体K的合成路线如下。 溶液反应产生
溶液反应产生 ,其钠盐可用于食品防腐。有机物B能与
,其钠盐可用于食品防腐。有机物B能与 溶液反应,但不产生
溶液反应,但不产生 ;B加氢可得环己醇。
;B加氢可得环己醇。
③F是一种天然香料,经碱性水解、酸化,得G和J,G经氧化可转化为J。
下列说法错误的是
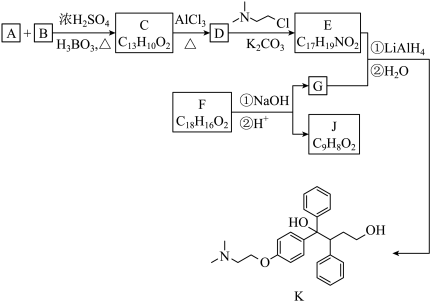
①
 溶液反应产生
溶液反应产生 ,其钠盐可用于食品防腐。有机物B能与
,其钠盐可用于食品防腐。有机物B能与 溶液反应,但不产生
溶液反应,但不产生 ;B加氢可得环己醇。
;B加氢可得环己醇。③F是一种天然香料,经碱性水解、酸化,得G和J,G经氧化可转化为J。
下列说法错误的是
| A.物质A的化学名称为苯甲酸 | B.D与E的反应为取代反应 |
| C.J含有三种官能团 | D.E和G反应得到K的过程中, 的作用是还原剂 的作用是还原剂 |
您最近一年使用:0次
2024-07-18更新
|
161次组卷
|
2卷引用:吉林省辽宁省实验中学联考2023-2024学年高二下学期7月期末考试化学试题
名校
解题方法
3 . 吡啶(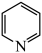 )和吡咯(
)和吡咯(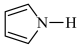 )是重要的化工原料。它们与苯相似,存在大
)是重要的化工原料。它们与苯相似,存在大 键。下列说法错误的是
键。下列说法错误的是
| A.吡啶中所有原子共平面 | B.吡啶在水中的溶解度大于苯在水中的溶解度 |
| C.吡啶接受质子能力强于吡咯 | D.4-甲基吡啶(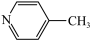 )的二氯取代物有6种 )的二氯取代物有6种 |
您最近一年使用:0次
2024-07-18更新
|
188次组卷
|
2卷引用:吉林省辽宁省实验中学联考2023-2024学年高二下学期7月期末考试化学试题
名校
4 . 硒是人体不可缺少的微量元素,铈是稀土元素中丰度最大的元素,它们的化合物在生产、生活中有着广泛的应用。回答下列问题:
(1)基态Se原子的核外价电子轨道表示式为___________ 。
(2)“依布硒”是一种有机硒化物,具有良好的抗炎活性,其结构简式如图1所示。“依布硒”中Se原子的杂化类型为___________ ,元素Se、O、N的第一电离能由大到小的顺序为___________ 。___________ 。___________ SF6 (填“>”或“<”或“=”),原因是___________ 。
(5)二氧化铈(CeO2)氧载体具有良好的储氧放氧能力,可用于甲烷化学链重整,其原理如下图所示。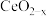 中x=
中x=___________ , 和Ce3+个数比为
和Ce3+个数比为___________ 。
(1)基态Se原子的核外价电子轨道表示式为
(2)“依布硒”是一种有机硒化物,具有良好的抗炎活性,其结构简式如图1所示。“依布硒”中Se原子的杂化类型为
(5)二氧化铈(CeO2)氧载体具有良好的储氧放氧能力,可用于甲烷化学链重整,其原理如下图所示。
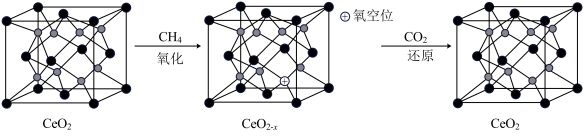
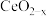 中x=
中x= 和Ce3+个数比为
和Ce3+个数比为
您最近一年使用:0次
2024-07-04更新
|
53次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高二下学期6月月考化学试题
2024·黑龙江吉林·模拟预测
解题方法
5 . 碱式碳酸铜[Cu2(OH)2CO3](M=222g/mol)是孔雀石主要成分,绿色晶体,在冷水中的溶解度很小,在沸水中易分解。实验室制备Cu2(OH)2CO3步骤如下:
 .将CuSO4•5H2O和Na2CO3分别溶解配制成浓度为0.5
.将CuSO4•5H2O和Na2CO3分别溶解配制成浓度为0.5 的溶液;
的溶液;
Ⅱ.按不同的物质的量之比将CuSO4溶液和Na2CO3溶液混合,在一定温度下搅拌,监测沉淀的生成速率和质量;
Ⅲ.静置,减压过滤,洗涤,干燥,得产品,测定产品纯度。
表一反应物物质的量之比对产物的影响
表二反应温度对产物的影响
(1)依据表一信息,步骤Ⅱ中的CuSO4与Na2CO3最佳投料比为______ 。
(2)依据表二信息,确定步骤Ⅱ中制备温度为75℃,应采取的加热方式为_______ 。此温度下产生的沉淀量最大,可能的原因为______ 。
(3)制备碱式碳酸铜[Cu(OH)2•CuCO3]时,有一种无色无味气体生成,则离子方程式为______ 。
(4)步骤Ⅲ中测定样品纯度实验如下:取三份质量均为0.2400g碱式碳酸铜[Cu2(OH)2CO3]样品,溶解,以淀粉为指示剂,加入过量KI溶液,保持体系密封避光5min后,用0.1000mol/LNa2S2O3标准液滴定,反应原理为2Cu2++4I-=2CuI↓+I2,2S2O +I2=S4O
+I2=S4O +2I-,使用标准液体积分别为19.98mL、20.02mL、20.90mL,产品的纯度为
+2I-,使用标准液体积分别为19.98mL、20.02mL、20.90mL,产品的纯度为_______ 。
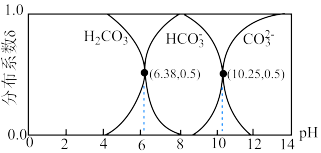
(5)制备碱式碳酸铜也可以利用Na2CO3和NaHCO3的混合溶液,已知25℃时,碱式碳酸铜的饱和溶液pH约为8.5,溶液中H2CO3、HCO 、CO
、CO 的分布系数δ随pH的变化如图。当恰好形成饱和碱式碳酸铜溶液时,溶液中c(CO
的分布系数δ随pH的变化如图。当恰好形成饱和碱式碳酸铜溶液时,溶液中c(CO )∶c(HCO
)∶c(HCO )=
)=_______ 。______ 。
 .将CuSO4•5H2O和Na2CO3分别溶解配制成浓度为0.5
.将CuSO4•5H2O和Na2CO3分别溶解配制成浓度为0.5 的溶液;
的溶液;Ⅱ.按不同的物质的量之比将CuSO4溶液和Na2CO3溶液混合,在一定温度下搅拌,监测沉淀的生成速率和质量;
Ⅲ.静置,减压过滤,洗涤,干燥,得产品,测定产品纯度。
表一反应物物质的量之比对产物的影响
| n(CuSO4)∶n(Na2CO3) | 1∶0.9 | 1∶1.1 | 1∶1.2 | 1∶1.4 |
| 沉淀生成速率 | 很慢 | 慢 | 快 | 很快 |
| 最终沉淀质量/g | 0.547 | 0.533 | 0.549 | 0.527 |
| 温度/℃ | 65 | 70 | 75 | 85 |
| 沉淀生成速率 | 较慢 | 较快 | 快 | 较快 |
| 最终沉淀质量/g | 1.303 | 1.280 | 1.451 | 1.280 |
(1)依据表一信息,步骤Ⅱ中的CuSO4与Na2CO3最佳投料比为
(2)依据表二信息,确定步骤Ⅱ中制备温度为75℃,应采取的加热方式为
(3)制备碱式碳酸铜[Cu(OH)2•CuCO3]时,有一种无色无味气体生成,则离子方程式为
(4)步骤Ⅲ中测定样品纯度实验如下:取三份质量均为0.2400g碱式碳酸铜[Cu2(OH)2CO3]样品,溶解,以淀粉为指示剂,加入过量KI溶液,保持体系密封避光5min后,用0.1000mol/LNa2S2O3标准液滴定,反应原理为2Cu2++4I-=2CuI↓+I2,2S2O
 +I2=S4O
+I2=S4O +2I-,使用标准液体积分别为19.98mL、20.02mL、20.90mL,产品的纯度为
+2I-,使用标准液体积分别为19.98mL、20.02mL、20.90mL,产品的纯度为(5)制备碱式碳酸铜也可以利用Na2CO3和NaHCO3的混合溶液,已知25℃时,碱式碳酸铜的饱和溶液pH约为8.5,溶液中H2CO3、HCO
 、CO
、CO 的分布系数δ随pH的变化如图。当恰好形成饱和碱式碳酸铜溶液时,溶液中c(CO
的分布系数δ随pH的变化如图。当恰好形成饱和碱式碳酸铜溶液时,溶液中c(CO )∶c(HCO
)∶c(HCO )=
)=
您最近一年使用:0次
名校
6 . Ⅰ、CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
①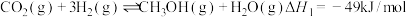
②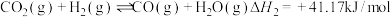
③
(1)③___________ (填“高温自发”“低温自发”或“任何温度下都自发”),该反应中活化能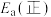
___________ 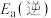 。(填“>”或“<”)
。(填“>”或“<”)
(2)反应①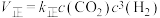 ,
, ,(
,( 、
、 只是温度的函数)。若该温度下的平衡常数K=10,则
只是温度的函数)。若该温度下的平衡常数K=10,则
___________  。升高温度,
。升高温度, 增大的倍数
增大的倍数___________ (填“大于”“小于”或“等于”) 增大的倍数。
增大的倍数。
(3)一定压强下,往某密闭容器中按投料比 充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。___________ 。
A.恒温恒压时充入氦气,反应①、③的平衡均逆向移动,反应②不移动
B.增大 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大
C.图中X、Y分别代表CO、H2O
D.体系中的CO2的物质的量分数随温度变化不大,原因是温度变化,反应①、②的平衡移动方向相反
②在一定温度下,向恒容密闭容器中充入lnolCO2和3molH2,仅发生反应①。实验测得CH3OH的平衡分压与起始投料比[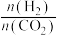 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=___________  (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
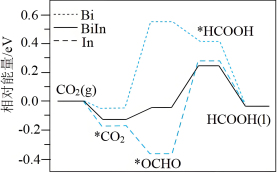
(4)我国学者探究了BiIn合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是___________ 。
①
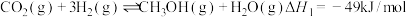
②
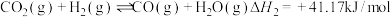
③

(1)③
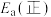
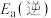 。(填“>”或“<”)
。(填“>”或“<”)(2)反应①
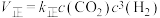 ,
, ,(
,( 、
、 只是温度的函数)。若该温度下的平衡常数K=10,则
只是温度的函数)。若该温度下的平衡常数K=10,则
 。升高温度,
。升高温度, 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。(3)一定压强下,往某密闭容器中按投料比
 充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。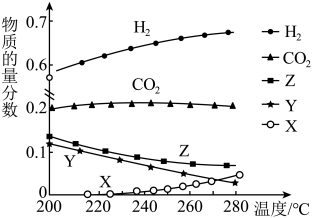
A.恒温恒压时充入氦气,反应①、③的平衡均逆向移动,反应②不移动
B.增大
 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大C.图中X、Y分别代表CO、H2O
D.体系中的CO2的物质的量分数随温度变化不大,原因是温度变化,反应①、②的平衡移动方向相反
②在一定温度下,向恒容密闭容器中充入lnolCO2和3molH2,仅发生反应①。实验测得CH3OH的平衡分压与起始投料比[
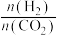 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp= (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。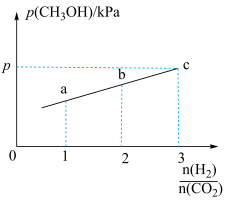
(4)我国学者探究了BiIn合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是
您最近一年使用:0次
2024-05-24更新
|
582次组卷
|
3卷引用:吉林省长春市东北师范大学附属实验学校2023-2024学年高三下学期七模化学试题
7 . 常温下,Ka(CH3COOH)=1.0×10-5, 向某含有ZnSO4酸性废液加入一定量CH3COONa后,再通入H2S生成ZnS沉淀,始终保持H2S饱和,即c(H2S)=0.1mol/L,体系中pX[pX=—1gX,X为 、
、 或c(Zn2+), 单位为 mol/L]与
或c(Zn2+), 单位为 mol/L]与 关系如图。下列说法错误的是
关系如图。下列说法错误的是
 、
、 或c(Zn2+), 单位为 mol/L]与
或c(Zn2+), 单位为 mol/L]与 关系如图。下列说法错误的是
关系如图。下列说法错误的是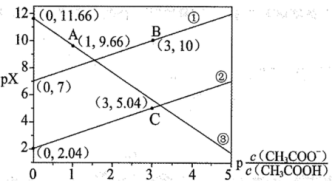
A.②中X为 | B.A 点溶液的pH为4 |
| C.Ka1(H₂S) 的数量级为10-7 | D.Ksp(ZnS)=10-21.7 |
您最近一年使用:0次
2024-03-22更新
|
931次组卷
|
4卷引用:2024届吉林省通化市梅河口市第五中学高三下学期一模化学试题
8 . 锰、铁、钛等过渡金属元素化合物的应用研究是当今前沿科学之一、回答下列问题:
(1)熔融态的MnO和MnS均能导电,则熔点高的是___________ (填物质化学式),原因为___________ 。
(2)铁氮化合物晶体中铁原子为面心立方最密堆积,氮原子位于体心,其晶胞沿z轴的投影如图甲所示,Fel、N间最近距离为apm,则该晶体的晶胞参数为___________ pm。 。
。___________ 。
②Q点的分数坐标为___________ 。
(4)TiO2属于四方晶系,晶胞参数α=β=γ=90°。研究表明,TiO2通过氮掺杂反应生成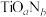 ,能使TiO2对可见光具有活性,反应如图丙所示。
,能使TiO2对可见光具有活性,反应如图丙所示。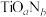 晶体化学式中a=
晶体化学式中a=___________ ,b=___________ 。
②TiO2的密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
___________ (列出表达式)。
(1)熔融态的MnO和MnS均能导电,则熔点高的是
(2)铁氮化合物晶体中铁原子为面心立方最密堆积,氮原子位于体心,其晶胞沿z轴的投影如图甲所示,Fel、N间最近距离为apm,则该晶体的晶胞参数为

 。
。
②Q点的分数坐标为
(4)TiO2属于四方晶系,晶胞参数α=β=γ=90°。研究表明,TiO2通过氮掺杂反应生成
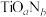 ,能使TiO2对可见光具有活性,反应如图丙所示。
,能使TiO2对可见光具有活性,反应如图丙所示。
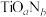 晶体化学式中a=
晶体化学式中a=②TiO2的密度为
 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
您最近一年使用:0次
2023-08-02更新
|
645次组卷
|
5卷引用:吉林省通化市梅河口市第五中学2024-2025学年高三上学期开学考试化学试题
吉林省通化市梅河口市第五中学2024-2025学年高三上学期开学考试化学试题山东省威海市2022-2023学年高二下学期期末考试化学试题(已下线)题型02 晶胞的分析与计算-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)山东省惠民县2023-2024学年高二下学期期中考试化学试题河南省南阳市方城县第一高级中学2023-2024学年高二下学期7月期末考试化学试题
名校
9 . 乙醇和乙酸在酸性条件下生成乙酸乙酯,反应机理如图,下列说法错误的是
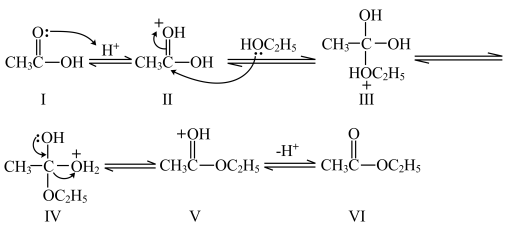
| A.Ⅰ→Ⅱ形成配位键,Ⅴ→Ⅵ断裂配位键 |
| B.Ⅱ→Ⅲ的反应的原子利用率为100% |
| C.Ⅲ→Ⅳ质子发生转移 |
| D.加入催化剂浓硫酸,能加快反应速率,不能提高平衡产率 |
您最近一年使用:0次
2023-07-07更新
|
504次组卷
|
4卷引用:吉林省通化市梅河口市第五中学2023-2024学年高二下学期半月考化学试卷
12-13高三下·江苏扬州·阶段练习
名校
解题方法
10 . 常温下,向 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液的
溶液,溶液的 随
随 溶液体积的变化如图所示。下列说法正确的是
溶液体积的变化如图所示。下列说法正确的是
 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液的
溶液,溶液的 随
随 溶液体积的变化如图所示。下列说法正确的是
溶液体积的变化如图所示。下列说法正确的是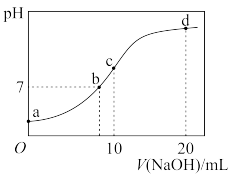
A.点 所示溶液中: 所示溶液中: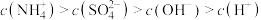 |
B.点 所示溶液中: 所示溶液中: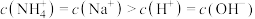 |
C.点 所示溶液中: 所示溶液中: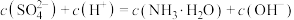 |
D.点 以后的溶液中可能出现: 以后的溶液中可能出现: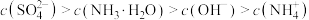 |
您最近一年使用:0次
2021-12-29更新
|
1351次组卷
|
24卷引用:吉林油田高级中学2021-2022学年高二上学期期中考试化学试题
吉林油田高级中学2021-2022学年高二上学期期中考试化学试题(已下线)2013届江苏省扬州市高三下学期5月考前适应性考试化学试卷2017届江苏省南通市高三高考全真模拟(四)化学 试卷2016-2017学年浙江省温州市“十五校联合体”高二下学期期中联考化学试卷河北省定州中学2017届高三(高补班)下学期第二次月考(4月)化学试题黑龙江省双鸭山市第一中学2017届高三全真模拟(第四次)考试理科综合化学试题浙江省2018版考前特训(2017年10月):选考仿真测试卷(四)江苏省前黄高级中学、如东高级中学、姜堰中学等五校2018届高三上学期第一次学情监测化学试题新疆2018届高三第一次适应性检测(一模)理科综合化学试题【区级联考】山东省临沂市罗庄区2018-2019学年高二上学期期末考试化学试题安徽省长丰县双墩中学2018-2019学年高二上学期期末调研化学试题河北省武邑中学2019-2020学年高二下学期3月线上考试化学试题天津市海河中学2020届高三第二学期化学测试(二)试卷辽宁省朝阳市凌源市实验中学2019-2020学年高二下学期4月份月考化学试题黑龙江省安达市第七中学2019-2020学年高二下学期第一次网络检测化学试题人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 章末综合检测卷上海交通大学附属中学2021届高三下学期3月月考化学试题天津市耀华中学2021届高三年级第二次模拟考试化学试题辽宁省朝阳市建平县实验中学2021-2022学年高二上学期期末考试化学试题江西省九江市第一中学2021-2022学年高二上学期期末化学试题江苏省秦淮中学、宇通实验学校等六校2022-2023学年高三上学期10月学情调研化学试题(已下线)【知识图鉴】单元讲练测选择性必修1第3单元03巩固练黑龙江省海伦市第一中学2022-2023学年高二上学期11月期中考试化学试题上海市部分学校2025届高三高考化学模拟卷04



