1 .  常作有机反应的催化剂。某实验小组拟制备
常作有机反应的催化剂。某实验小组拟制备 并探究其性质。
并探究其性质。
实验(一)制备 。
。
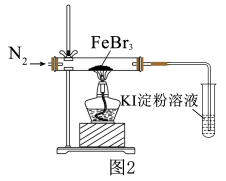
装置如图1所示。已知: 沸点为58.8℃。实验中,观察到烧瓶中产生红棕色气体。
沸点为58.8℃。实验中,观察到烧瓶中产生红棕色气体。_______ (填“溴水”或“液溴”)。用铁粉替代铁片的目的是_______ 。
(2)装置中利用到的四氯化碳的性质是_______ 。实验完毕后,将烧瓶中混合物经_______ (填实验操作名称)得到 固体。
固体。
实验(二)探究性质。
为了探究的稳定性,进行如图2实验。_______ (填实验现象)时,可以确认 发生分解反应,生成了
发生分解反应,生成了 。
。
(4)实验过程中,先通入一会儿 ,再点燃酒精灯,这样操作的目的是
,再点燃酒精灯,这样操作的目的是_______ 。
(5)为确认玻璃管中残留物有 ,宜选择试剂
,宜选择试剂_______ (填标号)。
a. 溶液 b.酸性
溶液 b.酸性 溶液
溶液
c.KSCN溶液,氯水 d. 溶液
溶液
(6)为了探究浓度对 氧化性的影响,实验操作及现象如下:
氧化性的影响,实验操作及现象如下:
已知: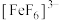 呈无色。
呈无色。
写出实验ⅰ中离子反应方程式:_______ 。
实验ⅱ“不变蓝色”的原因是_______ (结合必要化学用语和文字解释)。
 常作有机反应的催化剂。某实验小组拟制备
常作有机反应的催化剂。某实验小组拟制备 并探究其性质。
并探究其性质。实验(一)制备
 。
。装置如图1所示。已知:
 沸点为58.8℃。实验中,观察到烧瓶中产生红棕色气体。
沸点为58.8℃。实验中,观察到烧瓶中产生红棕色气体。
(2)装置中利用到的四氯化碳的性质是
 固体。
固体。实验(二)探究性质。
为了探究的稳定性,进行如图2实验。
 发生分解反应,生成了
发生分解反应,生成了 。
。(4)实验过程中,先通入一会儿
 ,再点燃酒精灯,这样操作的目的是
,再点燃酒精灯,这样操作的目的是(5)为确认玻璃管中残留物有
 ,宜选择试剂
,宜选择试剂a.
 溶液 b.酸性
溶液 b.酸性 溶液
溶液c.KSCN溶液,氯水 d.
 溶液
溶液(6)为了探究浓度对
 氧化性的影响,实验操作及现象如下:
氧化性的影响,实验操作及现象如下:实验 | 操作 | 现象 |
ⅰ | 向2mL0.1mol 溶液中滴加KI淀粉溶液 溶液中滴加KI淀粉溶液 | 溶液变蓝色 |
ⅱ | 向2mL0.1mol 溶液中先加入适量NaF固体,后滴加KI淀粉溶液 溶液中先加入适量NaF固体,后滴加KI淀粉溶液 | 溶液不变蓝色 |
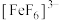 呈无色。
呈无色。写出实验ⅰ中离子反应方程式:
实验ⅱ“不变蓝色”的原因是
您最近一年使用:0次
2024-09-11更新
|
238次组卷
|
2卷引用:湖南省名校联考联合体2025届高三上学期第一次联考(暨入学检测)化学试题
名校
2 .  常用作麻醉剂、用于肝脏超声检查等。可通过硫蒸气和氟气反应制备
常用作麻醉剂、用于肝脏超声检查等。可通过硫蒸气和氟气反应制备 。
。
已知:①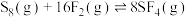

②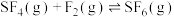
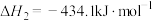 ,
,
回答下列问题:
(1) 和
和 的结构如图所示。
的结构如图所示。 在一定温度下会生成
在一定温度下会生成 ,破坏的作用力类型有
,破坏的作用力类型有_______ (填标号)。
A. 键 B.极性键 C.非极性键 D.
键 B.极性键 C.非极性键 D. 型
型 键
键
②下列有关 叙述正确的是
叙述正确的是_______ (填标号)。
A.空间结构为正四面体形 B.难溶于水,易溶于
C.键角为90°、180° D.1mol 含14mol共价键
含14mol共价键
(2)

_______  。
。
(3)反应②的正反应在下列温度下能自发进行的是_______(填标号)。
(4)某温度下,向刚性密闭容器中充入0.1mol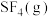 和0.1mol
和0.1mol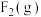 ,发生反应②,测得含S粒子浓度与时间的关系如图1所示。
,发生反应②,测得含S粒子浓度与时间的关系如图1所示。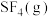 转化率为
转化率为_______ 。正反应速率:a_______ b(填“ ”“
”“ ”或“
”或“ ”)。
”)。
②0~6s内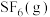 平均反应速率为
平均反应速率为_______ (结果保留2位有效数字)。
(5)某温度下,向恒容密闭容器中充入0.1mol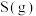 和适量
和适量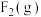 ,达到平衡后,调节
,达到平衡后,调节 浓度,测得
浓度,测得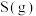 、
、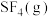 和
和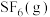 浓度与
浓度与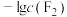 的关系如图2所示。
的关系如图2所示。 代表
代表_______ 与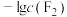 的关系。
的关系。
②该温度下,反应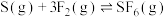 的平衡常数K为
的平衡常数K为_______ (不带单位)。
 常用作麻醉剂、用于肝脏超声检查等。可通过硫蒸气和氟气反应制备
常用作麻醉剂、用于肝脏超声检查等。可通过硫蒸气和氟气反应制备 。
。已知:①
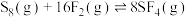

②
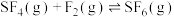
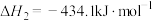 ,
,
回答下列问题:
(1)
 和
和 的结构如图所示。
的结构如图所示。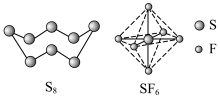
 在一定温度下会生成
在一定温度下会生成 ,破坏的作用力类型有
,破坏的作用力类型有A.
 键 B.极性键 C.非极性键 D.
键 B.极性键 C.非极性键 D. 型
型 键
键②下列有关
 叙述正确的是
叙述正确的是A.空间结构为正四面体形 B.难溶于水,易溶于

C.键角为90°、180° D.1mol
 含14mol共价键
含14mol共价键(2)


 。
。(3)反应②的正反应在下列温度下能自发进行的是_______(填标号)。
| A.500℃ | B.900℃ | C.1900℃ | D.2000℃ |
(4)某温度下,向刚性密闭容器中充入0.1mol
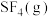 和0.1mol
和0.1mol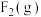 ,发生反应②,测得含S粒子浓度与时间的关系如图1所示。
,发生反应②,测得含S粒子浓度与时间的关系如图1所示。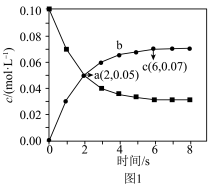
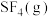 转化率为
转化率为 ”“
”“ ”或“
”或“ ”)。
”)。②0~6s内
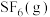 平均反应速率为
平均反应速率为(5)某温度下,向恒容密闭容器中充入0.1mol
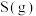 和适量
和适量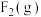 ,达到平衡后,调节
,达到平衡后,调节 浓度,测得
浓度,测得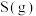 、
、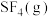 和
和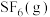 浓度与
浓度与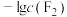 的关系如图2所示。
的关系如图2所示。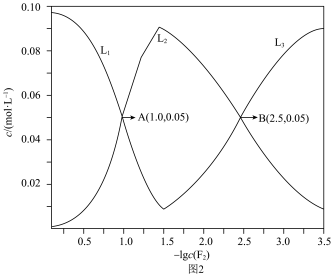
 代表
代表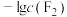 的关系。
的关系。②该温度下,反应
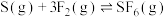 的平衡常数K为
的平衡常数K为
您最近一年使用:0次
名校
解题方法
3 . 氧化还原反应在工业生产、环保及科研中有广泛的应用,请根据以下信息,结合所掌握的化学知识,回答下列问题:
I.酸性 在生活、卫生医疗中常用作消毒剂。
在生活、卫生医疗中常用作消毒剂。
(1)已知 溶液与酸性
溶液与酸性 溶液可发生氧化还原反应,若生成的氧化产物
溶液可发生氧化还原反应,若生成的氧化产物 和
和 数量均为1个,则转移电子的数目是
数量均为1个,则转移电子的数目是___________ 个。
(2)测定 样品的纯度可用标准
样品的纯度可用标准 溶液进行滴定,配平上述反应的离子方程式:
溶液进行滴定,配平上述反应的离子方程式:___________ 。

Ⅱ.钒性能优良,用途广泛,有金属“维生素”之称。
(3)将废钒催化剂(主要成分为 )与稀硫酸、
)与稀硫酸、 溶液混合,充分反应后生成
溶液混合,充分反应后生成 ,该反应中氧化剂和还原剂的个数之比为
,该反应中氧化剂和还原剂的个数之比为___________ 。
(4) 能与盐酸反应生成
能与盐酸反应生成 和一种黄绿色气体,该黄绿色气体能与
和一种黄绿色气体,该黄绿色气体能与 溶液反应而被吸收,则
溶液反应而被吸收,则 、
、 、
、 的还原性由强到弱的顺序是
的还原性由强到弱的顺序是___________ 。
(5)偏钒酸铵在加热条件下反应会生成 、
、 和
和 。
。 在氮气氛围中,碳高温条件下还原氮气制备
在氮气氛围中,碳高温条件下还原氮气制备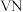 ,还生成一种具有还原性的气体,则该反应的化学方程式为
,还生成一种具有还原性的气体,则该反应的化学方程式为___________ 。
I.酸性
 在生活、卫生医疗中常用作消毒剂。
在生活、卫生医疗中常用作消毒剂。(1)已知
 溶液与酸性
溶液与酸性 溶液可发生氧化还原反应,若生成的氧化产物
溶液可发生氧化还原反应,若生成的氧化产物 和
和 数量均为1个,则转移电子的数目是
数量均为1个,则转移电子的数目是(2)测定
 样品的纯度可用标准
样品的纯度可用标准 溶液进行滴定,配平上述反应的离子方程式:
溶液进行滴定,配平上述反应的离子方程式:
Ⅱ.钒性能优良,用途广泛,有金属“维生素”之称。
(3)将废钒催化剂(主要成分为
 )与稀硫酸、
)与稀硫酸、 溶液混合,充分反应后生成
溶液混合,充分反应后生成 ,该反应中氧化剂和还原剂的个数之比为
,该反应中氧化剂和还原剂的个数之比为(4)
 能与盐酸反应生成
能与盐酸反应生成 和一种黄绿色气体,该黄绿色气体能与
和一种黄绿色气体,该黄绿色气体能与 溶液反应而被吸收,则
溶液反应而被吸收,则 、
、 、
、 的还原性由强到弱的顺序是
的还原性由强到弱的顺序是(5)偏钒酸铵在加热条件下反应会生成
 、
、 和
和 。
。 在氮气氛围中,碳高温条件下还原氮气制备
在氮气氛围中,碳高温条件下还原氮气制备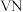 ,还生成一种具有还原性的气体,则该反应的化学方程式为
,还生成一种具有还原性的气体,则该反应的化学方程式为
您最近一年使用:0次
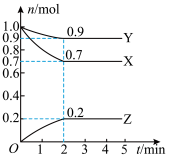
4 . 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)的物质的量随时间的变化曲线如图所示。请回答下列问题:_______ 。
(2)下列措施能加快反应速率的是_______ (填标号,下同)。
A. 恒压时充入He B. 恒容时充入He C. 恒容时充入X D. 及时分离出Z E. 升高温度 F. 选择高效的催化剂
(3)能说明该反应已达到平衡状态的是_______ o
A.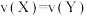
B.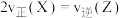
C. 容器内压强保持不变
D. 容器内混合气体的密度保持不变
E.X、Y、Z的浓度相等
(4)反应从开始至2 min, 用X的浓度变化表示的平均反应速率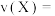
_______
(5)将amolX与bmolY的混合气体通入2L的密闭容器中并发生上述反应,反应到某时刻时各物质的物质的量恰好满足: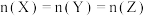 则原混合气体中
则原混合气体中 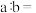
_______ 。
(2)下列措施能加快反应速率的是
A. 恒压时充入He B. 恒容时充入He C. 恒容时充入X D. 及时分离出Z E. 升高温度 F. 选择高效的催化剂
(3)能说明该反应已达到平衡状态的是
A.
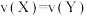
B.
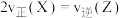
C. 容器内压强保持不变
D. 容器内混合气体的密度保持不变
E.X、Y、Z的浓度相等
(4)反应从开始至2 min, 用X的浓度变化表示的平均反应速率
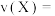
(5)将amolX与bmolY的混合气体通入2L的密闭容器中并发生上述反应,反应到某时刻时各物质的物质的量恰好满足:
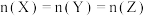 则原混合气体中
则原混合气体中 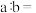
您最近一年使用:0次
5 . 含氮废水进入水体中对环境造成的污染越来越严重。
(一)某校环保小组的同学认为可以用金属铝将水中的NO 还原成N2,从而消除氮污染.
还原成N2,从而消除氮污染.
(1)配平以下有关的离子反应方程式: NO
NO +
+ Al+
Al+ H2O→
H2O→ N2↑+
N2↑+ Al(OH)3+
Al(OH)3+ OH-
OH-_______ 。
(2)以上反应中失电子的物质是_______ ,还原产物是_______ ,每生成1mol还原产物,转移的电子数目为_______ 。
(3)现需除去1m3含氮0.3mol的废水中的NO (设氮元素都以NO
(设氮元素都以NO 的形式存在),则至少需要消耗金属铝的物质的量为
的形式存在),则至少需要消耗金属铝的物质的量为_______ 。
(二)2015年8月12日天津海瑞公司危险品爆炸导致NaCN泄漏,对周边的环境造成极大的威胁。
(4)NaCN遇水就会产生剧毒物质HCN,请写出其离子方程式_______ 。
(5)天津此次事故中是用双氧水来处理泄漏的NaCN,处理后产生有刺激性气味的氨气与NaHCO3,请写出该反应的化学方程式_______ 。
(6)此次事故中_______ (填“能”或“不能”)用酸性高锰酸钾来处理泄漏的NaCN。请用文字结合方程式解释_______ 。
(一)某校环保小组的同学认为可以用金属铝将水中的NO
 还原成N2,从而消除氮污染.
还原成N2,从而消除氮污染.(1)配平以下有关的离子反应方程式:
 NO
NO +
+ Al+
Al+ H2O→
H2O→ N2↑+
N2↑+ Al(OH)3+
Al(OH)3+ OH-
OH-(2)以上反应中失电子的物质是
(3)现需除去1m3含氮0.3mol的废水中的NO
 (设氮元素都以NO
(设氮元素都以NO 的形式存在),则至少需要消耗金属铝的物质的量为
的形式存在),则至少需要消耗金属铝的物质的量为(二)2015年8月12日天津海瑞公司危险品爆炸导致NaCN泄漏,对周边的环境造成极大的威胁。
(4)NaCN遇水就会产生剧毒物质HCN,请写出其离子方程式
(5)天津此次事故中是用双氧水来处理泄漏的NaCN,处理后产生有刺激性气味的氨气与NaHCO3,请写出该反应的化学方程式
(6)此次事故中
您最近一年使用:0次
6 . 最新报道,我国科学家通过与多个国家进行科技合作,成功研发出铯(Cs)原子喷泉钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入世界先进行列。已知铯位于元素周期表中第六周期第ⅠA族,根据铯在元素周期表中的位置,推断下列内容:
(1)铯的原子核外共有___________ 个电子层,最外层电子数为___________ 。
(2)铯单质与水剧烈反应伴有爆炸,放出的气体是___________ ,生成的溶液可使酚酞溶液显___________ 色。
(3)预测铯单质的还原性比钠单质的还原性___________ 。(填“弱”或“强”)
(1)铯的原子核外共有
(2)铯单质与水剧烈反应伴有爆炸,放出的气体是
(3)预测铯单质的还原性比钠单质的还原性
您最近一年使用:0次
解题方法
7 . 初中阶段:物质得氧和失氧的反应是氧化还原反应;高中阶段:凡是有元素化合价升降的化学反应都是氧化还原反应,氧化反应和还原反应同时发生的。请回答下列问题:
(1)根据化合价改变判断下列四种基本反应类型,一定不是氧化还原反应的是___________。(选填字母序号)
(2)在化学反应Fe+CuSO4=Cu+FeSO4中,该反应的还原剂是___________ ,发生还原反应的是___________ 。(填化学式)
(3)下列反应中,氧化反应与还原反应在同一元素中进行的是___________。(选填字母序号)
(1)根据化合价改变判断下列四种基本反应类型,一定不是氧化还原反应的是___________。(选填字母序号)
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
(3)下列反应中,氧化反应与还原反应在同一元素中进行的是___________。(选填字母序号)
| A.Cl2+2NaOH=NaCl+NaClO+H2O | B.4P+5O2 2P2O5 2P2O5 |
| C.Zn+CuCl2=Cu+ZnCl2 | D.3NO2+H2O=2HNO3+NO |
您最近一年使用:0次
名校
解题方法
8 . 化学与人类生活息息相关,联系学过的化学知识,按要求完成下列各题。
(1)2007年6月5日,在“南海一号”打捞出的文物中,玉器手镯光彩夺目,铜镜表面有铜绿,铁器锈迹斑斑。写出一个铁比铜活泼的化学方程式___________ 。
(2)工业上用稀硫酸清洗铁制品表面的铁锈,其化学方程式___________ 。
(3)写出工业上用赤铁矿石炼铁的化学方程式:___________ 。
(4)“芯片”是智能化电器设备的核心部件,制作材料主要是高纯度的单质硅。制备高纯度硅的过程较为复杂,其中一个化学反应是:SiO2+2C Si+2CO↑该反应前后化合价发生改变的元素有
Si+2CO↑该反应前后化合价发生改变的元素有 ___________ 。
(1)2007年6月5日,在“南海一号”打捞出的文物中,玉器手镯光彩夺目,铜镜表面有铜绿,铁器锈迹斑斑。写出一个铁比铜活泼的化学方程式
(2)工业上用稀硫酸清洗铁制品表面的铁锈,其化学方程式
(3)写出工业上用赤铁矿石炼铁的化学方程式:
(4)“芯片”是智能化电器设备的核心部件,制作材料主要是高纯度的单质硅。制备高纯度硅的过程较为复杂,其中一个化学反应是:SiO2+2C
 Si+2CO↑该反应前后化合价发生改变的元素有
Si+2CO↑该反应前后化合价发生改变的元素有
您最近一年使用:0次
解题方法
9 . 我国嫦娥五号返回器带回了月球土壤样品。研究发现,月球土壤样品中存在铁、金、银、铅、锌、铜等矿物颗粒。请回答下列问题:
(1)基态Fe原子的价层电子排布式为___________ ,其核外填充有电子的原子轨道数目为___________ ,比铁原子多一个质子的元素名称为___________ 。
(2)Ti(BH4)2是一种储氢材料。 的空间结构是
的空间结构是___________ ,H、Na、K的电负性由小到大的顺序为___________ 。
(3)我国科学家研究发现,十八胺在较高温度下具有一定的还原性,由于从十八胺中获得电子的能力不同,不同的金属盐在十八胺体系中反应可以得到不同的产物:
已知元素的电负性数据:
据此推测单一的金属(Au3+)盐在十八胺体系中反应的产物为___________ (写化学式)。
(4)分析Cu,Zn的核外电子排布,推测Cu的第二电离能I2___________ Zn的第二电离能I2(填“大于”“小于”或“等于”)。
(1)基态Fe原子的价层电子排布式为
(2)Ti(BH4)2是一种储氢材料。
 的空间结构是
的空间结构是(3)我国科学家研究发现,十八胺在较高温度下具有一定的还原性,由于从十八胺中获得电子的能力不同,不同的金属盐在十八胺体系中反应可以得到不同的产物:
| 单一金属盐 | Zn2+ | Ag+ |
| 在十八胺体系中的产物 | ZnO | Ag |
| 元素 | Zn | Ag | Au |
| 电负性(鲍林标度) | 1.6 | 1.9 | 2.4 |
(4)分析Cu,Zn的核外电子排布,推测Cu的第二电离能I2
您最近一年使用:0次
10 . 氨气和甲醇都是重要的工业产品,试运用必要的化学原理解决有关问题。
(1)在密闭容器中,使2molN2和7molH2在一定条件下发生反应:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ/mol。
①NH3分子的空间构型为:_______ ,中心N原子的杂化类型为:_______
②当达到平衡时,保持恒温,压缩容器体积,平衡_______ (填“正向”“逆向”或“不”)移动,化学平衡常数K_______ (填“增大”“减小”或“不变”)。
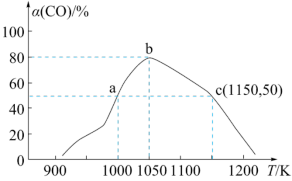
(2)水煤气在一定条件下可合成甲醇:CO(g)+2H2(g)⇌CH3OH(g) △H<0。将1molCO和2molH2充入1L恒容密闭容器中,在一定条件下合成甲醇,反应相同时间(2min)时测得不同温度下CO的转化率如图所示:_______ 。
②由图可知,在温度低于1050K时,CO的转化率随温度的升高而增大,原因是_______ 。
③已知c点时容器内气体的压强为p,则在1150K下该反应的压强平衡常数KP为_______  (用含p的代数式表示,KP是用各气体的分压,(替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
(用含p的代数式表示,KP是用各气体的分压,(替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
(1)在密闭容器中,使2molN2和7molH2在一定条件下发生反应:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ/mol。
①NH3分子的空间构型为:
②当达到平衡时,保持恒温,压缩容器体积,平衡
(2)水煤气在一定条件下可合成甲醇:CO(g)+2H2(g)⇌CH3OH(g) △H<0。将1molCO和2molH2充入1L恒容密闭容器中,在一定条件下合成甲醇,反应相同时间(2min)时测得不同温度下CO的转化率如图所示:
②由图可知,在温度低于1050K时,CO的转化率随温度的升高而增大,原因是
③已知c点时容器内气体的压强为p,则在1150K下该反应的压强平衡常数KP为
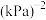 (用含p的代数式表示,KP是用各气体的分压,(替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
(用含p的代数式表示,KP是用各气体的分压,(替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次



