名校
解题方法
1 . 填空
(1)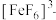 与许多金属离子或
与许多金属离子或 形成的化合物有广泛的用途。
形成的化合物有广泛的用途。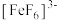 与
与 形成的化合物可以作为锂离子电池的电极材料
形成的化合物可以作为锂离子电池的电极材料
① 价电子排布式:
价电子排布式:______ 。
②化合物 中的化学键类型有
中的化学键类型有______ (填字母)。
a.离子键 b.极性共价键 c.非极性共价键 d.金属键 e.配位键
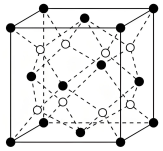
(2)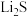 因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为
因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为 。
。______ (填“ ”或“
”或“ ”)。
”)。
②距离 最近的
最近的 有
有______ 个。
③已知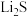 的摩尔质量是
的摩尔质量是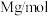 ,阿伏加德罗常数为
,阿伏加德罗常数为 。该晶体的密度为
。该晶体的密度为______  。
。
(1)
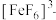 与许多金属离子或
与许多金属离子或 形成的化合物有广泛的用途。
形成的化合物有广泛的用途。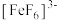 与
与 形成的化合物可以作为锂离子电池的电极材料
形成的化合物可以作为锂离子电池的电极材料①
 价电子排布式:
价电子排布式:②化合物
 中的化学键类型有
中的化学键类型有a.离子键 b.极性共价键 c.非极性共价键 d.金属键 e.配位键
(2)
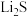 因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为
因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为 。
。
 ”或“
”或“ ”)。
”)。②距离
 最近的
最近的 有
有③已知
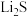 的摩尔质量是
的摩尔质量是 ,阿伏加德罗常数为
,阿伏加德罗常数为 。该晶体的密度为
。该晶体的密度为 。
。
您最近一年使用:0次
名校
解题方法
2 . 一种高硫锰矿的主要成分为MnCO3和MnS,主要杂质为FeS、SiO2、CaCO3、Al2O3、MgO等,研究人员设计了如图流程,制备Mn3O4。
②金属离子浓度≤10-5 时,认为该离子沉淀完全。相关离子形成氢氧化物沉淀的pH范围如表。
时,认为该离子沉淀完全。相关离子形成氢氧化物沉淀的pH范围如表。
③Ksp(MgF2)=6.4×10-9、Ksp(CaF2)=4.0×10-11。
(1)MnCO3中Mn的价电子排布式为___________ ,“焙烧”的主要目的是___________ 。
(2)“酸浸”过程中,___________ (填“能”或“不能”)用盐酸替换硫酸。
(3)“氧化1”时,试剂a为MnO2,并控制溶液的pH=3,此时发生反应的离子方程式为___________ 。
(4)若省略“氧化”步骤直接进行“中和除杂”,则造成的影响是___________ 。
(5)“净化除杂”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Mg2+)=1.0×10-5 ,则滤液中c(Ca2+)为
,则滤液中c(Ca2+)为___________  。
。
(6)“氧化2”过程中,在MnSO4溶液中滴入一定浓度的氨水,加压通入空气反应7小时制备Mn3O4,此时发生反应的离子方程式为___________ 。
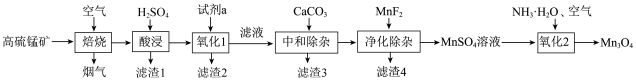
②金属离子浓度≤10-5
 时,认为该离子沉淀完全。相关离子形成氢氧化物沉淀的pH范围如表。
时,认为该离子沉淀完全。相关离子形成氢氧化物沉淀的pH范围如表。| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉定的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)MnCO3中Mn的价电子排布式为
(2)“酸浸”过程中,
(3)“氧化1”时,试剂a为MnO2,并控制溶液的pH=3,此时发生反应的离子方程式为
(4)若省略“氧化”步骤直接进行“中和除杂”,则造成的影响是
(5)“净化除杂”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Mg2+)=1.0×10-5
 ,则滤液中c(Ca2+)为
,则滤液中c(Ca2+)为 。
。(6)“氧化2”过程中,在MnSO4溶液中滴入一定浓度的氨水,加压通入空气反应7小时制备Mn3O4,此时发生反应的离子方程式为
您最近一年使用:0次
名校
3 . 实验室需要90mL1.0mol•L-1稀硫酸,现用质量分数为98%、密度为1.84g/mL的浓硫酸配制,根据实验事实需要配制情况回答下列问题。
(1)需量取浓硫酸的体积为___________ mL。
(2)在如图所示仪器中,配制上述溶液肯定不需要的是___________ (填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是___________ 。
(4)配制过程中,下列情况会使配制结果偏高的是(填序号)___________ ,偏低的是 ___________ ,不影响的是___________ 。
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线。
(5)若用0.01000mol·L-1K2Cr2O7(酸性)溶液滴定20.00mL未知浓度的含Fe2+的溶液,恰好完全反应时消10.00mLK2Cr2O7溶液,则待测液中Fe2+的浓度是___________ mol/L。
(1)需量取浓硫酸的体积为
(2)在如图所示仪器中,配制上述溶液肯定不需要的是
A. B.
B. C.
C. D.
D. E.
E.
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线 |
| D.定容后,盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀 |
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线。
(5)若用0.01000mol·L-1K2Cr2O7(酸性)溶液滴定20.00mL未知浓度的含Fe2+的溶液,恰好完全反应时消10.00mLK2Cr2O7溶液,则待测液中Fe2+的浓度是
您最近一年使用:0次
名校
4 . 二氧化硫和亚硫酸在工农业生产中具有重要的用途。某化学兴趣小组对SO2和H2SO3的一些性质进行了探究。
Ⅰ.探究SO2的性质_______ ;关闭旋塞2,打开旋塞1,注入硫酸至浸没三颈烧瓶中的固体,反应的化学方程式为_______ 。
(2)装置B中试剂X是_______ ,装置C中发生反应的化学方程式:_______ ,装置D中NaOH溶液的作用是_______ 。
Ⅱ.探究H2SO3的酸性强于HClO(可能需要的装置和试剂如图所示)_______ (填字母),装置J中反应的离子方程式为_______ 。
(4)能证明H2SO3的酸性强于HClO的实验现象是_______ 。
Ⅰ.探究SO2的性质
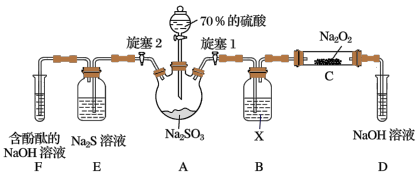
(2)装置B中试剂X是
Ⅱ.探究H2SO3的酸性强于HClO(可能需要的装置和试剂如图所示)

(4)能证明H2SO3的酸性强于HClO的实验现象是
您最近一年使用:0次
名校
5 . 研究化学反应的快慢和限度,对工农业生产和人们生活有重要的意义。
I.某化学课外小组的同学通过铁和稀盐酸的反应探究外界条件对化学反应速率的影响,下表是实验过程中的数据及相关信息:
(注:气体体积均在相同条件下测得)
(1)实验①和②探究盐酸浓度对反应速率的影响,即V1为_______ mL;实验②和③表明_______ 对反应速率的影响。
(2)分析其中一组实验,发现产生氢气的速率随时间的变化情况都是开始速率慢慢增大,后来慢慢减小。前期速率慢慢增大的主要原因是_______ ;后期速率慢慢减小的主要原因是_______ 。
II.工业制硫酸的反应之一为:2SO2(g)+O2(g) 2SO3(g),在1L恒容密闭容器中投入2molSO2和2molO2,在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。
2SO3(g),在1L恒容密闭容器中投入2molSO2和2molO2,在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。_______ ;达平衡时SO2的体积百分数为_______ (结果保留一位小数)
(4)下列叙述不能 判断该反应达到平衡状态的是_______ ;
a.容器中压强不再改变 b.容器中气体密度不再改变 c.O2的物质的量浓度不再改变
d.SO3的质量不再改变 e.2V正(SO2)=V逆(O2)
I.某化学课外小组的同学通过铁和稀盐酸的反应探究外界条件对化学反应速率的影响,下表是实验过程中的数据及相关信息:
| 序号 | 反应温度/℃ | 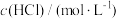 | 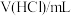 | V(H2O)/mL | 10gFe的形状 | t/min |
| ① | 20 | 2 | 5 | V1 | 块状 | 1 |
| ② | 20 | 2 | 10 | 0 | 块状 | 1 |
| ③ | 20 | 2 | 10 | 0 | 粉末 | 1 |
| ④ | 40 | 2 | 10 | 0 | 块状 | 1 |
(1)实验①和②探究盐酸浓度对反应速率的影响,即V1为
(2)分析其中一组实验,发现产生氢气的速率随时间的变化情况都是开始速率慢慢增大,后来慢慢减小。前期速率慢慢增大的主要原因是
II.工业制硫酸的反应之一为:2SO2(g)+O2(g)
 2SO3(g),在1L恒容密闭容器中投入2molSO2和2molO2,在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。
2SO3(g),在1L恒容密闭容器中投入2molSO2和2molO2,在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。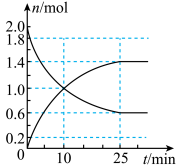
(4)下列叙述
a.容器中压强不再改变 b.容器中气体密度不再改变 c.O2的物质的量浓度不再改变
d.SO3的质量不再改变 e.2V正(SO2)=V逆(O2)
您最近一年使用:0次
名校
6 . 磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应制取少量,方程式为SO2(g)+Cl2(g)=SO2Cl2(l),该反应放热,装置如图所示(部分夹持装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾。
(1)写出仪器b的名称________ 。
(2)甲装置可以用来实验室迅速制取氨气,则分液漏斗盛装_____ (填试剂名称),烧瓶盛装_____ (填试剂名称)。
(3)SO2使酸性高锰酸钾溶液褪色体现了它的_____ 性,反应的化学方程式为_________ 。
(4)装置乙和丁中可以使用同一种试剂,该试剂为_____ 。
(5)装置戊中长颈漏斗的作用__________ 。
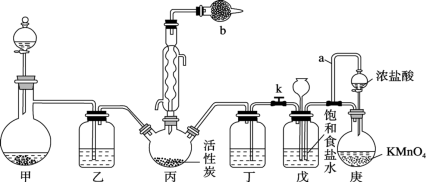
(1)写出仪器b的名称
(2)甲装置可以用来实验室迅速制取氨气,则分液漏斗盛装
(3)SO2使酸性高锰酸钾溶液褪色体现了它的
(4)装置乙和丁中可以使用同一种试剂,该试剂为
(5)装置戊中长颈漏斗的作用
您最近一年使用:0次
名校
7 . 已知:A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。___________ 。
(2)若A为淡黄色粉末,写出A的电子式_________ 。A与 反应的离子方程式为
反应的离子方程式为________ 。X为一种温室气体,C与E反应的离子方程式为___________ 。
(3)若A、B均为氮的常见氧化物,X是Fe,溶液D加入 溶液变红。
溶液变红。
①写出加热条件下C的浓溶液与X反应生成D的化学方程式_____________ 。
②检验溶液D中还可能存在 的方法是
的方法是____________ 。
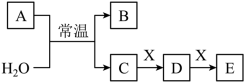
(2)若A为淡黄色粉末,写出A的电子式
 反应的离子方程式为
反应的离子方程式为(3)若A、B均为氮的常见氧化物,X是Fe,溶液D加入
 溶液变红。
溶液变红。①写出加热条件下C的浓溶液与X反应生成D的化学方程式
②检验溶液D中还可能存在
 的方法是
的方法是
您最近一年使用:0次
名校
解题方法
8 . 烷烃与卤素单质发生取代反应生成卤代烃,卤代烃在生产、生活中有非常重要的应用。如氯仿(三氯甲烷,CHCl3)在医学上常用作麻醉剂;还可用作抗生素、香料、油脂、树脂、橡胶的溶剂和萃取剂;与四氯化碳混合可制成不冻的防火液体。某课外活动小组利用下图所示装置探究甲烷与氯气的反应。根据题意,回答下列问题:___________ ;若用日光直射,可能会引起___________ 。
(2)实验中可观察到的实验现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出,___________ ,___________ 等。
(3)写出甲烷与氯气反应生成一氯代物的化学方程式:___________ 。此反应属于___________ (填反应类型)反应。
(4)用饱和食盐水而不用水的原因是___________ 。
(5)实验中生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应的化学方程式为2CHCl3+O2→2COCl2+2HCl,为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是___________ 。
A.氢氧化钠溶液 B.硝酸银溶液 C.稀盐酸 D.水 E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸

(2)实验中可观察到的实验现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出,
(3)写出甲烷与氯气反应生成一氯代物的化学方程式:
(4)用饱和食盐水而不用水的原因是
(5)实验中生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应的化学方程式为2CHCl3+O2→2COCl2+2HCl,为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是
A.氢氧化钠溶液 B.硝酸银溶液 C.稀盐酸 D.水 E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸
您最近一年使用:0次
名校
解题方法
9 . 铁在史前就为人们所知,铁及其化合物推动了人类文明的发展。回答下列问题:
(1)Fe元素位于元素周期表的___________ 区,基态Fe2+的核外电子排布式为___________ 。
(2)复盐NH4Fe(SO4)2•12H2O俗称铁铵矾,可用于鞣革。铁铵矾中,所含N、O、S三种非金属元素电负性由小到大的顺序是___________ ,基态O原子有___________ 种空间运动状态不同的电子;H2O的VSEPR模型为___________ 。
(3)三价铁的强酸盐溶于水后经水解可以生成如图所示的二聚体,其中Fe3+的配位数为___________ ,过渡元素的s、p、d轨道可以参与杂化,含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,该二聚体中Fe采取的杂化类型为___________ (填标号)。
试解释其熔点差异的原因:___________ 。
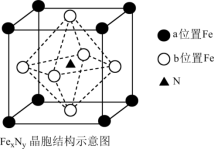
(5)铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某立方FexNy的晶胞如图所示,晶胞参数为apm,该晶体密度为___________ g•cm-3(设NA为阿伏加德罗常数的值,写出表达式),Cu完全替代该晶体中b位置的Fe,形成Cu替代型产物Fe(x-n)CunNy,n∶y=___________ 。
(1)Fe元素位于元素周期表的
(2)复盐NH4Fe(SO4)2•12H2O俗称铁铵矾,可用于鞣革。铁铵矾中,所含N、O、S三种非金属元素电负性由小到大的顺序是
(3)三价铁的强酸盐溶于水后经水解可以生成如图所示的二聚体,其中Fe3+的配位数为
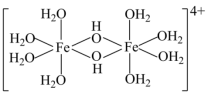
| 化合物 | FeCl3 | NaCl | MgO |
| 熔点/℃ | 308 | 801 | 2852 |
(5)铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某立方FexNy的晶胞如图所示,晶胞参数为apm,该晶体密度为
您最近一年使用:0次
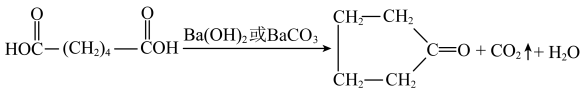
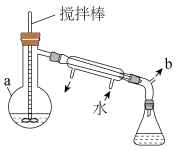
10 . 伊贝沙坦是一种新型的抗高血压药物,环戊酮是合成伊贝沙坦的中间体,实验室以如下图装置制备环戊酮(M=84g/mol,加热及夹持装置已省略),其反应原理:
 .将29.2g己二酸和适量Ba(OH)2置于如图仪器a中,维持温度285~290℃,加热20分钟。
.将29.2g己二酸和适量Ba(OH)2置于如图仪器a中,维持温度285~290℃,加热20分钟。
 .在馏出液中加入适量的K2CO3浓溶液,振荡锥形瓶、分液除去水层;将有机层转移至干燥锥形瓶,再次加入K2CO3(s),振荡分离出有机层。
.在馏出液中加入适量的K2CO3浓溶液,振荡锥形瓶、分液除去水层;将有机层转移至干燥锥形瓶,再次加入K2CO3(s),振荡分离出有机层。
 .组装蒸馏装置,对
.组装蒸馏装置,对 所得有机层进行蒸馏,收集128~131℃的馏分,称量获得产品12.6g,计算产率。
所得有机层进行蒸馏,收集128~131℃的馏分,称量获得产品12.6g,计算产率。
回答下列问题:
(1)仪器a的名称为___________ 。
(2)步骤I加热的最佳方式是___________ (填序号)。
A.熔融的KNO3+NaNO3盐浴 B.自来水水浴 C.酒精灯直接加热
用导管连接b并通向户外,“通向户外”的主要目的是___________ 。
(3)步骤 蒸馏有机层时温度计球泡位置应在
蒸馏有机层时温度计球泡位置应在___________ 。
(4)步骤 中第一次加入K2CO3的作用是减小环戊酮的溶解性及
中第一次加入K2CO3的作用是减小环戊酮的溶解性及___________ ,第二次加入K2CO3的作用是___________ 。
(5)环戊酮的产率为___________ (结果保留3位有效数字),如果步骤 温度高于330℃,会导致产率
温度高于330℃,会导致产率___________ (填“升高”、“降低”或“无影响”)。
 .将29.2g己二酸和适量Ba(OH)2置于如图仪器a中,维持温度285~290℃,加热20分钟。
.将29.2g己二酸和适量Ba(OH)2置于如图仪器a中,维持温度285~290℃,加热20分钟。 .在馏出液中加入适量的K2CO3浓溶液,振荡锥形瓶、分液除去水层;将有机层转移至干燥锥形瓶,再次加入K2CO3(s),振荡分离出有机层。
.在馏出液中加入适量的K2CO3浓溶液,振荡锥形瓶、分液除去水层;将有机层转移至干燥锥形瓶,再次加入K2CO3(s),振荡分离出有机层。 .组装蒸馏装置,对
.组装蒸馏装置,对 所得有机层进行蒸馏,收集128~131℃的馏分,称量获得产品12.6g,计算产率。
所得有机层进行蒸馏,收集128~131℃的馏分,称量获得产品12.6g,计算产率。回答下列问题:
(1)仪器a的名称为
(2)步骤I加热的最佳方式是
A.熔融的KNO3+NaNO3盐浴 B.自来水水浴 C.酒精灯直接加热
用导管连接b并通向户外,“通向户外”的主要目的是
(3)步骤
 蒸馏有机层时温度计球泡位置应在
蒸馏有机层时温度计球泡位置应在(4)步骤
 中第一次加入K2CO3的作用是减小环戊酮的溶解性及
中第一次加入K2CO3的作用是减小环戊酮的溶解性及(5)环戊酮的产率为
 温度高于330℃,会导致产率
温度高于330℃,会导致产率
您最近一年使用:0次



