1 . 物质结构决定物质的性质,下列性质差异与结构因素匹配正确的是
| 性质差异 | 结构因素 | |
| A. | 酸性: | 非金属性 |
| B. | 与钠反应的剧烈程度: | 羟基的极性 |
| C. | 键角: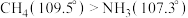 | 中心原子的杂化方式 |
| D. | 熔点: | 晶体类型 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
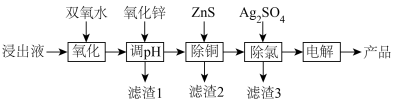
2 . 工业上将一种以ZnSO4为主要成分的浸出液(含有Fe3+、Fe2+、Cu2+、Cl-等杂质)经过一系列处理后,用于制备金属锌,其流程如下:
回答下列问题:
(1)“调pH”时选择氧化锌的目的是_______ ,优点是_______ 。
(2)若“滤渣1”的主要成分是Fe(OH)3,“调pH”的范围应是_______ ,写出相关反应的离子方程式:_______ 。
(3)“除氯”时发生反应: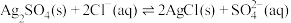 。已知:25℃时,
。已知:25℃时,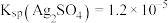 ,
,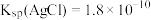 ,请计算该反应的平衡常数K=
,请计算该反应的平衡常数K=_______ (列出计算式即可)。
(4)“电解”时生成产品的一极是_______ (填“阴极”或“阳极”);缺少“除氯”步骤的影响是_______ 。
| 金属离子 | Fe3+ | Fe2 | Cu2+ | Zn2+ |
| 开始沉淀的pH | 2.3 | 6.8 | 4.7 | 6.2 |
| 完全沉淀的pH | 3.2 | 8.3 | 6.7 | 8.2 |
(1)“调pH”时选择氧化锌的目的是
(2)若“滤渣1”的主要成分是Fe(OH)3,“调pH”的范围应是
(3)“除氯”时发生反应:
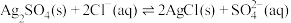 。已知:25℃时,
。已知:25℃时,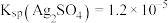 ,
,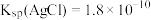 ,请计算该反应的平衡常数K=
,请计算该反应的平衡常数K=(4)“电解”时生成产品的一极是
您最近一年使用:0次
解题方法
3 . 湿法炼锌净化钴渣中含有 、
、 、
、 和
和 的单质及
的单质及 ,可利用过硫酸钠(
,可利用过硫酸钠( )氧化水解法实现钴的富集,其工艺流程如下:
)氧化水解法实现钴的富集,其工艺流程如下: 见下表:
见下表:
回答下列问题:
(1)“浸渣”的主要成分为_______ 。
(2)根据以上流程判断离子的还原性:
_______ (填“小于”或“大于”) 。
。
(3)利用上述表格数据,计算 的
的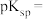
_______ 。如果“滤液I”中 浓度为
浓度为 ,则“除铁”应控制的
,则“除铁”应控制的 范围是
范围是_______ 。( )
)
(4)①已知过硫酸钠中 的化合价为+6,则
的化合价为+6,则 过硫酸钠中含有的过氧键(
过硫酸钠中含有的过氧键( )数目为
)数目为_______ 。(用 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值)
②写出“沉钴”时发生反应的离子方程式:_______ 。
(5)上述流程中_______ (填字母)可返回湿法炼锌系统,提高锌的利用率。
A.浸渣 B.滤渣I C.滤液I D.滤渣Ⅱ E.滤液Ⅱ
 、
、 、
、 和
和 的单质及
的单质及 ,可利用过硫酸钠(
,可利用过硫酸钠( )氧化水解法实现钴的富集,其工艺流程如下:
)氧化水解法实现钴的富集,其工艺流程如下: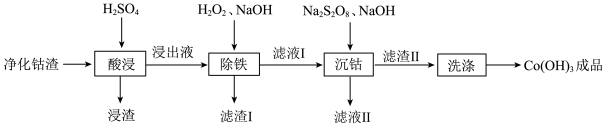
 见下表:
见下表:| 金属离子 |  |  |  |
开始沉淀( )的 )的 | 2.2 | 6.8 | 7.7 |
沉淀完全( )的 )的 | 3.2 | 8.3 | 9.2 |
(1)“浸渣”的主要成分为
(2)根据以上流程判断离子的还原性:

 。
。(3)利用上述表格数据,计算
 的
的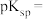
 浓度为
浓度为 ,则“除铁”应控制的
,则“除铁”应控制的 范围是
范围是 )
)(4)①已知过硫酸钠中
 的化合价为+6,则
的化合价为+6,则 过硫酸钠中含有的过氧键(
过硫酸钠中含有的过氧键( )数目为
)数目为 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值)②写出“沉钴”时发生反应的离子方程式:
(5)上述流程中
A.浸渣 B.滤渣I C.滤液I D.滤渣Ⅱ E.滤液Ⅱ
您最近一年使用:0次
4 .  的资源化有利于实现“碳中和”,利用
的资源化有利于实现“碳中和”,利用 氧化烷烃可制得烯烃。以
氧化烷烃可制得烯烃。以 和乙苯(
和乙苯(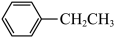 )为原料合成苯乙烯(
)为原料合成苯乙烯(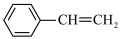 )为例,涉及以下反应:
)为例,涉及以下反应:
I.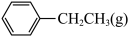

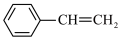 (g)+
(g)+
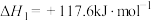
Ⅱ.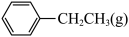
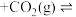
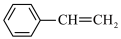 (g)
(g)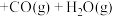
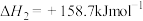
(1)写出
 与
与 反应生成
反应生成 和
和 的热化学方程式:
的热化学方程式:(2)下列说法正确的是_______。(填字母)
A.当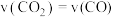 时,反应Ⅱ达到平衡状态 时,反应Ⅱ达到平衡状态 |
| B.升高温度,反应Ⅱ的正、逆反应速率都增大 |
C.增大压强,反应I平衡逆向移动,平衡常数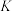 减小 减小 |
| D.反应I加入催化剂,可降低该反应的活化能 |
(3)在刚性容器中,进料浓度比[
 (乙苯):
(乙苯): ]分别等于1∶5、1∶15、1∶50时,乙苯的平衡转化率随反应温度的变化关系如图所示:
]分别等于1∶5、1∶15、1∶50时,乙苯的平衡转化率随反应温度的变化关系如图所示: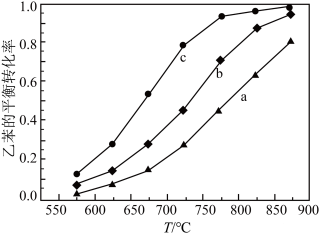
 的进料浓度比[
的进料浓度比[ (乙苯):
(乙苯): ]为
]为(4)某温度下,等物质的量的乙苯和
 在刚性容器内只发生反应Ⅱ,若初始的总压强为
在刚性容器内只发生反应Ⅱ,若初始的总压强为 ,平衡时乙苯的转化率为40%,则平衡时的总压强为
,平衡时乙苯的转化率为40%,则平衡时的总压强为 表示,下同),反应Ⅱ的平衡常数
表示,下同),反应Ⅱ的平衡常数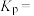
 物质的量分数)
物质的量分数)
您最近一年使用:0次
解题方法
5 . 某研究性学习小组用如图所示的装置进行实验,探究原电池、电解池和电解制备钴的工作原理。一段时间后装置甲的两极均有气体产生,且 极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。请根据实验现象及所查资料,回答下列问题:
极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。请根据实验现象及所查资料,回答下列问题:
查阅资料:高铁酸根( )在溶液中呈紫红色。
)在溶液中呈紫红色。
(2)丙池中的
_______ (填“从左向右”“从右向左”或“不”)移动。
(3)若撤掉装置乙中的阳离子交换膜,石墨电极上产生的气体除 外,还可能有
外,还可能有_______ 。
(4)乙池是电解制备金属钴的装置图,相比电解前,电解完成后理论上I室中
_______ (填“变大”“变小”或“不变”),该电解池总反应的化学方程式是_______ 。
(5)反应过程中, 极处发生的电极反应为
极处发生的电极反应为 和
和_______ 。
(6)一段时间后,若 极质量减小
极质量减小 ,
, 极收集到
极收集到 气体,则在
气体,则在 极收集到的气体体积为
极收集到的气体体积为_______  (均已折算为标准状况时的气体体积)。
(均已折算为标准状况时的气体体积)。
 极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。请根据实验现象及所查资料,回答下列问题:
极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。请根据实验现象及所查资料,回答下列问题:查阅资料:高铁酸根(
 )在溶液中呈紫红色。
)在溶液中呈紫红色。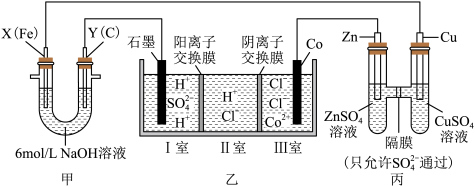
A. | B. | C. | D. |
(2)丙池中的

(3)若撤掉装置乙中的阳离子交换膜,石墨电极上产生的气体除
 外,还可能有
外,还可能有(4)乙池是电解制备金属钴的装置图,相比电解前,电解完成后理论上I室中

(5)反应过程中,
 极处发生的电极反应为
极处发生的电极反应为 和
和(6)一段时间后,若
 极质量减小
极质量减小 ,
, 极收集到
极收集到 气体,则在
气体,则在 极收集到的气体体积为
极收集到的气体体积为 (均已折算为标准状况时的气体体积)。
(均已折算为标准状况时的气体体积)。
您最近一年使用:0次
解题方法
6 . 室温下,相关弱酸的电离常数如下表所示:
回答下列问题:
(1)室温下,浓度相同的 和
和 两种溶液的
两种溶液的 大小:
大小:
_______  (填“<”或“>”),判断依据是
(填“<”或“>”),判断依据是_______ 。
(2)室温下,向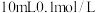 的
的 溶液中加入相同浓度的
溶液中加入相同浓度的 溶液。
溶液。
①当滴加 溶液至溶液中的
溶液至溶液中的 时,溶液的
时,溶液的
_______ 7(填“<”“=”或“>”,下同),此时 (
( 溶液)
溶液)_______  。
。
②该温度下,反应 的平衡常数
的平衡常数
_______ (列出计算式即可)。
(3)为测定某 溶液的浓度,取
溶液的浓度,取 待测溶液于锥形瓶中,滴加2滴酚酞溶液,用浓度为
待测溶液于锥形瓶中,滴加2滴酚酞溶液,用浓度为 的
的 标准溶液滴定。
标准溶液滴定。
①达到滴定终点的现象是_______ 。
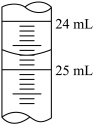
②某同学第一次滴定后 标准溶液的液面如图所示,读数为
标准溶液的液面如图所示,读数为_______  。
。 溶液的浓度为
溶液的浓度为_______  。
。
| 弱酸 |  |  |  |
电离常数 |  |  |  |
(1)室温下,浓度相同的
 和
和 两种溶液的
两种溶液的 大小:
大小:
 (填“<”或“>”),判断依据是
(填“<”或“>”),判断依据是(2)室温下,向
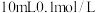 的
的 溶液中加入相同浓度的
溶液中加入相同浓度的 溶液。
溶液。①当滴加
 溶液至溶液中的
溶液至溶液中的 时,溶液的
时,溶液的
 (
( 溶液)
溶液) 。
。②该温度下,反应
 的平衡常数
的平衡常数
(3)为测定某
 溶液的浓度,取
溶液的浓度,取 待测溶液于锥形瓶中,滴加2滴酚酞溶液,用浓度为
待测溶液于锥形瓶中,滴加2滴酚酞溶液,用浓度为 的
的 标准溶液滴定。
标准溶液滴定。①达到滴定终点的现象是
②某同学第一次滴定后
 标准溶液的液面如图所示,读数为
标准溶液的液面如图所示,读数为 。
。
 溶液的浓度为
溶液的浓度为 。
。| 实验次数 |  溶液的体积/ 溶液的体积/ | 待测 溶液的体积/ 溶液的体积/ |
| 1 | ② | 25.00 |
| 2 | 24.71 | 25.00 |
| 3 | 24.69 | 25.00 |
您最近一年使用:0次
解题方法
7 . 下表为元素周期表的一部分,每个字母分别代表一种元素。
(1)元素Y、Z、M、Q中,原子半径最大的是_______ (填元素名称)。
(2)基态Q原子中,其占据的最高能层的符号是_______ ,其最高能级的原子轨道的形状是_______ 。
(3)下列关于R的说法正确的是_______ (填序号)。
①R的原子序数为26
②依据核外电子排布,把元素周期表划分为5个区,R位于ds区 的中心原子杂化轨道类型为
的中心原子杂化轨道类型为_______ ,键角为_______ 。 的空间结构名称为
的空间结构名称为_______ 。
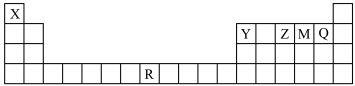
(1)元素Y、Z、M、Q中,原子半径最大的是
(2)基态Q原子中,其占据的最高能层的符号是
(3)下列关于R的说法正确的是
①R的原子序数为26
②依据核外电子排布,把元素周期表划分为5个区,R位于ds区
③基态 的价层电子轨道表示式为
的价层电子轨道表示式为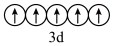
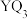 的中心原子杂化轨道类型为
的中心原子杂化轨道类型为 的空间结构名称为
的空间结构名称为
您最近一年使用:0次
8 . 常温下,将过量 粉末置于水中,达到沉淀溶解平衡:
粉末置于水中,达到沉淀溶解平衡: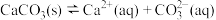 ,
, 。[已知:
。[已知: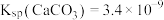 ,
,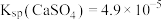 ,
, ,
,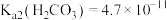 ],下列说法错误的是
],下列说法错误的是
 粉末置于水中,达到沉淀溶解平衡:
粉末置于水中,达到沉淀溶解平衡: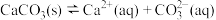 ,
, 。[已知:
。[已知: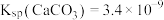 ,
,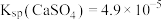 ,
, ,
,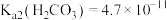 ],下列说法错误的是
],下列说法错误的是A.上层清液中: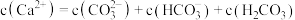 |
B.上层清液中: |
C.向体系中通入 气体,溶液中 气体,溶液中 增大 增大 |
D.向体系中加入 溶液,存在: 溶液,存在: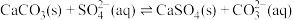  |
您最近一年使用:0次
解题方法
9 . 常温下,将等浓度的 溶液分别滴加到等
溶液分别滴加到等 、等体积的
、等体积的 、
、 两种弱酸溶液中,溶液的
两种弱酸溶液中,溶液的 与粒子浓度比值的对数关系如图所示。下列叙述错误的是
与粒子浓度比值的对数关系如图所示。下列叙述错误的是
 溶液分别滴加到等
溶液分别滴加到等 、等体积的
、等体积的 、
、 两种弱酸溶液中,溶液的
两种弱酸溶液中,溶液的 与粒子浓度比值的对数关系如图所示。下列叙述错误的是
与粒子浓度比值的对数关系如图所示。下列叙述错误的是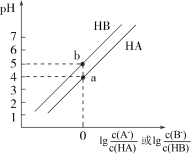
A. 的浓度大于 的浓度大于 的浓度 的浓度 |
| B.a点水的电离程度小于b点水的电离程度 |
C.常温下 的电离常数是 的电离常数是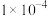 |
D.向 溶液中滴加 溶液中滴加 溶液至 溶液至 时, 时,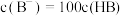 |
您最近一年使用:0次
10 . 一定条件下,按2:1的比例向容积为 的密闭容器充入A物质和B物质,发生反应:
的密闭容器充入A物质和B物质,发生反应: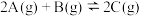 ,温度、压强(
,温度、压强( )对A物质的平衡转化率的影响如下图所示,下列说法错误的是
)对A物质的平衡转化率的影响如下图所示,下列说法错误的是
 的密闭容器充入A物质和B物质,发生反应:
的密闭容器充入A物质和B物质,发生反应: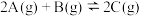 ,温度、压强(
,温度、压强( )对A物质的平衡转化率的影响如下图所示,下列说法错误的是
)对A物质的平衡转化率的影响如下图所示,下列说法错误的是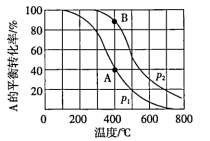
A.压强: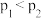 ; ; |
B.压强为 时,若 时,若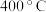 和 和 时该反应的速率分别为 时该反应的速率分别为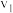 、 、 ,则: ,则: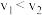 |
C.该反应的 |
| D.平衡常数:A点=B点 |
您最近一年使用:0次

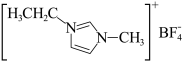 <NaBF4
<NaBF4

