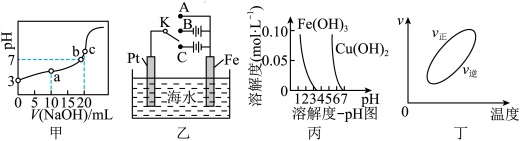
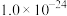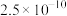1 . 下列对关系图像或实验装置(如图)的分析错误的是
| A.图甲表示等浓度的NaOH溶液滴定20mLHF溶液的滴定曲线,其中c点水的电离程度最大 |
| B.图乙所示装置,为减缓铁的腐蚀,开关K应置于C处 |
C.根据图丙可知若要除去 溶液中的 溶液中的 ,可向溶液中加入适量CuO至pH在3.5左右 ,可向溶液中加入适量CuO至pH在3.5左右 |
D.对于反应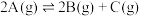  ,由图丁可知, ,由图丁可知, |
您最近半年使用:0次
解题方法
2 . Ⅰ.氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运。通过氨热分解法制取氢气,其反应的化学方程式如下: 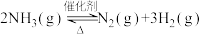
(1)根据下表数据,写出氨热分解法的热化学方程式___________ 。相关化学键的键能数据
(2)已知该反应的∆S=198.9×10-3kJ·mol-1·K-1,判断在300℃时反应是否能自发进行___________ (填“是”或“否”),理由是___________ 。
(3)在一定温度和催化剂的条件下,将0.1molNH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如下图所示。___________ mol·L-1·min-1(用含t1的代数式表示)。
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是___________ (用图中a、b、c、d表示),理由是___________ 。
Ⅱ.氨气的催化氧化是工业制取硝酸的重要步骤,假设只会发生以下两个竞争反应Ⅰ、Ⅱ。
反应Ⅰ: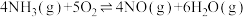
反应Ⅱ:
为分析某催化剂对该反应的选择性,将1moNH3和2molO2充入1L密闭容器中,在不同温度相同时间下,测得有关物质的量关系如图。___________ (填“Ⅰ”或“Ⅱ”)的选择性更好。
(5)高于840℃时,NO的产率降低的可能原因是___________。
(6)520℃时,反应4NH3(g)+3O2 2N2(g)+6H2O(g)的平衡常数K=
2N2(g)+6H2O(g)的平衡常数K=___________ (不要求得出计算结果,只需列出有具体数字的计算式)。
(7)请写出一种除了氨气以外的储氢载体及其生成氢气的化学方程式___________ 。
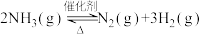
(1)根据下表数据,写出氨热分解法的热化学方程式
| 化学键 | N≡N | H-H | N-H |
| 键能E/(kJ·mol-1) | 946 | 436.0 | 390.8 |
(3)在一定温度和催化剂的条件下,将0.1molNH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如下图所示。
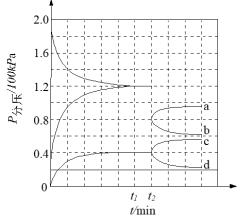
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是
Ⅱ.氨气的催化氧化是工业制取硝酸的重要步骤,假设只会发生以下两个竞争反应Ⅰ、Ⅱ。
反应Ⅰ:
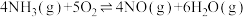
反应Ⅱ:

为分析某催化剂对该反应的选择性,将1moNH3和2molO2充入1L密闭容器中,在不同温度相同时间下,测得有关物质的量关系如图。
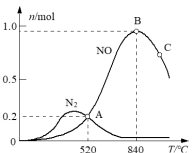
(5)高于840℃时,NO的产率降低的可能原因是___________。
| A.NH3溶于水 | B.反应活化能降低 |
| C.反应Ⅰ的平衡常数变小 | D.催化剂活性降低 |
 2N2(g)+6H2O(g)的平衡常数K=
2N2(g)+6H2O(g)的平衡常数K=(7)请写出一种除了氨气以外的储氢载体及其生成氢气的化学方程式
您最近半年使用:0次
名校
解题方法
3 . 丙烯是一种重要的化工原料,但丙烯的产量仅通过石油的催化裂解反应无法满足工业生产需求。工业上以WO3/SiO2为催化剂,利用丁烯和乙烯的催化歧化反应制丙烯: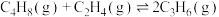
 。请回答下列问题:
。请回答下列问题:
(1)相关物质的燃烧热数据如下表所示:
催化歧化反应的
___________  ;
;
(2)利用丁烯和乙烯的催化歧化反应制备丙烯时,仅 发生如下反应:
反应ⅰ: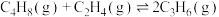
反应ⅱ:
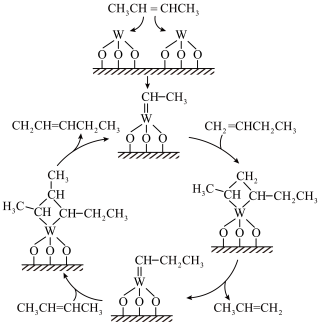
一定条件下,经相同反应时间,丙烯的产率、丁烯的转化率随温度变化的关系如图所示:___________ ,500~550℃丙烯产率下降的原因为___________ 。
②某温度下,保持体系总压强为1.0 MPa,按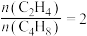 投料,达平衡状态时,C4H8、C2H4的转化率分别为96%、32%,则平衡时
投料,达平衡状态时,C4H8、C2H4的转化率分别为96%、32%,则平衡时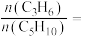
___________ ;反应ⅰ的压强平衡常数
___________ (保留三位有效数字)。
(3)反应ⅱ中,WO3/SiO2催化机理如图,关于该过程中的说法错误的是___________(填字母)。
(4)为了增强WO3/SiO2催化剂的活性和吸附能力,其他条件一定时,可向WO3/SiO2催化剂中添加催化剂助剂。下图为不同催化剂助剂的加入对丁烯的转化率、丙烯的选择性(产率 转化率
转化率 选择性)的影响,选择
选择性)的影响,选择___________ 作催化剂助剂为优选方案(填化学式)。
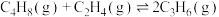
 。请回答下列问题:
。请回答下列问题:(1)相关物质的燃烧热数据如下表所示:
| 物质 | 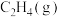 |  | 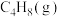 |
燃烧热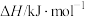 | -1411 | -2049 | -2539 |

 ;
;(2)利用丁烯和乙烯的催化歧化反应制备丙烯时,
反应ⅰ:
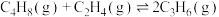
反应ⅱ:

一定条件下,经相同反应时间,丙烯的产率、丁烯的转化率随温度变化的关系如图所示:

②某温度下,保持体系总压强为1.0 MPa,按
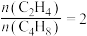 投料,达平衡状态时,C4H8、C2H4的转化率分别为96%、32%,则平衡时
投料,达平衡状态时,C4H8、C2H4的转化率分别为96%、32%,则平衡时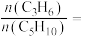

(3)反应ⅱ中,WO3/SiO2催化机理如图,关于该过程中的说法错误的是___________(填字母)。
| A.有加成反应发生 | B.能将2-丁烯转化为1-丁烯 |
| C.W元素的成键数目一直未发生变化 | D.存在碳碳单键的断裂和形成 |
 转化率
转化率 选择性)的影响,选择
选择性)的影响,选择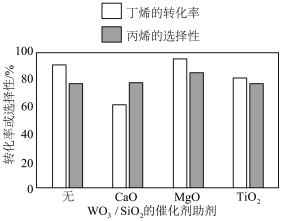
您最近半年使用:0次
7日内更新
|
467次组卷
|
4卷引用:东北三省2024届高三下学期三校二模联考化学试题
名校
4 . 一种利用含钴废料(主要成分为 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备
等杂质)制备 的工艺流程如下。下列说法错误的是
的工艺流程如下。下列说法错误的是

已知:常温下,部分金属离子沉淀的pH如下表。
 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备
等杂质)制备 的工艺流程如下。下列说法错误的是
的工艺流程如下。下列说法错误的是
已知:常温下,部分金属离子沉淀的pH如下表。
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 8.5 | 2.2 | 3.4 | 7.8 |
| 完全沉淀[c(金属离子)≤1×10-5mol/L]的pH | 10.0 | 3.0 | 4.5 | 9.4 |
A.“酸浸”时可用 代替 代替 |
B.“调pH”的范围为4.5~7.8,滤液中残留的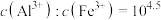 |
| C.气体X可在“调pH”操作单元回收利用 |
D.“高温焙烧”时的化学方程式: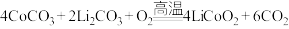 |
您最近半年使用:0次
名校
5 . 用 和
和 脱氢制备丙烯已成为制备丙烯的重要方法之一、相关反应为:
脱氢制备丙烯已成为制备丙烯的重要方法之一、相关反应为:
反应Ⅰ:
反应Ⅱ:
已知:①CO和 的标准燃烧热分别为
的标准燃烧热分别为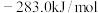 和
和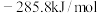 ;
;
②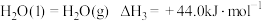
(1)计算
_______  。
。
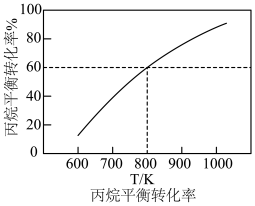
(2)维持体系总压强恒定为0.1MPa,加入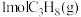 时体积为50L,再加入8.4mol水蒸气作为稀释剂,测得丙烷平衡转化率与温度关系如图所示,已知:水烃比是指投料中水蒸气和丙烷的物质的量之比。
时体积为50L,再加入8.4mol水蒸气作为稀释剂,测得丙烷平衡转化率与温度关系如图所示,已知:水烃比是指投料中水蒸气和丙烷的物质的量之比。
①计算800K下反应1的平衡常数
_______  。(用气体分压计算平衡常数为
。(用气体分压计算平衡常数为 ,气体分压=气体总压×气体的物质的量分数).
,气体分压=气体总压×气体的物质的量分数).
② 下,在图中画出水烃比为10时的曲线
下,在图中画出水烃比为10时的曲线_______ 。
③若其它条件不变,将8.4mol的水蒸气改为8.4mol的 ,则丙烷的平衡转化率将大大增加,请解释原因
,则丙烷的平衡转化率将大大增加,请解释原因______ 。
(3)化学家研究催化剂 催化丙烷脱氢机理如下图所示:
催化丙烷脱氢机理如下图所示:
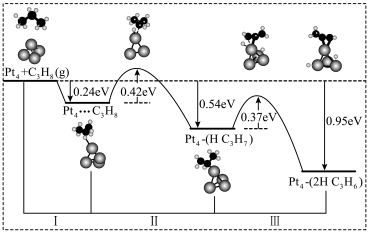
下列说法正确的是______。
 和
和 脱氢制备丙烯已成为制备丙烯的重要方法之一、相关反应为:
脱氢制备丙烯已成为制备丙烯的重要方法之一、相关反应为:反应Ⅰ:

反应Ⅱ:

已知:①CO和
 的标准燃烧热分别为
的标准燃烧热分别为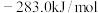 和
和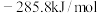 ;
;②
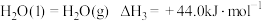
(1)计算

 。
。(2)维持体系总压强恒定为0.1MPa,加入
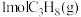 时体积为50L,再加入8.4mol水蒸气作为稀释剂,测得丙烷平衡转化率与温度关系如图所示,已知:水烃比是指投料中水蒸气和丙烷的物质的量之比。
时体积为50L,再加入8.4mol水蒸气作为稀释剂,测得丙烷平衡转化率与温度关系如图所示,已知:水烃比是指投料中水蒸气和丙烷的物质的量之比。①计算800K下反应1的平衡常数

 。(用气体分压计算平衡常数为
。(用气体分压计算平衡常数为 ,气体分压=气体总压×气体的物质的量分数).
,气体分压=气体总压×气体的物质的量分数).②
 下,在图中画出水烃比为10时的曲线
下,在图中画出水烃比为10时的曲线
③若其它条件不变,将8.4mol的水蒸气改为8.4mol的
 ,则丙烷的平衡转化率将大大增加,请解释原因
,则丙烷的平衡转化率将大大增加,请解释原因(3)化学家研究催化剂
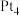 催化丙烷脱氢机理如下图所示:
催化丙烷脱氢机理如下图所示: 
下列说法正确的是______。
A.由图可知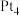 催化大致经过阶段Ⅰ(吸附)、反应Ⅱ(断裂第1个 催化大致经过阶段Ⅰ(吸附)、反应Ⅱ(断裂第1个 键)、反应Ⅲ(断裂第2个 键)、反应Ⅲ(断裂第2个 键) 键) |
B.反应Ⅱ活化能最大,是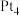 催化丙烷的决速阶段 催化丙烷的决速阶段 |
C.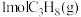 在 在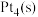 催化下反应生成 催化下反应生成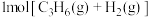 时,放出的热量为 时,放出的热量为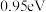 |
| D.若该催化反应在绝热容器中按照先发生Ⅰ,后发生Ⅱ,再发生Ⅲ,则完成反应Ⅱ后,不需要再加热就能发生反应Ⅲ |
您最近半年使用:0次
名校
解题方法
6 . 利用工业废气实现双减最有希望开展大规模应用的是 加氢生成甲醇的反应。298K、100kPa条件下该反应焓变和熵变的数据如下,假设反应
加氢生成甲醇的反应。298K、100kPa条件下该反应焓变和熵变的数据如下,假设反应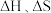 不随温度的改变而变化。
不随温度的改变而变化。
I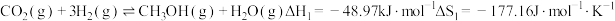
(1)该反应在________ 自发(填“低温”或“任意条件”或“高温”)
(2)在使用催化剂时,该反应由两个基元反应组成,写出决速步骤基元反应方程式________ 。
(3)给出温度 、总压
、总压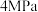 下,
下,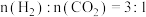 时,不同催化剂组成对
时,不同催化剂组成对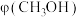 [
[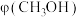 代表单位质量的催化剂在单位时间处理原料气的质量,体现出催化剂的处理能力]、甲醇选择性及副产物
代表单位质量的催化剂在单位时间处理原料气的质量,体现出催化剂的处理能力]、甲醇选择性及副产物 选择性的影响如下表:
选择性的影响如下表:
在实际生产过程中选择催化剂2、3组均可,请说明工业生产中应选择第2组催化剂最主要的原因________ ,选择催化剂3的最主要的原因________ 。
(4) 与
与 不同比例对
不同比例对 转化率和甲醇产率的影响如下图所示,在图中画出副产物
转化率和甲醇产率的影响如下图所示,在图中画出副产物 产率曲线
产率曲线________ (在图中标出与虚线的坐标)。
(5)温度在 时,
时, 和
和 反应生成甲醇的平衡常数为
反应生成甲醇的平衡常数为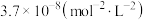 ,在恒容容器中按照
,在恒容容器中按照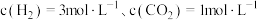 投料,若只发生反应Ⅰ,计算此时
投料,若只发生反应Ⅰ,计算此时 的平衡转化率
的平衡转化率________ 。
 加氢生成甲醇的反应。298K、100kPa条件下该反应焓变和熵变的数据如下,假设反应
加氢生成甲醇的反应。298K、100kPa条件下该反应焓变和熵变的数据如下,假设反应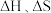 不随温度的改变而变化。
不随温度的改变而变化。I
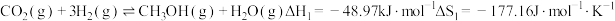
(1)该反应在
(2)在使用催化剂时,该反应由两个基元反应组成,写出决速步骤基元反应方程式

(3)给出温度
 、总压
、总压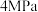 下,
下,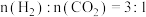 时,不同催化剂组成对
时,不同催化剂组成对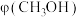 [
[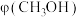 代表单位质量的催化剂在单位时间处理原料气的质量,体现出催化剂的处理能力]、甲醇选择性及副产物
代表单位质量的催化剂在单位时间处理原料气的质量,体现出催化剂的处理能力]、甲醇选择性及副产物 选择性的影响如下表:
选择性的影响如下表: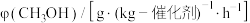 |  选择性(%) 选择性(%) | CO选择性(%) | |
| 催化剂1 | 78 | 40 | 60 |
| 催化剂2 | 88 | 100 | 0 |
| 催化剂3 | 138 | 91 | 9 |
(4)
 与
与 不同比例对
不同比例对 转化率和甲醇产率的影响如下图所示,在图中画出副产物
转化率和甲醇产率的影响如下图所示,在图中画出副产物 产率曲线
产率曲线
(5)温度在
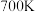 时,
时, 和
和 反应生成甲醇的平衡常数为
反应生成甲醇的平衡常数为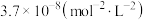 ,在恒容容器中按照
,在恒容容器中按照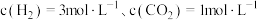 投料,若只发生反应Ⅰ,计算此时
投料,若只发生反应Ⅰ,计算此时 的平衡转化率
的平衡转化率
您最近半年使用:0次
名校
解题方法
7 . 请按要求回答下列问题:
(1)实验测得,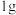 甲醇(常温下为液态)在氧气中完全燃烧释放出
甲醇(常温下为液态)在氧气中完全燃烧释放出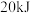 的热量,则表示甲醇燃烧热的热化学方程式为:
的热量,则表示甲醇燃烧热的热化学方程式为:___________ 。
(2)乙二胺(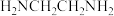 )易溶于水,可用于制造然料、药物等。乙二胺易溶于水的原因是
)易溶于水,可用于制造然料、药物等。乙二胺易溶于水的原因是___________ ,其分子中采取 杂化的原子是
杂化的原子是___________ (填元素符号)。
(3) 分子中含有
分子中含有 键的数目为
键的数目为___________ ,其晶体中含有的作用力为___________ (填标号)。
a.氢键 b.离子键 c.极性键 d.范德华力
(4)已知常温下,醋酸的电离平衡常数为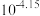 。向
。向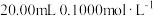 的醋酸溶液中滴加
的醋酸溶液中滴加 的
的 溶液
溶液 反应后溶液的
反应后溶液的 为(
为(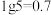 )
)___________ ;
(5)同浓度条件下,①氨水、② 溶液、③
溶液、③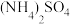 溶液、④
溶液、④ 溶液比较
溶液比较 大小关系:
大小关系:___________ 。
(1)实验测得,
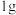 甲醇(常温下为液态)在氧气中完全燃烧释放出
甲醇(常温下为液态)在氧气中完全燃烧释放出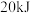 的热量,则表示甲醇燃烧热的热化学方程式为:
的热量,则表示甲醇燃烧热的热化学方程式为:(2)乙二胺(
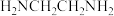 )易溶于水,可用于制造然料、药物等。乙二胺易溶于水的原因是
)易溶于水,可用于制造然料、药物等。乙二胺易溶于水的原因是 杂化的原子是
杂化的原子是(3)
 分子中含有
分子中含有 键的数目为
键的数目为a.氢键 b.离子键 c.极性键 d.范德华力
(4)已知常温下,醋酸的电离平衡常数为
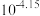 。向
。向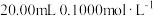 的醋酸溶液中滴加
的醋酸溶液中滴加 的
的 溶液
溶液 反应后溶液的
反应后溶液的 为(
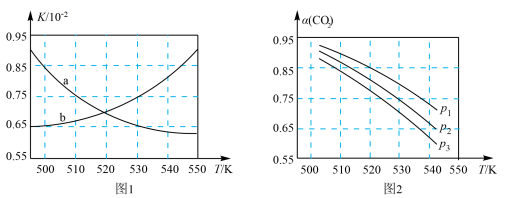
为(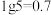 )
)(5)同浓度条件下,①氨水、②
 溶液、③
溶液、③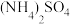 溶液、④
溶液、④ 溶液比较
溶液比较 大小关系:
大小关系:
您最近半年使用:0次
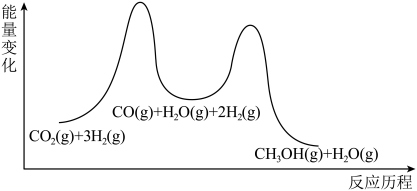
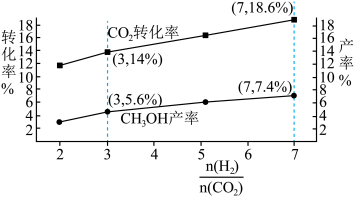
8 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)⇌CO(g)+H2O(g) △H1=+41kJ·mol﹣1
②CO(g)+2H2(g)⇌CH3OH(g) △H1=-99kJ·mol﹣1
(1)总反应的

(2)甲醇(CH3OH)直接燃料电池具有启动快,效率高等优点,若电解质为酸性,甲醇直接燃料电池的负极反应为
(3)总反应的化学平衡常数K的表达式为
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为
(5)总反应的平衡常数为K,反应①的平衡常数为K1,反应②的平衡常数为K2则K=
您最近半年使用:0次
名校
解题方法
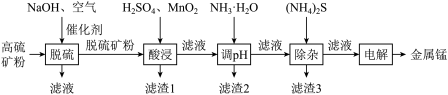
9 . 一种高硫锰矿的主要成分为 ,主要杂质为
,主要杂质为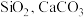 ,还含有少量
,还含有少量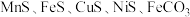 等,其中
等,其中 含量较大。研究人员设计了如下流程,制得了金属锰。
含量较大。研究人员设计了如下流程,制得了金属锰。
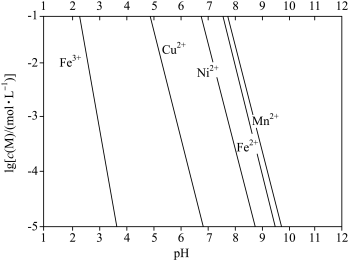
已知:①金属离子的 与溶液pH的关系如下图所示:
与溶液pH的关系如下图所示:
②金属硫化物的溶度积常数如下表。
金属硫化物 |
|
|
|
|
|
|
|
|
|
回答下列问题。
(1)碱性溶液中,在催化剂存在下通空气氧化脱硫,硫化物中的硫元素被氧化为单质,铁元素变成氢氧化铁。写出该过程中硫化亚铁反应的化学方程式
(2)根据矿物组成,脱硫时能被
 溶解的物质是
溶解的物质是(3)若未经脱硫直接酸浸,会产生的污染物是
(4)酸浸时主要含锰组分发生反应的化学方程式为
 的作用是
的作用是(5)调溶液
 到5左右,滤渣2的主要成分是
到5左右,滤渣2的主要成分是 除去的主要离子是
除去的主要离子是(6)除杂后的
 溶液通过电解制得金属锰,若生成
溶液通过电解制得金属锰,若生成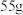 金属锰,则阳极放出的气体在标准状况下的体积为
金属锰,则阳极放出的气体在标准状况下的体积为
您最近半年使用:0次
名校
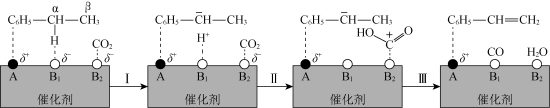
10 .  参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( ,
, 表示乙苯分子中C或H原子的位置:A、B为催化剂的活性位点,其中A位点带部分正电荷,
表示乙苯分子中C或H原子的位置:A、B为催化剂的活性位点,其中A位点带部分正电荷, 、
、 位点带部分负电荷)。下列说法不正确的是
位点带部分负电荷)。下列说法不正确的是
 参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( ,
, 表示乙苯分子中C或H原子的位置:A、B为催化剂的活性位点,其中A位点带部分正电荷,
表示乙苯分子中C或H原子的位置:A、B为催化剂的活性位点,其中A位点带部分正电荷, 、
、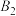 位点带部分负电荷)。下列说法不正确的是
位点带部分负电荷)。下列说法不正确的是
A.乙苯脱氢反应中 作氧化剂 作氧化剂 |
| B.乙苯脱氢后所得有机产物中所有原子可以共平面 |
C.步骤Ⅰ可表述为乙苯 带部分正电荷,被带部分负电荷的 带部分正电荷,被带部分负电荷的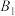 位点吸引,随后解离出 位点吸引,随后解离出 并吸附在 并吸附在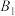 位点上 位点上 |
D.步骤Ⅱ可描述为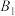 位点上的 位点上的 与 与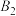 位点上 位点上 中带部分负电荷的C作用生成 中带部分负电荷的C作用生成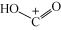 ,带部分正电荷的C吸附在带部分负电荷的 ,带部分正电荷的C吸附在带部分负电荷的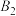 位点上 位点上 |
您最近半年使用:0次