名校
1 . 已知反应① 和反应②
和反应②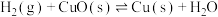 在T℃时的平衡常数分别为
在T℃时的平衡常数分别为 和
和 ,该温度下反应③
,该温度下反应③ 的平衡常数为
的平衡常数为 。则下列说法正确的是
。则下列说法正确的是
 和反应②
和反应②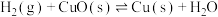 在T℃时的平衡常数分别为
在T℃时的平衡常数分别为 和
和 ,该温度下反应③
,该温度下反应③ 的平衡常数为
的平衡常数为 。则下列说法正确的是
。则下列说法正确的是A.反应①的平衡常数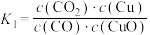 |
B.反应②中,增大氢气浓度,平衡正移, 增大 增大 |
C.对于反应③,T℃时, |
| D.反应③,恒容时,温度升高,K值减小,则该反应为放热反应 |
您最近一年使用:0次
2024-01-07更新
|
234次组卷
|
4卷引用:山西省朔州市怀仁一中2023-2024学年高二上学期12月期中考试化学试题
名校
2 . 五氧化二碘( )是一种重要的工业试剂,常温下为白色针状晶体,可作氧化剂,除去空气中的一氧化碳。
)是一种重要的工业试剂,常温下为白色针状晶体,可作氧化剂,除去空气中的一氧化碳。
反应Ⅰ:

 ;
;
反应Ⅱ: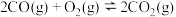

 ;
;
反应Ⅲ: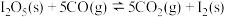

 。
。
回答下列问题:
(1)对于上述反应Ⅰ、Ⅱ、Ⅲ:
①
___________ (用含 、
、 的代数式表示),
的代数式表示),
___________ (用含 、
、 的代数式表示)。
的代数式表示)。
②查阅资料可知: 、
、 ,则反应Ⅱ的平衡常数
,则反应Ⅱ的平衡常数 随着温度的升高而
随着温度的升高而___________ (填“增大”或“减小”),判断的理由为___________ 。
(2) ℃时向盛有足量
℃时向盛有足量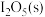 的VL恒容密闭容器中通入
的VL恒容密闭容器中通入 ,此时压强为p,仅发生反应
,此时压强为p,仅发生反应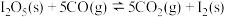
 ,
, ℃时,
℃时, 后,该反应达到平衡,且反应达到平衡后固体质量减小6.4g。
后,该反应达到平衡,且反应达到平衡后固体质量减小6.4g。
①下列关于反应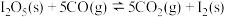 的说法正确的是
的说法正确的是___________ (填标号)。
A.仅加入合适的催化剂,反应速率加快且 的值变大
的值变大
B.该反应的反应物的总键能小于生成物的总键能
C.每断裂1molC=O键,同时消耗0.5molCO,则该反应达到平衡
D.仅充入少量稀有气体,正、逆反应速率均增大
② ℃时,该反应达到平衡时的平衡常数
℃时,该反应达到平衡时的平衡常数
___________ (分压=总压×物质的量分数)。
③保持其他条件不变,仅移出部分 ,CO的平衡转化率随
,CO的平衡转化率随 的移出率[
的移出率[ 的移出率
的移出率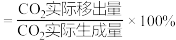 ]的变化关系如图。则
]的变化关系如图。则
___________ ,
___________ 。
 )是一种重要的工业试剂,常温下为白色针状晶体,可作氧化剂,除去空气中的一氧化碳。
)是一种重要的工业试剂,常温下为白色针状晶体,可作氧化剂,除去空气中的一氧化碳。反应Ⅰ:


 ;
;反应Ⅱ:
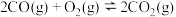

 ;
;反应Ⅲ:
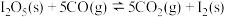

 。
。回答下列问题:
(1)对于上述反应Ⅰ、Ⅱ、Ⅲ:
①

 、
、 的代数式表示),
的代数式表示),
 、
、 的代数式表示)。
的代数式表示)。②查阅资料可知:
 、
、 ,则反应Ⅱ的平衡常数
,则反应Ⅱ的平衡常数 随着温度的升高而
随着温度的升高而(2)
 ℃时向盛有足量
℃时向盛有足量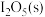 的VL恒容密闭容器中通入
的VL恒容密闭容器中通入 ,此时压强为p,仅发生反应
,此时压强为p,仅发生反应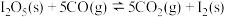
 ,
, ℃时,
℃时, 后,该反应达到平衡,且反应达到平衡后固体质量减小6.4g。
后,该反应达到平衡,且反应达到平衡后固体质量减小6.4g。①下列关于反应
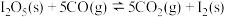 的说法正确的是
的说法正确的是A.仅加入合适的催化剂,反应速率加快且
 的值变大
的值变大B.该反应的反应物的总键能小于生成物的总键能
C.每断裂1molC=O键,同时消耗0.5molCO,则该反应达到平衡
D.仅充入少量稀有气体,正、逆反应速率均增大
②
 ℃时,该反应达到平衡时的平衡常数
℃时,该反应达到平衡时的平衡常数
③保持其他条件不变,仅移出部分
 ,CO的平衡转化率随
,CO的平衡转化率随 的移出率[
的移出率[ 的移出率
的移出率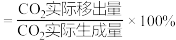 ]的变化关系如图。则
]的变化关系如图。则

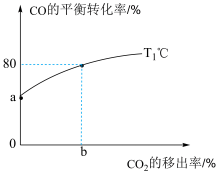
您最近一年使用:0次
2023-07-04更新
|
255次组卷
|
11卷引用:山西省部分学校2023-2024学年高二上学期11月期中联合考试化学试题
山西省部分学校2023-2024学年高二上学期11月期中联合考试化学试题四川省自贡市第一中学校2023-2024学年高二上学期期中考试化学试卷辽宁省抚顺市六校2023-2024学年高二上学期期中考试化学试题山西省忻州市名校2023-2024学年高二下学期3月联合考试化学试题四川省雅安市多校联考2023-2024学年高二上学期期中考试化学试题陕西省商洛市2022-2023学年高二下学期7月期末考试化学试题辽宁省铁岭市六校2022-2023学年高一下学期期末考试化学试题河北省邯郸市2022-2023学年高二下学期期末考试化学试题河北省邢台市四校联盟2023-2024学年高二上学期11月月考化学试题河北省邯郸市鸡泽县第一中学2023-2024学年高二上学期12月月考化学试题江西省部分高中学校2023-2024学年高二上学期11月月考化学试卷
3 . 已知一定条件下:
①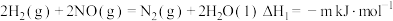 ;
;
② ;
;
③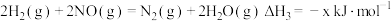 ﹔
﹔
④
下列关系式中正确的是
①
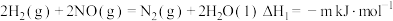 ;
;②
 ;
;③
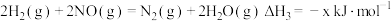 ﹔
﹔④

下列关系式中正确的是
A.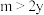 | B.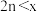 | C.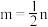 | D. |
您最近一年使用:0次
2023-11-24更新
|
79次组卷
|
3卷引用:山西省朔州市怀仁一中2023-2024学年高二上学期12月期中考试化学试题
4 . 氮的氧化物是造成大气污染的主要成分之一,降低氮氧化物的排放可改善大气质量。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+181kJ•mol-1
2C(s)+O2(g)=2CO(g) △H2=-221kJ•mol-1
2NO(g)+2CO(g) N2(g)+2CO2(g) △H3=-747kJ•mol-1
N2(g)+2CO2(g) △H3=-747kJ•mol-1
碳完全燃烧时的热化学方程式为______ 。
(2)向密闭反应器中按n(NO):n(CO)=1:1投料,发生(1)中的反应③。不同温度下,反应达到平衡时,NO的平衡转化率随压强的变化曲线如图所示。
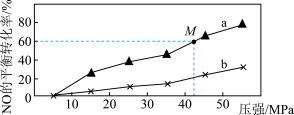
①曲线a、b对应温度较低的是______ (填“曲线a”或“曲线b”)。
②M点时混合气体的平均相对分子质量为______ (结果保留两位小数)。
(3)一定温度下,向恒容密闭容器中通入1molNO、1molCO,发生(1)中的反应③。测得容器中混合气体的压强(p)随时间(t)的变化关系如表所示。
①反应开始到刚达平衡状态的时间段内,v(CO)=______ kPa·min-1,该反应条件下的平衡常数Kp=_____ (kPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。该反应中正反应速率v正=k正·p2(NO)·p2(CO),逆反应速率v逆=k逆·p(N2)·p2(CO2),则该温度下,该反应的k正_____ (填“>”“<”或“=”)k逆。
②能判断反应已达到化学平衡状态的是______ (填字母序号)。
A.N2和CO2的浓度比保持不变 B.容器中熵值保持不变
C.2v正(NO)=v逆(N2) D.气体的密度保持不变
(4)工业上利用电化学方法处理NO的原理如图所示。正极的电极反应式为______ 。
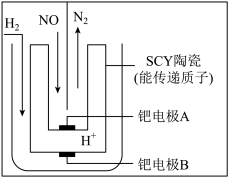
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+181kJ•mol-1
2C(s)+O2(g)=2CO(g) △H2=-221kJ•mol-1
2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H3=-747kJ•mol-1
N2(g)+2CO2(g) △H3=-747kJ•mol-1碳完全燃烧时的热化学方程式为
(2)向密闭反应器中按n(NO):n(CO)=1:1投料,发生(1)中的反应③。不同温度下,反应达到平衡时,NO的平衡转化率随压强的变化曲线如图所示。

①曲线a、b对应温度较低的是
②M点时混合气体的平均相对分子质量为
(3)一定温度下,向恒容密闭容器中通入1molNO、1molCO,发生(1)中的反应③。测得容器中混合气体的压强(p)随时间(t)的变化关系如表所示。
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| p/kPa | 200 | 185 | 173 | 165 | 160 | 160 |
②能判断反应已达到化学平衡状态的是
A.N2和CO2的浓度比保持不变 B.容器中熵值保持不变
C.2v正(NO)=v逆(N2) D.气体的密度保持不变
(4)工业上利用电化学方法处理NO的原理如图所示。正极的电极反应式为

您最近一年使用:0次
2023-05-16更新
|
316次组卷
|
3卷引用:山西省吕梁市孝义市2022-2023学年高二下学期期中考试化学试题
名校
解题方法
5 . 在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:
变化示意图如图:
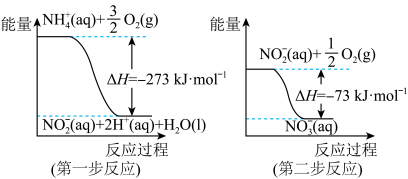
(1)第一步反应是_______ (填“放热”或“吸热”)反应,判断依据是_______ 。
(2)1molNH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是_______ 。
(3)HCl与氧气在催化剂加热条件下可生成氯气和气态水:4HCl+O2 2Cl2+2H2O,已知某些化学键的键能数据如表:
2Cl2+2H2O,已知某些化学键的键能数据如表:
该反应的热化学方程式是_______ 。
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:变化示意图如图:

(1)第一步反应是
(2)1molNH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是(3)HCl与氧气在催化剂加热条件下可生成氯气和气态水:4HCl+O2
 2Cl2+2H2O,已知某些化学键的键能数据如表:
2Cl2+2H2O,已知某些化学键的键能数据如表:| 化学键 | H-Cl | O=O | Cl-Cl | H-O |
| 键能/kJmol | 431 | 498 | 243 | 463 |
该反应的热化学方程式是
您最近一年使用:0次
名校
6 . 合成气是一种重要的化工原料气,甲烷、二氧化碳自热重整制合成气的主要反应有:
Ⅰ.CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1=+247.3kJ·mol-1
2CO(g)+2H2(g) ΔH1=+247.3kJ·mol-1
Ⅱ.CH4(g)+H2O(g) CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1
CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)ΔH3=___________ kJ·mol-1。
(2)一定条件下,向VL恒容密闭容器中通入2molCH4(g)、1molCO2(g)、1molH2O(g)发生上述反应,达到平衡时,容器中CH4(g)为amol,CO2(g)为bmol,此时CO(g)的浓度为___________ mol·L-1,反应Ⅲ的平衡常数为___________ 。(用含字母的代数式表示)
(3)不同温度下,向VL密闭容器中按照n(CO2)∶n(CH4)∶n(H2O)=1∶1∶1投料,实验测得平衡时n(H2)∶n(CO)随温度的变化关系如图所示:

①压强P1、P2、P3由大到小的顺序为___________ ,判断的依据是___________ 。
②压强为P2时,随着温度升高,n(H2)∶n(CO)先增大后减小。解释温度Tm前后,随着温度升高n(H2)∶n(CO)变化的原因分别是___________ 。
(4)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图如下:
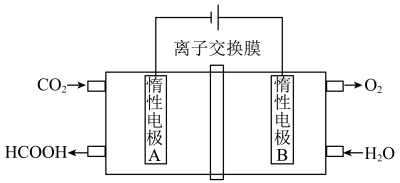
则A极的电极反应式为:___________ 。
Ⅰ.CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH1=+247.3kJ·mol-1
2CO(g)+2H2(g) ΔH1=+247.3kJ·mol-1Ⅱ.CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1
CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1Ⅲ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3回答下列问题:
(1)ΔH3=
(2)一定条件下,向VL恒容密闭容器中通入2molCH4(g)、1molCO2(g)、1molH2O(g)发生上述反应,达到平衡时,容器中CH4(g)为amol,CO2(g)为bmol,此时CO(g)的浓度为
(3)不同温度下,向VL密闭容器中按照n(CO2)∶n(CH4)∶n(H2O)=1∶1∶1投料,实验测得平衡时n(H2)∶n(CO)随温度的变化关系如图所示:

①压强P1、P2、P3由大到小的顺序为
②压强为P2时,随着温度升高,n(H2)∶n(CO)先增大后减小。解释温度Tm前后,随着温度升高n(H2)∶n(CO)变化的原因分别是
(4)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图如下:

则A极的电极反应式为:
您最近一年使用:0次
7 . 近年来,改善环境是科学研究的重要课题,对实现碳循环及废气资源的再利用技术的发展都具有重要意义。
(1)以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1 K1
CH3OH(g)+H2O(g) △H1 K1
Ⅱ.CO(g)+2H2(g) CH3OH(g) △H2 K2
CH3OH(g) △H2 K2
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) △H3 K3
CO(g)+H2O(g) △H3 K3
则△H2=______ (用含△H1、△H3的代数式表示),K2=______ (用含K1、K3的代数式表示)。
(2)一定条件下,CH4和H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) △H,设起始
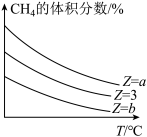
CO(g)+3H2(g) △H,设起始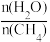 =Z,在恒压下,反应达到平衡时CH4的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
=Z,在恒压下,反应达到平衡时CH4的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是______ (填标号)。
(3)在T1℃时,往10L的某恒容密闭容器中充入3molCH4(g)和5molH2O(g),发生反应CH4(g)+H2O(g) CO(g)+3H2(g),5min后该反应达到平衡,此时测得混合气体的总压强为起始压强的1.5倍,则:
CO(g)+3H2(g),5min后该反应达到平衡,此时测得混合气体的总压强为起始压强的1.5倍,则:
①0~5min内,v(H2)=______ mol•L-1•min-1,H2O(g)的平衡转化率为______ %。
②该反应的平衡常数K=______ (mol•L-1)2。
③反应达到平衡时,再充入1molH2O(g)和2molCO(g),此时v正______ (填“>”、“<”或“=”)v逆。
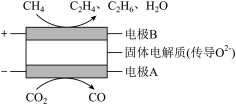
(4)CH4和CO2都是比较稳定的分子,科学家利用化学装置实现两种分子的耦合转化,其原理如图所示。若生成乙烯和乙烷的体积比为7∶3,则消耗CH4和CO2的体积比为______ 。
(1)以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1 K1
CH3OH(g)+H2O(g) △H1 K1Ⅱ.CO(g)+2H2(g)
 CH3OH(g) △H2 K2
CH3OH(g) △H2 K2Ⅲ.CO2(g)+H2(g)
 CO(g)+H2O(g) △H3 K3
CO(g)+H2O(g) △H3 K3则△H2=
(2)一定条件下,CH4和H2O(g)发生反应:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H,设起始
CO(g)+3H2(g) △H,设起始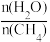 =Z,在恒压下,反应达到平衡时CH4的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
=Z,在恒压下,反应达到平衡时CH4的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
| A.若氢气的物质的量分数不再随时间而改变,则该反应达到平衡 |
| B.加入合适的催化剂,该反应的平衡转化率和△H的值均增大 |
| C.当混合气体的平均相对分子质量不再随时间而改变时,该反应达到平衡 |
| D.a>3>b |
 CO(g)+3H2(g),5min后该反应达到平衡,此时测得混合气体的总压强为起始压强的1.5倍,则:
CO(g)+3H2(g),5min后该反应达到平衡,此时测得混合气体的总压强为起始压强的1.5倍,则:①0~5min内,v(H2)=
②该反应的平衡常数K=
③反应达到平衡时,再充入1molH2O(g)和2molCO(g),此时v正
(4)CH4和CO2都是比较稳定的分子,科学家利用化学装置实现两种分子的耦合转化,其原理如图所示。若生成乙烯和乙烷的体积比为7∶3,则消耗CH4和CO2的体积比为

您最近一年使用:0次
2023-04-16更新
|
92次组卷
|
2卷引用:山西省忻州一中忻州实验中学校2022-2023学年高二下学期4月期中联考化学试题
8 . 燃煤烟气中含有大量 和NO是大气主要污染物,需要经过净化处理后才能排放。
和NO是大气主要污染物,需要经过净化处理后才能排放。
(1)尿素 可用于
可用于 和NO的吸收。
和NO的吸收。
①已知: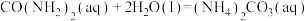
 ,
,

 ,
,
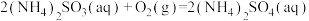
 ,反应
,反应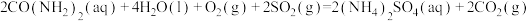 的
的
___________  。
。
②尿素 可将NO转化为
可将NO转化为 和
和 而除去,该反应的化学方程式为
而除去,该反应的化学方程式为___________ 。
(2)利用电化学联合处理法可实现 和NO同时除去,工作原理如图所示。
和NO同时除去,工作原理如图所示。
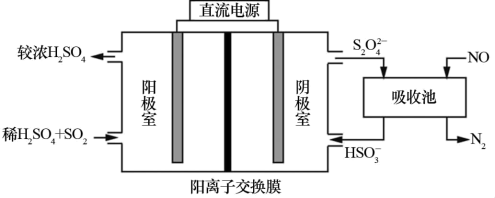
①阳极的电极反应式为___________ 。
②若工作前后阴极室成分不变,被处理的 和NO在相同条件下的体积比
和NO在相同条件下的体积比
___________ 。
 和NO是大气主要污染物,需要经过净化处理后才能排放。
和NO是大气主要污染物,需要经过净化处理后才能排放。(1)尿素
 可用于
可用于 和NO的吸收。
和NO的吸收。①已知:
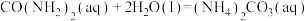
 ,
,
 ,
,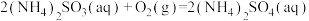
 ,反应
,反应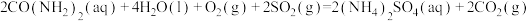 的
的
 。
。②尿素
 可将NO转化为
可将NO转化为 和
和 而除去,该反应的化学方程式为
而除去,该反应的化学方程式为(2)利用电化学联合处理法可实现
 和NO同时除去,工作原理如图所示。
和NO同时除去,工作原理如图所示。
①阳极的电极反应式为
②若工作前后阴极室成分不变,被处理的
 和NO在相同条件下的体积比
和NO在相同条件下的体积比
您最近一年使用:0次
9 . 尿素 是目前使用量较大的一种化学氮肥。
是目前使用量较大的一种化学氮肥。
I.以 、
、 为原料生产尿素
为原料生产尿素 的反应历程与能量变化示意图如下:
的反应历程与能量变化示意图如下:
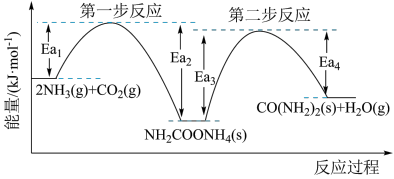
(1)图中的两步反应属于放热反应的
_______  。(用
。(用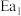 、
、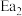 、
、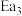 、
、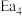 表示,下同)
表示,下同)
(2)根据图像写出以 、
、 为原料生产尿素
为原料生产尿素 的热化学方程式:
的热化学方程式:_______ 。
(3)根据上述反应历程与能量变化示意图,过程_______ (填“第一步反应”或“第二步反应”)为决速步。
II.氨基甲酸铵为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。
已知:①
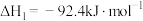
②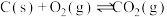
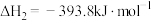
③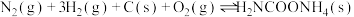
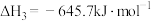
(4)请写出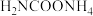 分解生成
分解生成 与
与 气体的热化学方程式:
气体的热化学方程式:_______ 。
 是目前使用量较大的一种化学氮肥。
是目前使用量较大的一种化学氮肥。I.以
 、
、 为原料生产尿素
为原料生产尿素 的反应历程与能量变化示意图如下:
的反应历程与能量变化示意图如下:
(1)图中的两步反应属于放热反应的

 。(用
。(用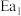 、
、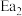 、
、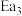 、
、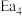 表示,下同)
表示,下同)(2)根据图像写出以
 、
、 为原料生产尿素
为原料生产尿素 的热化学方程式:
的热化学方程式:(3)根据上述反应历程与能量变化示意图,过程
II.氨基甲酸铵为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。
已知:①

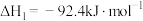
②
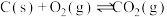
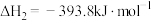
③
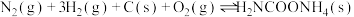
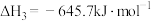
(4)请写出
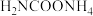 分解生成
分解生成 与
与 气体的热化学方程式:
气体的热化学方程式:
您最近一年使用:0次
解题方法
10 . 下表所列是2个反应在不同温度时的化学平衡常数(K)值。
下列关于反应①、②的说法正确的是
| 反应 | ① | ② | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 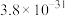 | 0.1 | 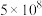 | 0.507 | 0.152 |
| A.①、②均为放热反应 |
B.一定温度下,①、②分别达到平衡,压缩容器体积(加压)均可使 的转化率增大 的转化率增大 |
| C.①、②均实现了“固氮”的过程,但①不适合用于大规模人工固氮 |
D.若已知①、②的 ,即可求算反应 ,即可求算反应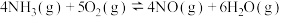 的 的 |
您最近一年使用:0次



