解题方法
1 . 回答下列问题:
(1)以 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 的反应为:
的反应为: ,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。____________ 转化为化学能。
②由图中信息经计算可知,2mol 发生光解反应生成2mol CO和1mol
发生光解反应生成2mol CO和1mol  需要
需要____________ (填“吸收”或“放出”)能量为____________ kJ。
(2)下列反应中属于吸热反应的是____________ 。(填字母)
a.盐酸与烧碱溶液反应 b. 与氯化铵固体反应
与氯化铵固体反应
c.盐酸与小苏打反应 d.镁和盐酸反应
(3)氢气被认为是21世纪替代矿物燃料的理想能源,每克 和汽油燃烧放出的热量分别为55kJ和46kJ。请分析氢气作为锌能源替代汽油的优势:
和汽油燃烧放出的热量分别为55kJ和46kJ。请分析氢气作为锌能源替代汽油的优势:
ⅰ. 为清洁能源,不污染环境;
为清洁能源,不污染环境;
ⅱ. 。
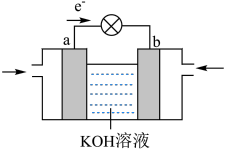
图中装置为氢氧燃料电池,回答下列问题: 向
向____________ 电极移动(填“a”或“b”);
②b电极上的反应式为_________________ 。当外电路中转移1mol电子时,a电极消耗的 在标准状况下体积为
在标准状况下体积为____________ L。
(4)“天宫1号”使用的蓄电池为镍氢电池,电解质为碱性溶液,该电池的总反应式为:
 。放电时,该电池的正极反应式为
。放电时,该电池的正极反应式为________ ,该电极附近溶液pH将_____ (填“增大”、“减小”或“不变”)。
(1)以
 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 的反应为:
的反应为: ,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。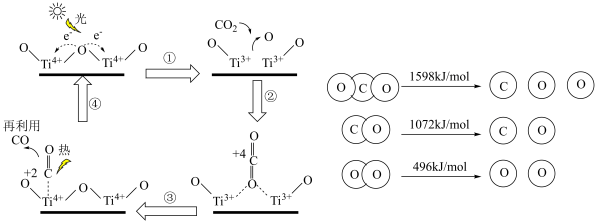
②由图中信息经计算可知,2mol
 发生光解反应生成2mol CO和1mol
发生光解反应生成2mol CO和1mol  需要
需要(2)下列反应中属于吸热反应的是
a.盐酸与烧碱溶液反应 b.
 与氯化铵固体反应
与氯化铵固体反应c.盐酸与小苏打反应 d.镁和盐酸反应
(3)氢气被认为是21世纪替代矿物燃料的理想能源,每克
 和汽油燃烧放出的热量分别为55kJ和46kJ。请分析氢气作为锌能源替代汽油的优势:
和汽油燃烧放出的热量分别为55kJ和46kJ。请分析氢气作为锌能源替代汽油的优势:ⅰ.
 为清洁能源,不污染环境;
为清洁能源,不污染环境;ⅱ. 。
图中装置为氢氧燃料电池,回答下列问题:
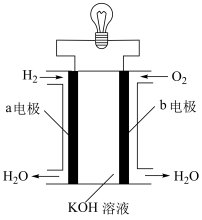
 向
向②b电极上的反应式为
 在标准状况下体积为
在标准状况下体积为(4)“天宫1号”使用的蓄电池为镍氢电池,电解质为碱性溶液,该电池的总反应式为:

 。放电时,该电池的正极反应式为
。放电时,该电池的正极反应式为
您最近一年使用:0次
2 . 化学在生产生活中无处不在。
 .某汽车安全气囊的气体发生剂主要含有叠氮化钠(
.某汽车安全气囊的气体发生剂主要含有叠氮化钠( )、三氧化二铁(
)、三氧化二铁( )、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
)、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)汽车受到猛烈碰撞时,点火器点火引发 迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是___________ (填字母),生成氮气的电子式为___________ 。 .
. 、
、 (甲醇)既是重要的化工原料,又是重要的能源物质。
(甲醇)既是重要的化工原料,又是重要的能源物质。
(2)将2.0 mol 和4.0 mol
和4.0 mol  通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应
通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应 ,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用
,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为___________ 。
(3)一定条件下,将1.0 mol 与2.0 mol
与2.0 mol  充入密闭容器中发生反应
充入密闭容器中发生反应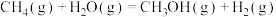 ,下列措施可以提高化学反应速率的是
,下列措施可以提高化学反应速率的是___________ (填字母)。
a.恒容条件下充入He b.增大体积 c.升高温度 d.保持恒容投入更多的 e.加入合适的催化剂
e.加入合适的催化剂
(4)用 设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为
设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为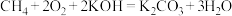 。
。 向B电极定向移动,则
向B电极定向移动,则___________ (填“A”或“B”)电极入口通甲烷,该电极反应的离子方程式为___________ 。
②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为___________ 。
 .某汽车安全气囊的气体发生剂主要含有叠氮化钠(
.某汽车安全气囊的气体发生剂主要含有叠氮化钠( )、三氧化二铁(
)、三氧化二铁( )、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
)、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。(1)汽车受到猛烈碰撞时,点火器点火引发
 迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是A.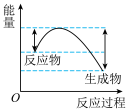 B.
B.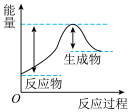 C.
C.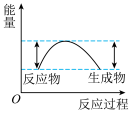
 .
. 、
、 (甲醇)既是重要的化工原料,又是重要的能源物质。
(甲醇)既是重要的化工原料,又是重要的能源物质。(2)将2.0 mol
 和4.0 mol
和4.0 mol  通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应
通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应 ,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用
,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为(3)一定条件下,将1.0 mol
 与2.0 mol
与2.0 mol  充入密闭容器中发生反应
充入密闭容器中发生反应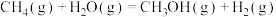 ,下列措施可以提高化学反应速率的是
,下列措施可以提高化学反应速率的是a.恒容条件下充入He b.增大体积 c.升高温度 d.保持恒容投入更多的
 e.加入合适的催化剂
e.加入合适的催化剂(4)用
 设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为
设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为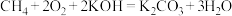 。
。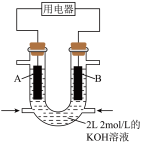
 向B电极定向移动,则
向B电极定向移动,则②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为
您最近一年使用:0次
名校
解题方法
3 . 某温度下CO2加氢制甲醇的总反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g)(该反应为放热反应),在固定容积为2.0 L的密闭容器中充入0.8 mol的CO2和2.4 mol的H2,测得CO2和CH3OH的物质的量随时间变化如图。请回答:
CH3OH(g)+H2O(g)(该反应为放热反应),在固定容积为2.0 L的密闭容器中充入0.8 mol的CO2和2.4 mol的H2,测得CO2和CH3OH的物质的量随时间变化如图。请回答:_______ (填“大于”“小于”或“等于”)生成物的化学键形成要放出的能量。
(2)2 min末时v正_______ (填“<”“>”或“=”)v逆。
(3)恒温恒容条件下,能说明反应已达平衡状态的是_______ 。
A.混合气体的密度保持不变
B.消耗1molCO2的同时消耗1molCH3OH
C.容器中CH3OH浓度与H2O浓度之比为1∶1
D.CO2(g)体积分数保持不变
E.v(H2) = 3v(CH3OH)
(4)该反应平衡时H2的转化率为_______ 。
(5)二氧化碳加氢制甲醇一般认为可通过两步反应来实现,物质变化与体系能量变化如题图所示。 CO(g)+H2O(g)。
CO(g)+H2O(g)。
②_______ (用化学方程式表示)。
总反应可表示为CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH_______ (填“>”或“<”)0。
 CH3OH(g)+H2O(g)(该反应为放热反应),在固定容积为2.0 L的密闭容器中充入0.8 mol的CO2和2.4 mol的H2,测得CO2和CH3OH的物质的量随时间变化如图。请回答:
CH3OH(g)+H2O(g)(该反应为放热反应),在固定容积为2.0 L的密闭容器中充入0.8 mol的CO2和2.4 mol的H2,测得CO2和CH3OH的物质的量随时间变化如图。请回答: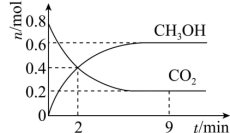
(2)2 min末时v正
(3)恒温恒容条件下,能说明反应已达平衡状态的是
A.混合气体的密度保持不变
B.消耗1molCO2的同时消耗1molCH3OH
C.容器中CH3OH浓度与H2O浓度之比为1∶1
D.CO2(g)体积分数保持不变
E.v(H2) = 3v(CH3OH)
(4)该反应平衡时H2的转化率为
(5)二氧化碳加氢制甲醇一般认为可通过两步反应来实现,物质变化与体系能量变化如题图所示。
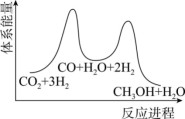
 CO(g)+H2O(g)。
CO(g)+H2O(g)。②
总反应可表示为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
您最近一年使用:0次
名校
解题方法
4 . 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。 请回答下列问题。
(1)某同学做如下实验,以检验反应中的能量变化。___________ 热反应;(b)中温度降低,由此可以判断(b)中反应是___________ 热反应。
②写出铝与盐酸反应的离子方程式___________ 。
③根据能量守恒定律,(b)中反应物的总能量应该___________ 其生成物的总能量。(填“大于”、“小于”、“等于”)
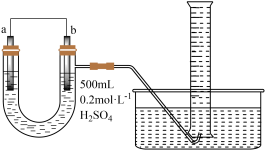
(2)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
①当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为___________ ,当电路中有0.2mol电子通过时,负极的质量减少___________ g。
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置___________ (填“能”或“不能”)形成原电池。
③将锌片和银片浸入硫酸铜溶液中组成原电池,两电极间连接一个电流表。
锌片上发生的电极反应为___________ ;
银片上发生的电极反应为___________ 。
(1)某同学做如下实验,以检验反应中的能量变化。
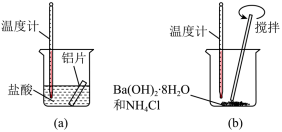
②写出铝与盐酸反应的离子方程式
③根据能量守恒定律,(b)中反应物的总能量应该
(2)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
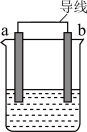
①当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置
③将锌片和银片浸入硫酸铜溶液中组成原电池,两电极间连接一个电流表。
锌片上发生的电极反应为
银片上发生的电极反应为
您最近一年使用:0次
名校
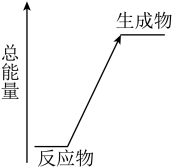
5 . 化学反应同时伴随着能量变化,是人类获取能量的重要途径。以下是常见的化学反应,回答(1)和(2)。 晶体与
晶体与 晶体反应
晶体反应
c.氢氧化钠与盐酸反应 d.盐酸与碳酸氢钠反应
(1)以上化学反应中能用上图表示其能量变化的是______ (填字母),此类反应中有能量变化的原因是:断开反应物的化学键吸收的总能量______ (填“>”或“<”)形成生成物的化学键释放的总能量。
(2)从以上反应中选择一个反应设计原电池。
①将如图原电池装置补充完整______ 。
②证实化学能转化为电能的实验现象是______ .
③正极的电极反应式是______ .______ .
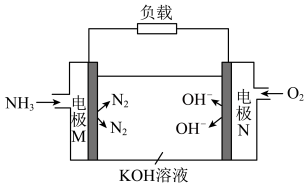
(4) 还原
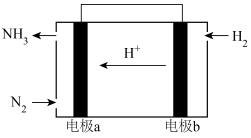
还原 电化学法制备
电化学法制备 (甲醇)的工作原理如图所示。通入
(甲醇)的工作原理如图所示。通入 的一端是电池的
的一端是电池的______ 极(填“正”或“负”),通入 的一端发生的电极反应式为
的一端发生的电极反应式为______ 。生成 甲醇时,转移
甲醇时,转移______  电子。
电子。
 晶体与
晶体与 晶体反应
晶体反应c.氢氧化钠与盐酸反应 d.盐酸与碳酸氢钠反应
(1)以上化学反应中能用上图表示其能量变化的是
(2)从以上反应中选择一个反应设计原电池。
①将如图原电池装置补充完整
②证实化学能转化为电能的实验现象是
③正极的电极反应式是
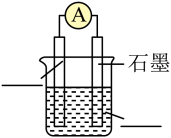
(4)
 还原
还原 电化学法制备
电化学法制备 (甲醇)的工作原理如图所示。通入
(甲醇)的工作原理如图所示。通入 的一端是电池的
的一端是电池的 的一端发生的电极反应式为
的一端发生的电极反应式为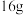 甲醇时,转移
甲醇时,转移 电子。
电子。
您最近一年使用:0次
名校
解题方法
6 . 研究化学能与热能、电能的转化具有重要价值。回答下列问题:
(1)下列化学反应过程中的能量变化符合图示的是___________ (填序号)。
①酸碱中和反应 ②碳酸钙分解 ③金属钠与水反应 ④酒精燃烧 ⑤灼热的碳与二氧化碳反应 ⑥ 与
与 反应
反应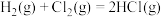 的反应过程如图所示:
的反应过程如图所示: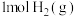 和
和 充分反应,则反应物中旧键断裂共吸收
充分反应,则反应物中旧键断裂共吸收___________ kJ能量,生成物中新键形成共放出___________ kJ能量,该反应为___________ (填“吸热”或“放热”)反应。
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(3)现有如下两个反应:A ;B.
;B.  ,判断上述两个反应中能设计成原电池的是
,判断上述两个反应中能设计成原电池的是___________ (填“A”或“B”)。
(4)将纯锌片和纯铜片按图中方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:___________ 。
A 甲、乙均为化学能转变为电能的装置 B. 乙中铜片上没有明显变化
C. 甲中铜片质量减少、乙中锌片质量减少 D. 两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲___________ 乙(填“>”“<”或“=”)。
③请写出图中构成原电池的负极电极反应式:___________ 。
(5)若利用反应 设计一个原电池,请完善实验装置,负极材料:
设计一个原电池,请完善实验装置,负极材料:___________ ;正极材料:___________ ;电解质溶液:___________ 。
__________________ ___________ 。
(1)下列化学反应过程中的能量变化符合图示的是
①酸碱中和反应 ②碳酸钙分解 ③金属钠与水反应 ④酒精燃烧 ⑤灼热的碳与二氧化碳反应 ⑥
 与
与 反应
反应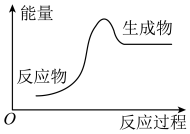
 的反应过程如图所示:
的反应过程如图所示: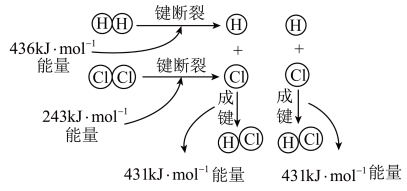
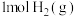 和
和 充分反应,则反应物中旧键断裂共吸收
充分反应,则反应物中旧键断裂共吸收原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(3)现有如下两个反应:A
 ;B.
;B.  ,判断上述两个反应中能设计成原电池的是
,判断上述两个反应中能设计成原电池的是(4)将纯锌片和纯铜片按图中方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
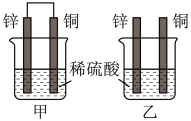
A 甲、乙均为化学能转变为电能的装置 B. 乙中铜片上没有明显变化
C. 甲中铜片质量减少、乙中锌片质量减少 D. 两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲
③请写出图中构成原电池的负极电极反应式:
(5)若利用反应
 设计一个原电池,请完善实验装置,负极材料:
设计一个原电池,请完善实验装置,负极材料: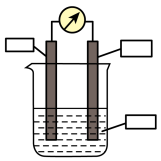
您最近一年使用:0次
2024-05-07更新
|
58次组卷
|
2卷引用:新疆乌鲁木齐市第十一中学2023-2024学年高一下学期期中测试化学试卷
7 . 人类利用化学反应不仅可以创造新物质,还可以获取能量或实现不同形式能量之间的转化。回答下列问题:
(1)冷敷袋俗称冰袋,在日常生活中有降温、保鲜和镇痛等多种用途。制作冷敷袋可以利用___________ (填标号)。
a.吸热的物理变化 b.放热的物理变化 c.吸热的化学变化 d.放热的化学变化
(2)氨气是重要的化工原料,工业合成氨反应: 。已知在25℃、
。已知在25℃、 时,拆开
时,拆开 键、
键、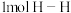 键和
键和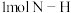 键所需能量分别为
键所需能量分别为 和
和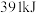 。
。
①根据上述数据判断,合成氨的反应是___________ 反应(填“吸热”或“放热”)。
②每消耗 ,反应放出或吸收的热量
,反应放出或吸收的热量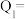
___________  。
。
③将 和
和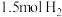 充入密闭容器中,在相同条件下发生该反应,达平衡时,放出或吸收的热量为
充入密闭容器中,在相同条件下发生该反应,达平衡时,放出或吸收的热量为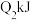 ,则
,则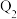
___________  (填“>”“<”或“=”),理由是
(填“>”“<”或“=”),理由是___________ 。
(3)饮用水中的 对人类健康产生危害,为了降低饮用水中
对人类健康产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 。补充完整下列化学方程式
。补充完整下列化学方程式_______ 。
___________ ___________
___________ ___________
___________ ___________+___________
___________+___________ ___________
___________
(4)从旧CPU中回收金部分流程如下。 、氯金酸、金元素的化合价为
、氯金酸、金元素的化合价为 )
)
若用 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量是
的物质的量是___________ 。
(5)明矾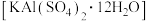 可用于净水。往明矾溶液中逐滴滴加
可用于净水。往明矾溶液中逐滴滴加 溶液,若使
溶液,若使 恰好完全沉淀,发生反应的离子方程式为
恰好完全沉淀,发生反应的离子方程式为___________ 。
(6)彩漂剂的主要成分是双氧水,使用时会释放出一种无色无味的气体,使污垢活化,易于洗涤。但是不能长期存放,会降低彩漂效果,则发生的反应的还原产物为___________ (写化学式)。
(1)冷敷袋俗称冰袋,在日常生活中有降温、保鲜和镇痛等多种用途。制作冷敷袋可以利用
a.吸热的物理变化 b.放热的物理变化 c.吸热的化学变化 d.放热的化学变化
(2)氨气是重要的化工原料,工业合成氨反应:
 。已知在25℃、
。已知在25℃、 时,拆开
时,拆开 键、
键、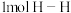 键和
键和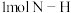 键所需能量分别为
键所需能量分别为 和
和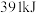 。
。①根据上述数据判断,合成氨的反应是
②每消耗
 ,反应放出或吸收的热量
,反应放出或吸收的热量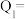
 。
。③将
 和
和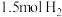 充入密闭容器中,在相同条件下发生该反应,达平衡时,放出或吸收的热量为
充入密闭容器中,在相同条件下发生该反应,达平衡时,放出或吸收的热量为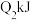 ,则
,则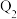
 (填“>”“<”或“=”),理由是
(填“>”“<”或“=”),理由是(3)饮用水中的
 对人类健康产生危害,为了降低饮用水中
对人类健康产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 。补充完整下列化学方程式
。补充完整下列化学方程式___________
 ___________
___________ ___________
___________ ___________+___________
___________+___________ ___________
___________
(4)从旧CPU中回收金部分流程如下。

 、氯金酸、金元素的化合价为
、氯金酸、金元素的化合价为 )
)若用
 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量是
的物质的量是(5)明矾
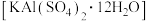 可用于净水。往明矾溶液中逐滴滴加
可用于净水。往明矾溶液中逐滴滴加 溶液,若使
溶液,若使 恰好完全沉淀,发生反应的离子方程式为
恰好完全沉淀,发生反应的离子方程式为(6)彩漂剂的主要成分是双氧水,使用时会释放出一种无色无味的气体,使污垢活化,易于洗涤。但是不能长期存放,会降低彩漂效果,则发生的反应的还原产物为
您最近一年使用:0次
名校
解题方法
8 . 化学反应中的能量和速率变化对生产生活有着重要意义。某研究学习小组进行下列探究。
(1)甲同学探究反应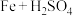 (稀)
(稀)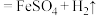 中的能量变化。向装有铁片的试管中加入
中的能量变化。向装有铁片的试管中加入 的
的 ,观察到试管内有气泡产生,触摸试管外壁,温度升高。
,观察到试管内有气泡产生,触摸试管外壁,温度升高。
①该反应为___________ (填“放热”或“吸热”)反应。
②该反应反应物的总能量___________ (填“>”或“<”)生成物的总能量。
(2)乙同学认为原电池原理也可加快化学反应速率,他设计如图所示实验装置。铁片上的电极反应式为___________ ,溶液中 浓度
浓度___________ (填“增大”、“减小”或“不变”)。___________ (填序号)。
①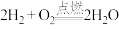 ;②
;② ;③
;③
(1)甲同学探究反应
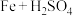 (稀)
(稀)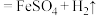 中的能量变化。向装有铁片的试管中加入
中的能量变化。向装有铁片的试管中加入 的
的 ,观察到试管内有气泡产生,触摸试管外壁,温度升高。
,观察到试管内有气泡产生,触摸试管外壁,温度升高。①该反应为
②该反应反应物的总能量
(2)乙同学认为原电池原理也可加快化学反应速率,他设计如图所示实验装置。铁片上的电极反应式为
 浓度
浓度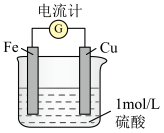
①
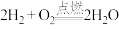 ;②
;② ;③
;③
您最近一年使用:0次
2024-05-06更新
|
71次组卷
|
2卷引用:湖南省长沙市德成学校2023-2024学年高一下学期4月月考化学试题
名校
解题方法
9 . 任何化学反应都伴随着能量的变化,化学能可转化为热能、电能等。回答下列有关问题:
(1)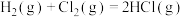 的反应过程如图所示:
的反应过程如图所示:___________ (填“放热”或“吸热”)反应,生成2molHCl(g)吸收或放出的热量为___________ 。
(2)下列变化中属于吸热反应的是___________ (填标号)。
①液态水汽化 ②生石灰与水反应
③ ④
④ 与固体
与固体 混合
混合
(3)用如图装置推算铜锌原电池工作时产生的电流量。供选择的电极材料有纯铜片和纯锌片。则 a 电极的电极反应式为___________ ,当量筒中收集到 336mL(标准状况下)气体时,通过导线的电子的物质的量为___________ 。___________ 极(填“正”或“负”)。___________ (填“①”或“②”)该装置中的正极的电极反应式为___________ ;电子从___________ (填电极材料)流向___________ (填电极材料)
(1)
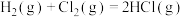 的反应过程如图所示:
的反应过程如图所示: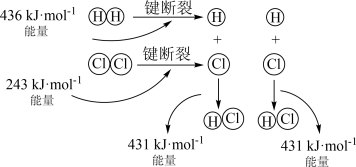
(2)下列变化中属于吸热反应的是
①液态水汽化 ②生石灰与水反应
③
 ④
④ 与固体
与固体 混合
混合(3)用如图装置推算铜锌原电池工作时产生的电流量。供选择的电极材料有纯铜片和纯锌片。则 a 电极的电极反应式为
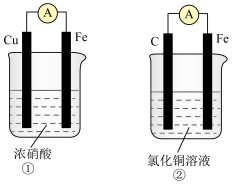
您最近一年使用:0次
名校
解题方法
10 . Ⅰ.断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B的键能。下表列出了一些化学键的键能(E):
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应_______ (填“吸收”或“放出”)_______ kJ能量(用含有a、b的关系式表示)。 O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=
O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=_______ 。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为_______ 。
Ⅱ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
(4)该实验探究的是_______ 因素对化学反应速率的影响。如下图一,相同时间内针筒中所得的CO2体积大小关系是_______ (填实验序号)。 =
=_______ (假设混合液体积为50mL)。
(6)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定_______ 来比较化学反应速率。
(7)小组同学发现反应速率总是如上图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②_______ 。
| 化学键 | H—H | Cl—Cl | O=O | C—Cl | C—H | O—H | H—Cl |
| E/(kJ·mol-1) | 436 | 247 | x | 330 | 413 | 463 | 431 |
(1)如图表示某反应的能量变化关系,则此反应
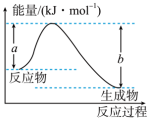
 O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=
O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为
Ⅱ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.1 mol·L-1KMnO4溶液 |
| ② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.1mol·L-1KMnO4溶液 |
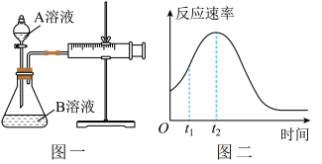
 =
=(6)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定
(7)小组同学发现反应速率总是如上图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②
您最近一年使用:0次
2024-04-25更新
|
226次组卷
|
2卷引用:广东省汕头市潮阳第一中学2023-2024学年高一下学期4月期中考试化学试题



