名校
解题方法
1 . 科学家成功捕获并表征到水氧化催化过程中的锰端基氧和锰过氧化物中间体,明确了水氧化过程中水亲核进攻锰端基氧的氧氧成键机理,如图所示。下列说法错误的是
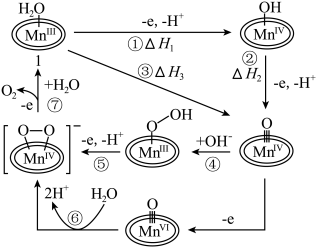
A.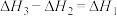 |
B. 中O的化合价为-1价 中O的化合价为-1价 |
C.水氧化的总反应为 |
D.过程⑦可表示为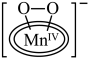 +H2O +H2O O2↑+ O2↑+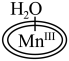 |
您最近半年使用:0次
名校
解题方法
2 . 甲醇是一种清洁能源,以甲醇为原料制备水煤气的原理为CH3OH(g) CO(g)+2H2(g)。
CO(g)+2H2(g)。
(1)已知:CH3OH(g)+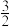 O2(g)=CO2(g)+2H2O(1) △H1=-726.5kJ/mol
O2(g)=CO2(g)+2H2O(1) △H1=-726.5kJ/mol
CO(g)+ O2(g)=CO2(g) △H2=-283kJ/mol
O2(g)=CO2(g) △H2=-283kJ/mol
H2(g)+ O2(g)=H2O(1) △H3=-285.8kJ/mol
O2(g)=H2O(1) △H3=-285.8kJ/mol
则制备水煤气的反应CH3OH(g) CO(g)+2H2(g)的△H=
CO(g)+2H2(g)的△H=________ kJ/mol。
(2)一定温度下维持100kPa,将CH3OH (g)与Ar(g)以一定比例投料发生上述反应[投料比x= ]测得CH3OH(g)的平衡转化率及H2的分压p(H2)随x的关系如图所示。已知:Kp为用气体分压表示的平衡常数,分压=总压×物质的量分数。
]测得CH3OH(g)的平衡转化率及H2的分压p(H2)随x的关系如图所示。已知:Kp为用气体分压表示的平衡常数,分压=总压×物质的量分数。_______ (填“A”或“B”),判断理由是______________ 。
②当x=1时,CH3OH(g)的平衡转化率为______ %(结果保留1位小数),该反应的压强平衡常数Kp=_______ (kPa)2。
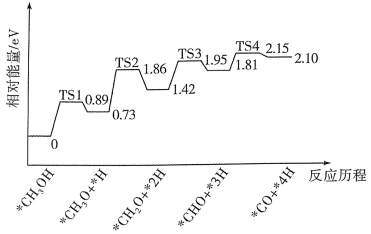
(3)CH3OH(g)在催化剂 Pd/MgO表面的催化反应机理,其部分反应历程如图所示,吸附在催化剂表面的物种用*表示,过渡态用TS表示。历程中______ (填“有”或“无”)C-О键的断裂,决定反应速率的步骤的化学方程式为_________________ 。
 CO(g)+2H2(g)。
CO(g)+2H2(g)。(1)已知:CH3OH(g)+
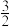 O2(g)=CO2(g)+2H2O(1) △H1=-726.5kJ/mol
O2(g)=CO2(g)+2H2O(1) △H1=-726.5kJ/molCO(g)+
 O2(g)=CO2(g) △H2=-283kJ/mol
O2(g)=CO2(g) △H2=-283kJ/molH2(g)+
 O2(g)=H2O(1) △H3=-285.8kJ/mol
O2(g)=H2O(1) △H3=-285.8kJ/mol则制备水煤气的反应CH3OH(g)
 CO(g)+2H2(g)的△H=
CO(g)+2H2(g)的△H=(2)一定温度下维持100kPa,将CH3OH (g)与Ar(g)以一定比例投料发生上述反应[投料比x=
 ]测得CH3OH(g)的平衡转化率及H2的分压p(H2)随x的关系如图所示。已知:Kp为用气体分压表示的平衡常数,分压=总压×物质的量分数。
]测得CH3OH(g)的平衡转化率及H2的分压p(H2)随x的关系如图所示。已知:Kp为用气体分压表示的平衡常数,分压=总压×物质的量分数。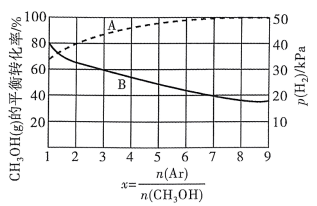
②当x=1时,CH3OH(g)的平衡转化率为
(3)CH3OH(g)在催化剂 Pd/MgO表面的催化反应机理,其部分反应历程如图所示,吸附在催化剂表面的物种用*表示,过渡态用TS表示。历程中
您最近半年使用:0次
3 . 某团队报道了高温富水环境下,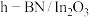 催化丙烷氧化脱氢原理,涉及反应如下:
催化丙烷氧化脱氢原理,涉及反应如下:
i.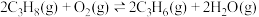
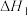
ii.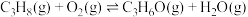
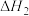
回答下列问题:
(1)上述反应过程中涉及的C、N、O元素可以组成多种配体,如CO、 、
、 等,CO、
等,CO、 的配位原子是C,而
的配位原子是C,而 的配位原子是N,简述其原因
的配位原子是N,简述其原因___________ 。
(2)已知:丙烷、丙烯的燃烧热分别为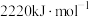 、
、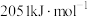 。18g液态水变为
。18g液态水变为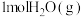 吸收热量44kJ。则
吸收热量44kJ。则
___________  。下列关于反应i自发性判断正确的是
。下列关于反应i自发性判断正确的是___________ (填标号)。
A.任何温度都能自发进行 B.任何温度都不能自发进行
C.在较高温度下能自发进行 D.在较低温度下能自发进行
(3)已知反应i速率方程为 (k为速率常数只与温度、催化剂有关;α、β、γ、δ为反应级数,可以为正数、负数或分数)。
(k为速率常数只与温度、催化剂有关;α、β、γ、δ为反应级数,可以为正数、负数或分数)。
①一定温度下,反应速率与浓度( )关系如下表所示:
)关系如下表所示:
根据数据计算,α+β+γ+δ=___________ 。
②速率常数与温度、活化能关系式为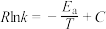 (R、C为常数,T为温度,
(R、C为常数,T为温度, 为活化能且不随温度变化而变化)。在不同催化剂Cat1、Cat2作用下,Ink与
为活化能且不随温度变化而变化)。在不同催化剂Cat1、Cat2作用下,Ink与 关系如图:
关系如图:___________ (填“Cat1”或“Cat2”)。
(4)在密闭容器中充入 和
和 ,仅发生上述反应i和ii,测得丙烷的平衡转化率与温度、压强关系如图所示:
,仅发生上述反应i和ii,测得丙烷的平衡转化率与温度、压强关系如图所示:___________ 。
② 下,A点丙烯的选择性为80%(选择性等于丙烯的物质的量与丙烷转化的总物质的量之比)。B点时,反应ii的压强平衡常数
下,A点丙烯的选择性为80%(选择性等于丙烯的物质的量与丙烷转化的总物质的量之比)。B点时,反应ii的压强平衡常数
___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)在熔融碳酸钠中,丙烷-空气燃料电池的放电效率高。该燃料电池放电时,负极的电极反应式为___________ 。
 催化丙烷氧化脱氢原理,涉及反应如下:
催化丙烷氧化脱氢原理,涉及反应如下:i.
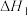
ii.
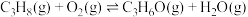
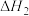
回答下列问题:
(1)上述反应过程中涉及的C、N、O元素可以组成多种配体,如CO、
 、
、 等,CO、
等,CO、 的配位原子是C,而
的配位原子是C,而 的配位原子是N,简述其原因
的配位原子是N,简述其原因(2)已知:丙烷、丙烯的燃烧热分别为
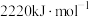 、
、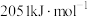 。18g液态水变为
。18g液态水变为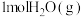 吸收热量44kJ。则
吸收热量44kJ。则
 。下列关于反应i自发性判断正确的是
。下列关于反应i自发性判断正确的是A.任何温度都能自发进行 B.任何温度都不能自发进行
C.在较高温度下能自发进行 D.在较低温度下能自发进行
(3)已知反应i速率方程为
 (k为速率常数只与温度、催化剂有关;α、β、γ、δ为反应级数,可以为正数、负数或分数)。
(k为速率常数只与温度、催化剂有关;α、β、γ、δ为反应级数,可以为正数、负数或分数)。①一定温度下,反应速率与浓度(
 )关系如下表所示:
)关系如下表所示:| 序号 |  | 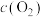 | 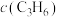 | 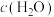 | v |
| Ⅰ | 0.1 | 0.1 | 0.1 | 0.1 | k |
| Ⅱ | 0.2 | 0.1 | 0.1 | 0.1 | 4k |
| Ⅲ | 0.2 | 0.4 | 0.1 | 0.1 | 8k |
| Ⅳ | 0.4 | 0.1 | 0.2 | 0.1 | 8k |
| Ⅴ | 0.4 | 0.4 | 0.1 | 0.2 | 16k |
②速率常数与温度、活化能关系式为
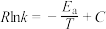 (R、C为常数,T为温度,
(R、C为常数,T为温度, 为活化能且不随温度变化而变化)。在不同催化剂Cat1、Cat2作用下,Ink与
为活化能且不随温度变化而变化)。在不同催化剂Cat1、Cat2作用下,Ink与 关系如图:
关系如图: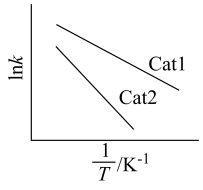
(4)在密闭容器中充入
 和
和 ,仅发生上述反应i和ii,测得丙烷的平衡转化率与温度、压强关系如图所示:
,仅发生上述反应i和ii,测得丙烷的平衡转化率与温度、压强关系如图所示: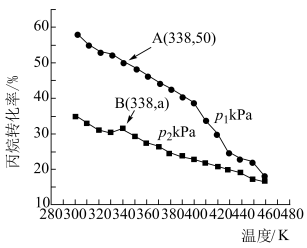
②
 下,A点丙烯的选择性为80%(选择性等于丙烯的物质的量与丙烷转化的总物质的量之比)。B点时,反应ii的压强平衡常数
下,A点丙烯的选择性为80%(选择性等于丙烯的物质的量与丙烷转化的总物质的量之比)。B点时,反应ii的压强平衡常数
(5)在熔融碳酸钠中,丙烷-空气燃料电池的放电效率高。该燃料电池放电时,负极的电极反应式为
您最近半年使用:0次
解题方法
4 . 科学家在寻求将太阳能转化成化学能的办法,其中办法之一就是利用太阳能将 分解成
分解成 ,再将化学能转化为其他能源。右图是有关的能量循环示意图(已知:H-H键的键能为a
,再将化学能转化为其他能源。右图是有关的能量循环示意图(已知:H-H键的键能为a  ,O—O键的键能为b
,O—O键的键能为b  )。下列有关说法正确的是
)。下列有关说法正确的是
 分解成
分解成 ,再将化学能转化为其他能源。右图是有关的能量循环示意图(已知:H-H键的键能为a
,再将化学能转化为其他能源。右图是有关的能量循环示意图(已知:H-H键的键能为a  ,O—O键的键能为b
,O—O键的键能为b  )。下列有关说法正确的是
)。下列有关说法正确的是
A.图中 |
B.断开1mol H—O键所需要的太阳能为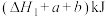 |
C.1mol  燃烧生成液态水的能量变化为 燃烧生成液态水的能量变化为 |
D.水蒸气所具有的能量比液态水多 kJ kJ |
您最近半年使用:0次
名校
5 . 各相关物质的燃烧热数据如下表。下列热化学方程式正确的是
| 物质 | 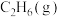 | 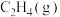 |  |
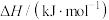 | 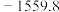 | 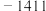 |  |
A.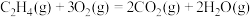 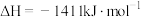 |
B.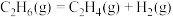 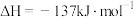 |
C.2H2O(l)=2H2(g)+O2(g) 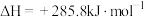 |
D.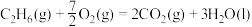  |
您最近半年使用:0次
名校
6 . 某温度下,利用CO2生产甲醇主要涉及以下两个反应。
反应I._______
反应Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
回答下列问题:
(1)已知CO(g)+2H2(g) CH3OH(g) ΔH3=–90.6kJ·mol-1。反应I的转化原理如图所示。该反应的热化学方程式为
CH3OH(g) ΔH3=–90.6kJ·mol-1。反应I的转化原理如图所示。该反应的热化学方程式为_______ ,在_______ 条件下反应I可自发发生。_______ 移动(填“正向”、“逆向”或“不”)。
(3)将1molCO2(g)和3molH2(g)充入密闭容器发生反应I和Ⅱ,并达到平衡状态。相同温度下,在不同压强下测得CO2的平衡转化率、CH3OH(g)的选择性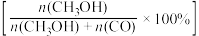 和CO的选择性
和CO的选择性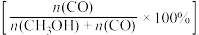 随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是
随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是_______ (填“m”、“n”或“p”),A点时H2的转化率为_______ ,CH3OH的平衡分压为_______ MPa(保留两位有效数字)。 ,式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示各组分的物质的量分数。Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp
,式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示各组分的物质的量分数。Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp_______ (填“增大”、“减小”或“不变”)。根据速率方程分析,T>Tm时v逐渐减小的原因是_______ 。
反应I._______
反应Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
回答下列问题:
(1)已知CO(g)+2H2(g)
 CH3OH(g) ΔH3=–90.6kJ·mol-1。反应I的转化原理如图所示。该反应的热化学方程式为
CH3OH(g) ΔH3=–90.6kJ·mol-1。反应I的转化原理如图所示。该反应的热化学方程式为
(3)将1molCO2(g)和3molH2(g)充入密闭容器发生反应I和Ⅱ,并达到平衡状态。相同温度下,在不同压强下测得CO2的平衡转化率、CH3OH(g)的选择性
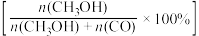 和CO的选择性
和CO的选择性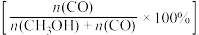 随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是
随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是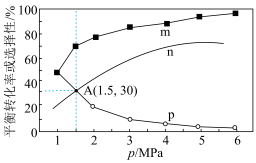
 ,式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示各组分的物质的量分数。Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp
,式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示各组分的物质的量分数。Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp
您最近半年使用:0次
7 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和.研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点.以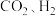 为原料合成甲醇
为原料合成甲醇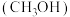 的过程主要涉及以下反应:
的过程主要涉及以下反应:
反应Ⅰ: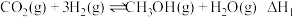
反应Ⅱ:
反应Ⅲ:
(1)根据盖斯定律,反应Ⅰ的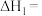
_____________ 。
(2)一定条件下, 的反应历程如图1所示.该反应的反应速率由第
的反应历程如图1所示.该反应的反应速率由第__________ (填“1”或“2”)步决定。 固定容积的密闭容器中,通入
固定容积的密闭容器中,通入 和
和 ,发生反应
,发生反应 ,测得
,测得 和
和 的浓度随时间变化如图2所示。
的浓度随时间变化如图2所示。_____________ (填标号)。
A. 的体积分数在混合气体中保持不变
的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗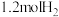 ,同时消耗
,同时消耗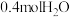
D.反应中 与
与 的物质的量浓度之比为
的物质的量浓度之比为 ,且保持不变
,且保持不变
②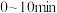 ,用
,用 的浓度变化表示平均反应速率
的浓度变化表示平均反应速率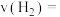
_____________  ;
;
③计算该温度下此反应的平衡常数
_____________  (保留两位有效数字);
(保留两位有效数字);
(4)将 设计成双液电池,正极烧杯中盛放的溶液为
设计成双液电池,正极烧杯中盛放的溶液为_____ ,电池负极的电极反应式为_____________ ;
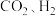 为原料合成甲醇
为原料合成甲醇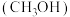 的过程主要涉及以下反应:
的过程主要涉及以下反应:反应Ⅰ:
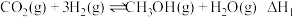
反应Ⅱ:

反应Ⅲ:

(1)根据盖斯定律,反应Ⅰ的
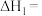
(2)一定条件下,
 的反应历程如图1所示.该反应的反应速率由第
的反应历程如图1所示.该反应的反应速率由第
 固定容积的密闭容器中,通入
固定容积的密闭容器中,通入 和
和 ,发生反应
,发生反应 ,测得
,测得 和
和 的浓度随时间变化如图2所示。
的浓度随时间变化如图2所示。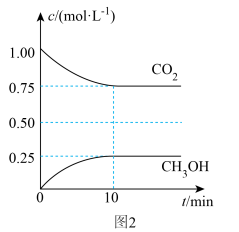
A.
 的体积分数在混合气体中保持不变
的体积分数在混合气体中保持不变B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗
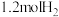 ,同时消耗
,同时消耗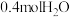
D.反应中
 与
与 的物质的量浓度之比为
的物质的量浓度之比为 ,且保持不变
,且保持不变②
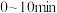 ,用
,用 的浓度变化表示平均反应速率
的浓度变化表示平均反应速率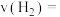
 ;
;③计算该温度下此反应的平衡常数

 (保留两位有效数字);
(保留两位有效数字);(4)将
 设计成双液电池,正极烧杯中盛放的溶液为
设计成双液电池,正极烧杯中盛放的溶液为
您最近半年使用:0次
2024高三下·全国·专题练习
8 . 二氧化碳的综合利用具有重要意义。
(1)工业上以 和
和 为原料可以制取合成气(
为原料可以制取合成气( 和
和 )。
)。
①已知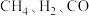 的燃烧热分别为
的燃烧热分别为 ,则反应
,则反应 的
的
___________ 。
(1)工业上以
 和
和 为原料可以制取合成气(
为原料可以制取合成气( 和
和 )。
)。①已知
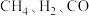 的燃烧热分别为
的燃烧热分别为 ,则反应
,则反应 的
的
您最近半年使用:0次
名校
9 . 氢能是一种绿色能源,研发新型制氢技术具有重要意义。
(1)甘油 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
反应I: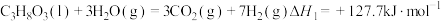
反应Ⅱ: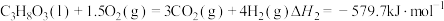
①
___________ 。
②除 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是___________ 。
(2)“表面改性铝粉分解水制氢”因 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠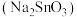 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。
①利用 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为___________ 。
② 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积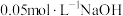 溶液和
溶液和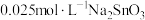 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是___________ 。 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为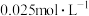 时,氢气产率接近
时,氢气产率接近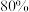 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是___________ 。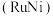 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用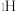 、
、 和
和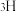 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为___________ ;步骤Ⅱ可描述为___________ 。
(1)甘油
 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:反应I:
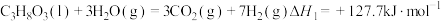
反应Ⅱ:
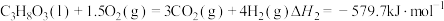
①

②除
 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是(2)“表面改性铝粉分解水制氢”因
 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠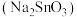 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。①利用
 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为②
 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积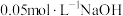 溶液和
溶液和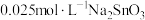 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是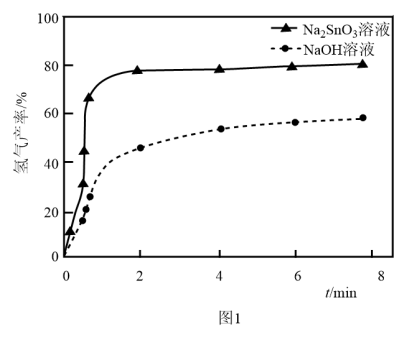
 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为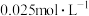 时,氢气产率接近
时,氢气产率接近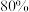 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是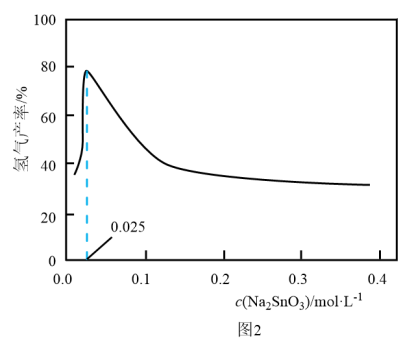
 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用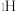 、
、 和
和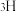 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为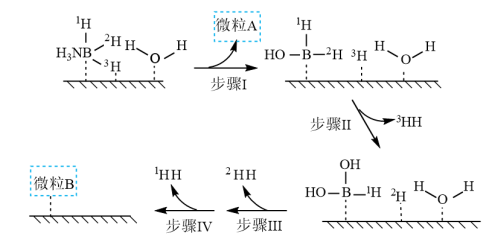
您最近半年使用:0次
解题方法
10 . 甲醇和乙醇都是清洁能源,也是重要的化工原料。回答下列问题:
(1)工业上利用合成气合成甲醇: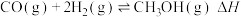
已知:① ;
;
②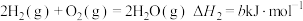 ;
;
③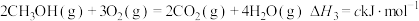
上述反应中的
___________  。
。
(2)一定温度下,在恒容密闭容器中充入1molCO和1molH2,在固体催化剂作用下合成甲醇: ,下列叙述错误的是___________(填字母)。
,下列叙述错误的是___________(填字母)。
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢: ,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。___________ 下(高温、低温、任意温度)自发进行;图示历程包括___________ 个基元反应;其中决速反应是反应___________ (填序号),写出该步反应式:___________ 。
(4)工业上,可以采用CO2催化还原制备CH3OH、CH3CH2OH.发生反应如下:
① (主反应);
(主反应);
② (主反应);
(主反应);
③ (副反应)。
(副反应)。
一定温度下,在甲、乙体积相同的反应容器中分别充入1molCO2和3molH2,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得CO2平衡转化率与压强关系如图b所示。其他条件相同,增大压强,CO2平衡转化率增大,其原因是___________ ;采用水分子膜分离技术的容器是___________ (填“甲”或“乙”)。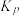 为
为___________  。(写出数字表达式即可,分压=总压×物质的量分数)
。(写出数字表达式即可,分压=总压×物质的量分数)
(1)工业上利用合成气合成甲醇:
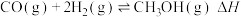
已知:①
 ;
;②
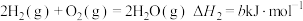 ;
;③
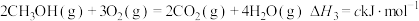
上述反应中的

 。
。(2)一定温度下,在恒容密闭容器中充入1molCO和1molH2,在固体催化剂作用下合成甲醇:
 ,下列叙述错误的是___________(填字母)。
,下列叙述错误的是___________(填字母)。| A.当CO体积分数不变时达到平衡状态 |
| B.平衡后充入少量氩气,平衡不移动 |
| C.平衡后再充入0.1molCO和0.1molH2,CO平衡转化率增大 |
| D.增大催化剂质量,正、逆反应速率同倍数增大 |
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢:
 ,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
(4)工业上,可以采用CO2催化还原制备CH3OH、CH3CH2OH.发生反应如下:
①
 (主反应);
(主反应);②
 (主反应);
(主反应);③
 (副反应)。
(副反应)。一定温度下,在甲、乙体积相同的反应容器中分别充入1molCO2和3molH2,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得CO2平衡转化率与压强关系如图b所示。其他条件相同,增大压强,CO2平衡转化率增大,其原因是
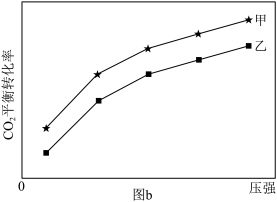
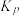 为
为 。(写出数字表达式即可,分压=总压×物质的量分数)
。(写出数字表达式即可,分压=总压×物质的量分数)
您最近半年使用:0次



