1 . 拟用如图装置设计实验来探究纯净、干燥的氯气与氨气的反应。___________ 。
(2)如图中的装置连接顺序为A→___________ (用大写字母表示)。若按照正确顺序连接实验装置后,整套实验装置存在的主要缺点___________ 。
(3)写出F装置中的反应的一种工业用途:___________ 。
(4)在工业上利用反应N2+3H2 2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是
2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是___________ (填字母)。
A.v(NH3)=0.1mol/(L·min) B.v(H2)=0.6mol/(L·min) C.v(N2)=0.3mol/(L·min)

(2)如图中的装置连接顺序为A→
(3)写出F装置中的反应的一种工业用途:
(4)在工业上利用反应N2+3H2
 2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是
2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是A.v(NH3)=0.1mol/(L·min) B.v(H2)=0.6mol/(L·min) C.v(N2)=0.3mol/(L·min)
您最近半年使用:0次
名校
2 . 已知反应: ,其浓度数据如下:
,其浓度数据如下:

当用Y浓度的减少来表示该化学反应的速率时,其速率为
 ,其浓度数据如下:
,其浓度数据如下:
当用Y浓度的减少来表示该化学反应的速率时,其速率为
A.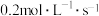 | B.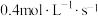 |
C.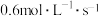 | D. |
您最近半年使用:0次
7日内更新
|
49次组卷
|
2卷引用:云南省临沧市沧源佤族自治县民族中学2022-2023学年高二上学期第二次月考化学试题
名校
3 .  在金表面分解的实验数据如下表。已知反应物消耗一半所需的时间
在金表面分解的实验数据如下表。已知反应物消耗一半所需的时间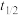 称为半衰期。下列说法错误的是
称为半衰期。下列说法错误的是
 在金表面分解的实验数据如下表。已知反应物消耗一半所需的时间
在金表面分解的实验数据如下表。已知反应物消耗一半所需的时间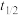 称为半衰期。下列说法错误的是
称为半衰期。下列说法错误的是 | 0 | 20 | 40 | 60 | 80 |
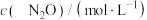 |  | 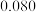 | 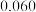 | 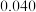 |  |
A. 消耗一半时的反应速率为 消耗一半时的反应速率为 |
B.100min时 消耗完全 消耗完全 |
C.该反应的速率与 的浓度有关 的浓度有关 |
D.该反应的半衰期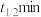 与起始浓度 与起始浓度 的关系满足 的关系满足 |
您最近半年使用:0次
7日内更新
|
133次组卷
|
3卷引用:东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题
4 . 丙酮的溴代反应(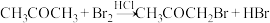 )的速率方程为:
)的速率方程为: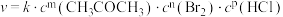 ,其中k为速率常数,与温度有关;“
,其中k为速率常数,与温度有关;“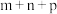 ”为反应级数。某温度时,获得如下实验数据:
”为反应级数。某温度时,获得如下实验数据:
分析该组实验数据所得出的结论错误的是
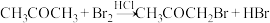 )的速率方程为:
)的速率方程为: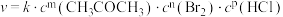 ,其中k为速率常数,与温度有关;“
,其中k为速率常数,与温度有关;“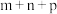 ”为反应级数。某温度时,获得如下实验数据:
”为反应级数。某温度时,获得如下实验数据:| 实验序号 | 初始浓度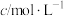 | 溴颜色消失所需时间t/s | ||
 | HCl |  | ||
| ① | 0.80 | 0.20 | 0.0010 | 200 |
| ② | 1.60 | 0.20 | 0.0010 | 100 |
| ③ | 0.80 | 0.40 | 0.0010 | 100 |
| ④ | 0.80 | 0.20 | 0.0020 | 400 |
A.增大 ,能延长溶液颜色消失的时间 ,能延长溶液颜色消失的时间 |
| B.实验②和③的平均速率相等 |
C.实验①在200s内的平均速率 |
| D.反应级数为2 |
您最近半年使用:0次
解题方法
5 . 反应4A(s)+3B(g)=2C(g)+D(g),经 ,B的浓度减少
,B的浓度减少 。对该反应速率的表示,下列说法正确的是
。对该反应速率的表示,下列说法正确的是
 ,B的浓度减少
,B的浓度减少 。对该反应速率的表示,下列说法正确的是
。对该反应速率的表示,下列说法正确的是A.用A表示的反应速率是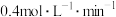 |
| B.用B、C 、D表示的反应速率之比为3∶2∶1 |
C.在 末,用B表示的反应速率是 末,用B表示的反应速率是 |
D.在 内用B表示的反应速率逐渐减小,用C表示的反应速率逐渐增大 内用B表示的反应速率逐渐减小,用C表示的反应速率逐渐增大 |
您最近半年使用:0次
2024-04-13更新
|
1285次组卷
|
4卷引用:广东清远一中实验学校2020-2021学年高二上学期备战期中定时检测化学试卷
名校
解题方法
6 . 汽车尾气中含有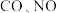 等有害气体。
等有害气体。
(1)汽车尾气中 生成过程的能量变化示意图如图:
生成过程的能量变化示意图如图:___________ 。
(2)利用催化技术可将汽车尾气中的 和
和 转化为
转化为 和
和 。
。
①该反应的化学方程式为___________ 。
②某温度下,在 的密闭容器中通入
的密闭容器中通入 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:
用 的浓度变化表示反应由开始到
的浓度变化表示反应由开始到 时的平均反应速率为
时的平均反应速率为___________  ;若恒温下保持起始投料量相同,容器体积变为
;若恒温下保持起始投料量相同,容器体积变为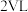 ,则该反应的速率会
,则该反应的速率会___________ (填“增大”“减小”或“不变”)。
③下列可以表明上述可逆反应已达到化学平衡状态的是___________ (填序号)。
a.容器中的气体压强保持不变
b. 的浓度之比为
的浓度之比为
c. 的浓度不再改变
的浓度不再改变
d.相同时间内,反应消耗 的同时消耗
的同时消耗
 等有害气体。
等有害气体。(1)汽车尾气中
 生成过程的能量变化示意图如图:
生成过程的能量变化示意图如图: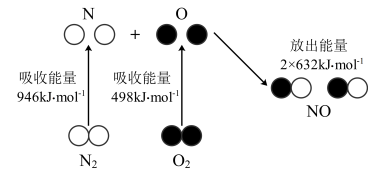
(2)利用催化技术可将汽车尾气中的
 和
和 转化为
转化为 和
和 。
。①该反应的化学方程式为
②某温度下,在
 的密闭容器中通入
的密闭容器中通入 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:时间/ | 0 | 1 | 2 | 3 | … |
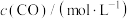 | 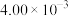 |  |  |  | … |
 的浓度变化表示反应由开始到
的浓度变化表示反应由开始到 时的平均反应速率为
时的平均反应速率为 ;若恒温下保持起始投料量相同,容器体积变为
;若恒温下保持起始投料量相同,容器体积变为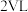 ,则该反应的速率会
,则该反应的速率会③下列可以表明上述可逆反应已达到化学平衡状态的是
a.容器中的气体压强保持不变
b.
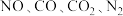 的浓度之比为
的浓度之比为
c.
 的浓度不再改变
的浓度不再改变d.相同时间内,反应消耗
 的同时消耗
的同时消耗
您最近半年使用:0次
名校
7 . 能量、速率与限度是认识和研究化学反应的重要视角。下列说法错误的是
| A.热值是指一定条件下1mol可燃物完全燃烧所放出的热量 |
| B.化学反应速率是用来衡量化学反应快慢的物理量 |
| C.化学反应的过程中一定伴随着能量的变化 |
| D.需要在高温条件下进行的化学反应不一定属于吸热反应 |
您最近半年使用:0次
8 . 碳和氮的化合物在生产生活中广泛存在。低碳烃类(甲烷、乙烯、丙烯等)作为重要的基本化工原料,在现代石油和化学工业中具有举足轻重的作用。
Ⅰ.小分子烃类(如丙烯)作为还原剂可以在催化剂上选择性还原 。
。
已知: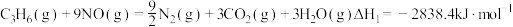
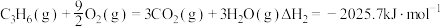
(1)反应
________  ;
;
Ⅱ.甲烷的制备 ,该反应的
,该反应的 与温度的关系如图所示。
与温度的关系如图所示。
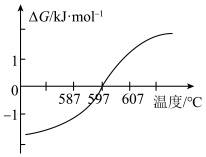
(2)要使该反应能自发进行,理论上温度不高于________ ℃;
(3)在恒温、恒容容器中按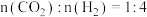 充入反应物进行该反应,下列有关该反应的说法正确的是
充入反应物进行该反应,下列有关该反应的说法正确的是________ ;
a.升高温度会使 的平衡转化率降低
的平衡转化率降低
b. 和
和 的转化率之比不再变化,说明反应达到平衡状态
的转化率之比不再变化,说明反应达到平衡状态
c.若反应达到平衡后,再向容器中充入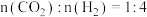 的反应物,则甲烷的体积分数仍保持不变
的反应物,则甲烷的体积分数仍保持不变
Ⅲ.一定条件下,碘甲烷 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:
反应①: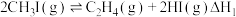
反应②: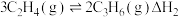
反应①和②在不同温度下的分压平衡常数 如下表,回答下列问题:
如下表,回答下列问题:
(4)根据表中数据推出反应①的活化能 (正)
(正)________ (填“ ”或“
”或“ ”)
”) (逆);
(逆);
(5)反应②的正、逆反应速率表达式有: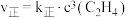 ,
,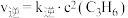 (
( 、
、 为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式:
为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式: [k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越
[k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越________ (填“大”或“小”)。当该反应达到平衡后,升高温度,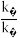 的值
的值________ (填“增大”“减小”或“不变”);
Ⅳ.微生物燃料电池的一种重要应用是废水处理中实现碳氮联合转化为 和
和 ,如图所示,其中1,2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。
,如图所示,其中1,2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。
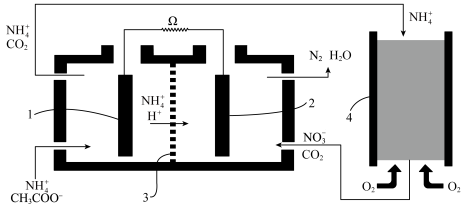
(6)正极的电极反应式是________ ;
(7)协同转化总反应中当有标准状况下 生成时转移电子的个数是
生成时转移电子的个数是________ 。
Ⅰ.小分子烃类(如丙烯)作为还原剂可以在催化剂上选择性还原
 。
。已知:
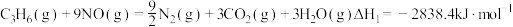
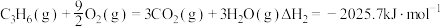
(1)反应

 ;
;Ⅱ.甲烷的制备
 ,该反应的
,该反应的 与温度的关系如图所示。
与温度的关系如图所示。
(2)要使该反应能自发进行,理论上温度不高于
(3)在恒温、恒容容器中按
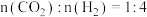 充入反应物进行该反应,下列有关该反应的说法正确的是
充入反应物进行该反应,下列有关该反应的说法正确的是a.升高温度会使
 的平衡转化率降低
的平衡转化率降低b.
 和
和 的转化率之比不再变化,说明反应达到平衡状态
的转化率之比不再变化,说明反应达到平衡状态c.若反应达到平衡后,再向容器中充入
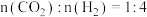 的反应物,则甲烷的体积分数仍保持不变
的反应物,则甲烷的体积分数仍保持不变Ⅲ.一定条件下,碘甲烷
 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:反应①:
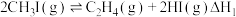
反应②:
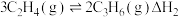
反应①和②在不同温度下的分压平衡常数
 如下表,回答下列问题:
如下表,回答下列问题: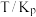 |  |  |  |  |  |  |
| 反应① | 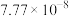 | 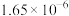 | 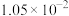 | 2.80 |  | 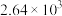 |
| 反应② | 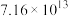 | 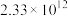 | 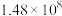 | 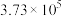 | 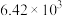 | 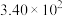 |
(4)根据表中数据推出反应①的活化能
 (正)
(正) ”或“
”或“ ”)
”) (逆);
(逆);(5)反应②的正、逆反应速率表达式有:
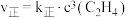 ,
,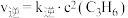 (
( 、
、 为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式:
为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式: [k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越
[k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越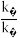 的值
的值Ⅳ.微生物燃料电池的一种重要应用是废水处理中实现碳氮联合转化为
 和
和 ,如图所示,其中1,2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。
,如图所示,其中1,2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。
(6)正极的电极反应式是
(7)协同转化总反应中当有标准状况下
 生成时转移电子的个数是
生成时转移电子的个数是
您最近半年使用:0次
名校
解题方法
9 . 某反应物的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的化学反应速率为
| A.0.01mol/(L·s) | B.0.04mol/(L·s) | C.0.08mol/(L·s) | D.0.05mol/(L·s) |
您最近半年使用:0次
2024-04-05更新
|
422次组卷
|
2卷引用:甘肃省白银市会宁县第四中学2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
10 . 丙酮在HCl催化条件下发生溴化反应的化学方程式为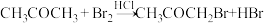 ,已知该反应的速率方程为
,已知该反应的速率方程为 ,其中k为与温度有关的常数。下列说法正确的是
,其中k为与温度有关的常数。下列说法正确的是
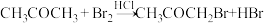 ,已知该反应的速率方程为
,已知该反应的速率方程为 ,其中k为与温度有关的常数。下列说法正确的是
,其中k为与温度有关的常数。下列说法正确的是| A.该反应为加成反应 | B.升高温度,k增大,化学反应速率加快 |
C.减小 ,化学反应速率减慢 ,化学反应速率减慢 | D.增大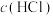 ,化学反应速率不变 ,化学反应速率不变 |
您最近半年使用:0次
2024-03-28更新
|
134次组卷
|
2卷引用:安徽省淮北市树人高级中学2023-2024学年上学期高二11月期中考试化学试题



