解题方法
1 . 甲醇和乙醇都是清洁能源,也是重要的化工原料。回答下列问题:
(1)工业上利用合成气合成甲醇: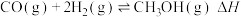
已知:① ;
;
②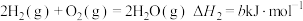 ;
;
③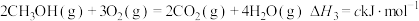
上述反应中的
___________  。
。
(2)一定温度下,在恒容密闭容器中充入1molCO和1molH2,在固体催化剂作用下合成甲醇: ,下列叙述错误的是___________(填字母)。
,下列叙述错误的是___________(填字母)。
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢: ,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。___________ 下(高温、低温、任意温度)自发进行;图示历程包括___________ 个基元反应;其中决速反应是反应___________ (填序号),写出该步反应式:___________ 。
(4)工业上,可以采用CO2催化还原制备CH3OH、CH3CH2OH.发生反应如下:
① (主反应);
(主反应);
② (主反应);
(主反应);
③ (副反应)。
(副反应)。
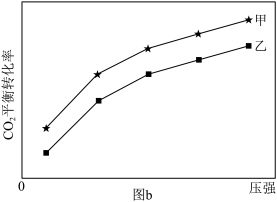
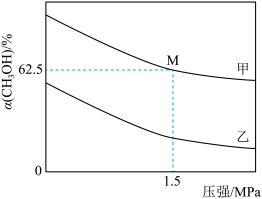
一定温度下,在甲、乙体积相同的反应容器中分别充入1molCO2和3molH2,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得CO2平衡转化率与压强关系如图b所示。其他条件相同,增大压强,CO2平衡转化率增大,其原因是___________ ;采用水分子膜分离技术的容器是___________ (填“甲”或“乙”)。 为
为___________  。(写出数字表达式即可,分压=总压×物质的量分数)
。(写出数字表达式即可,分压=总压×物质的量分数)
(1)工业上利用合成气合成甲醇:
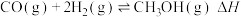
已知:①
 ;
;②
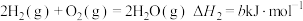 ;
;③
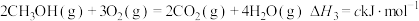
上述反应中的

 。
。(2)一定温度下,在恒容密闭容器中充入1molCO和1molH2,在固体催化剂作用下合成甲醇:
 ,下列叙述错误的是___________(填字母)。
,下列叙述错误的是___________(填字母)。| A.当CO体积分数不变时达到平衡状态 |
| B.平衡后充入少量氩气,平衡不移动 |
| C.平衡后再充入0.1molCO和0.1molH2,CO平衡转化率增大 |
| D.增大催化剂质量,正、逆反应速率同倍数增大 |
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢:
 ,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
(4)工业上,可以采用CO2催化还原制备CH3OH、CH3CH2OH.发生反应如下:
①
 (主反应);
(主反应);②
 (主反应);
(主反应);③
 (副反应)。
(副反应)。一定温度下,在甲、乙体积相同的反应容器中分别充入1molCO2和3molH2,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得CO2平衡转化率与压强关系如图b所示。其他条件相同,增大压强,CO2平衡转化率增大,其原因是
 为
为 。(写出数字表达式即可,分压=总压×物质的量分数)
。(写出数字表达式即可,分压=总压×物质的量分数)
您最近半年使用:0次
2 . MTP是一类重要的药物中间体,可以由TOME经环化后合成。其反应式为: ,反应过程中液体体积变化忽略不计。下列说法错误的是
,反应过程中液体体积变化忽略不计。下列说法错误的是
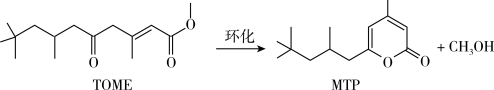
 ,反应过程中液体体积变化忽略不计。下列说法错误的是
,反应过程中液体体积变化忽略不计。下列说法错误的是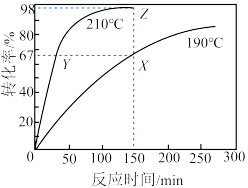
A.190℃时,0至150min之间MTP的平均反应速率为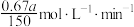 |
B.若Z点处于化学平衡状态,则210℃时反应平衡常数 |
| C.X、Y两点虽温度不同,但MTP的物质的量浓度相等 |
| D.从溶液体系中及时移出部分甲醇可提高TOME的转化率 |
您最近半年使用:0次
3 . 一定温度下,向四个不同的恒容密闭容器中分别通入3molNOCl(g),发生反应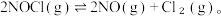 tmin时,NOCl的转化率与容器体积的关系如图所示。下列叙述正确的是
tmin时,NOCl的转化率与容器体积的关系如图所示。下列叙述正确的是
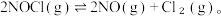 tmin时,NOCl的转化率与容器体积的关系如图所示。下列叙述正确的是
tmin时,NOCl的转化率与容器体积的关系如图所示。下列叙述正确的是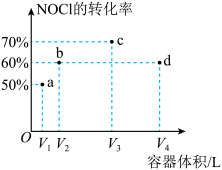
| A.图中只有c、d两点处于平衡状态 |
| B.b、d两点的压强相等 |
| C.tmin时a点v逆大于c点v正 |
| D.平衡常数:Ka<Kb<Kc<Kd |
您最近半年使用:0次
解题方法
4 . 我国承诺在2030年实现“碳达峰”,2060年实现“碳中和”, 资源化利用具有重要意义,回答下列问题:
资源化利用具有重要意义,回答下列问题:
I. 和
和 在镍基催化作用下重整模型如图所示(已知:*表示催化剂活性位点,
在镍基催化作用下重整模型如图所示(已知:*表示催化剂活性位点,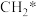 表示活性亚甲基)。
表示活性亚甲基)。 和
和 在镍基催化作用下发生重整反应的化学方程式为
在镍基催化作用下发生重整反应的化学方程式为_____ 。该反应在高温下才能自发进行,判断反应焓变
_____ (填“大于”“小于”或“等于”)0,判断理由是_____ 。
(2)已知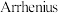 经验公式:
经验公式: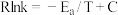 (
( 为活化能,k为速率常数,R和C为常数),该反应的速率常数
为活化能,k为速率常数,R和C为常数),该反应的速率常数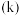 、活化能
、活化能 与温度
与温度 的关系如图:
的关系如图: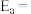
_____  。(用含有
。(用含有 的式子表示)
的式子表示)
Ⅱ.已知二氧化碳和氢气合成甲醇可能发生如下反应:
i.

ii.

(3)为提高甲醇平衡产率,可采取的措施有_____ (至少答两条)。
(4)若以 为催化剂,其活性温度范围通常为
为催化剂,其活性温度范围通常为 。向装有催化剂的密闭容器按投料比为
。向装有催化剂的密闭容器按投料比为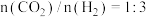 通入反应物,保持压强为
通入反应物,保持压强为 ,若只发生反应i,其他条件相同,不同温度下。5分钟内,测得温度与甲醇的产率关系如图,实际产率呈现先升高后降低的原因是
,若只发生反应i,其他条件相同,不同温度下。5分钟内,测得温度与甲醇的产率关系如图,实际产率呈现先升高后降低的原因是_____ 。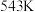 时的压强平衡常数
时的压强平衡常数
_____  。(写出计算式)
。(写出计算式)
 资源化利用具有重要意义,回答下列问题:
资源化利用具有重要意义,回答下列问题:I.
 和
和 在镍基催化作用下重整模型如图所示(已知:*表示催化剂活性位点,
在镍基催化作用下重整模型如图所示(已知:*表示催化剂活性位点,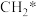 表示活性亚甲基)。
表示活性亚甲基)。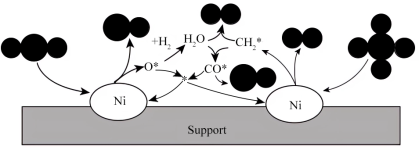
 和
和 在镍基催化作用下发生重整反应的化学方程式为
在镍基催化作用下发生重整反应的化学方程式为
(2)已知
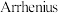 经验公式:
经验公式: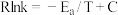 (
( 为活化能,k为速率常数,R和C为常数),该反应的速率常数
为活化能,k为速率常数,R和C为常数),该反应的速率常数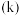 、活化能
、活化能 与温度
与温度 的关系如图:
的关系如图: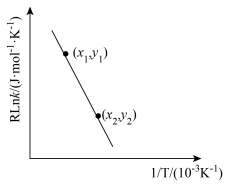
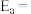
 。(用含有
。(用含有 的式子表示)
的式子表示)Ⅱ.已知二氧化碳和氢气合成甲醇可能发生如下反应:
i.


ii.


(3)为提高甲醇平衡产率,可采取的措施有
(4)若以
 为催化剂,其活性温度范围通常为
为催化剂,其活性温度范围通常为 。向装有催化剂的密闭容器按投料比为
。向装有催化剂的密闭容器按投料比为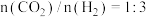 通入反应物,保持压强为
通入反应物,保持压强为 ,若只发生反应i,其他条件相同,不同温度下。5分钟内,测得温度与甲醇的产率关系如图,实际产率呈现先升高后降低的原因是
,若只发生反应i,其他条件相同,不同温度下。5分钟内,测得温度与甲醇的产率关系如图,实际产率呈现先升高后降低的原因是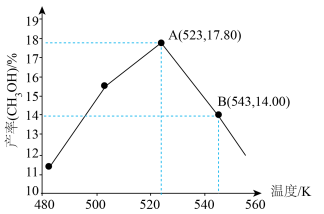
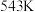 时的压强平衡常数
时的压强平衡常数
 。(写出计算式)
。(写出计算式)
您最近半年使用:0次
解题方法
5 . 苯乙烯是一种很重要的有机化学原料,用途十分广泛。在以水蒸气做稀释剂、存在催化剂的条件下,乙苯催化脱氢可生成苯乙烯。可能发生如下两个反应;
主反应: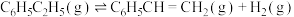
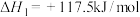 ;
;
副反应: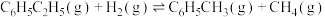
 。
。
回答下列问题:
(1)已知,在 、
、 条件下,
条件下,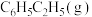 、
、 、
、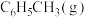 、
、 的燃烧热分别为
的燃烧热分别为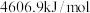 、
、 、
、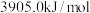 、
、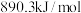 。则
。则
_______  。
。
(2)在某温度、pkPa的条件下,向反应器中充入 气态乙苯发生主反应:
气态乙苯发生主反应: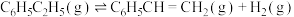 ,其平衡转化率为50%,若向该反应器中充入
,其平衡转化率为50%,若向该反应器中充入 水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至
水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至_______ 。
(3)在不同的温度条件下,以水烃比 投料,在膜反应器中发生乙苯催化脱氢反应
投料,在膜反应器中发生乙苯催化脱氢反应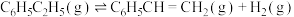 。膜反应器可以通过多孔膜移去
。膜反应器可以通过多孔膜移去 ,提高乙苯的平衡转化率,工作原理如图所示:
,提高乙苯的平衡转化率,工作原理如图所示: 移出率
移出率
 ×100%。
×100%。
①忽略副反应,维持体系总压强p恒定,在温度T时,已知乙苯的平衡转化率为 ,
, 的移出率为b,则在该温度下主反应的平衡常数
的移出率为b,则在该温度下主反应的平衡常数
_______ (用含 、b、p的代数式表示)。
、b、p的代数式表示)。
②乙苯的平衡转化率增长百分数与 的移出率在不同温度条件下的关系如表所示:
的移出率在不同温度条件下的关系如表所示:
高温下副反应程度极小,试说明当温度高于950℃时,乙苯的平衡转化率随 的移出率的变化改变程度不大的原因:
的移出率的变化改变程度不大的原因:_______ 。
③下列说法正确的是_______ (填选项字母)。
A.生成 的总物质的量与苯乙烯相等
的总物质的量与苯乙烯相等
B.因为 被分离至隔离区,故反应器中不发生副反应
被分离至隔离区,故反应器中不发生副反应
C.在恒容的膜反应器中,其他条件不变,增大水烃比,可提高乙苯的转化率
D.当 的分压不再发生变化时,说明主副反应均达到平衡状态
的分压不再发生变化时,说明主副反应均达到平衡状态
(4)有研究者发现,在 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示:_______ 。
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应影响较大,如果催化剂表面碱性太强,会降低乙苯的转化率,碱性太强使乙苯转化率降低的原因是_______ (写一点即可)。
③从资源综合利用角度分析, 氧化乙苯脱氢制苯乙烯的优点是
氧化乙苯脱氢制苯乙烯的优点是_______ 。
主反应:
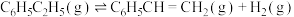
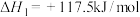 ;
;副反应:
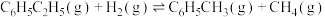
 。
。回答下列问题:
(1)已知,在
 、
、 条件下,
条件下,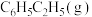 、
、 、
、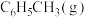 、
、 的燃烧热分别为
的燃烧热分别为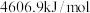 、
、 、
、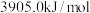 、
、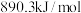 。则
。则
 。
。(2)在某温度、pkPa的条件下,向反应器中充入
 气态乙苯发生主反应:
气态乙苯发生主反应: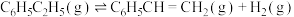 ,其平衡转化率为50%,若向该反应器中充入
,其平衡转化率为50%,若向该反应器中充入 水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至
水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至(3)在不同的温度条件下,以水烃比
 投料,在膜反应器中发生乙苯催化脱氢反应
投料,在膜反应器中发生乙苯催化脱氢反应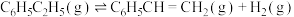 。膜反应器可以通过多孔膜移去
。膜反应器可以通过多孔膜移去 ,提高乙苯的平衡转化率,工作原理如图所示:
,提高乙苯的平衡转化率,工作原理如图所示: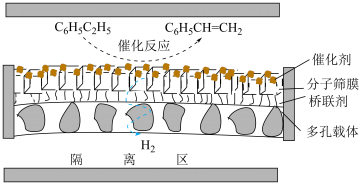
 移出率
移出率
 ×100%。
×100%。①忽略副反应,维持体系总压强p恒定,在温度T时,已知乙苯的平衡转化率为
 ,
, 的移出率为b,则在该温度下主反应的平衡常数
的移出率为b,则在该温度下主反应的平衡常数
 、b、p的代数式表示)。
、b、p的代数式表示)。②乙苯的平衡转化率增长百分数与
 的移出率在不同温度条件下的关系如表所示:
的移出率在不同温度条件下的关系如表所示:| 温度/℃ 增长百分数/%  移出率/% 移出率/% | 700 | 950 | 1000 |
| 60 | 8.43 | 4.38 | 2.77 |
| 80 | 16.8 | 6.1 | 3.8 |
| 90 | 27 | 7.1 | 4.39 |
 的移出率的变化改变程度不大的原因:
的移出率的变化改变程度不大的原因:③下列说法正确的是
A.生成
 的总物质的量与苯乙烯相等
的总物质的量与苯乙烯相等B.因为
 被分离至隔离区,故反应器中不发生副反应
被分离至隔离区,故反应器中不发生副反应C.在恒容的膜反应器中,其他条件不变,增大水烃比,可提高乙苯的转化率
D.当
 的分压不再发生变化时,说明主副反应均达到平衡状态
的分压不再发生变化时,说明主副反应均达到平衡状态(4)有研究者发现,在
 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示: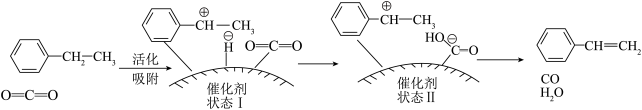
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应影响较大,如果催化剂表面碱性太强,会降低乙苯的转化率,碱性太强使乙苯转化率降低的原因是
③从资源综合利用角度分析,
 氧化乙苯脱氢制苯乙烯的优点是
氧化乙苯脱氢制苯乙烯的优点是
您最近半年使用:0次
6 . 氢能是清洁、绿色能源,我国在开发氢能领域取得突破性进展。
I.氨分解制备氢。
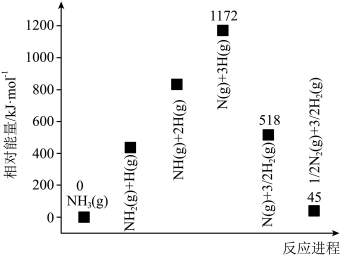
在铁或钨催化剂作用下,氨分解过程中能量变化如图所示。
(1)根据图推知,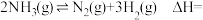
___________  。
。 键能为
键能为___________  。
。 ,实验测得氨气分解反应半衰期与温度(T)、初始压强(
,实验测得氨气分解反应半衰期与温度(T)、初始压强(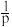 )的关系如图所示。
)的关系如图所示。
___________ (填“>”“<”或“=”) ,
, 温度下,反应进行到
温度下,反应进行到 时容器内反应体系总压强为
时容器内反应体系总压强为___________  。
。
(3)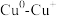 界面协同催化
界面协同催化 键断裂促进甲醇重整高效产氢的反应历程如图所示(
键断裂促进甲醇重整高效产氢的反应历程如图所示( 代表过渡态,*表示吸附在催化剂
代表过渡态,*表示吸附在催化剂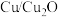 表面):控速步骤的化学方程式为
表面):控速步骤的化学方程式为___________ 。 的转化率与压强关系如图所示。进料组成
的转化率与压强关系如图所示。进料组成 ;进料组成
;进料组成 ,
,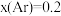 。[物质i的物质的量分数:
。[物质i的物质的量分数: ]
]___________ (填“甲”或“乙”)。
②M点 的体积分数为
的体积分数为___________ ,对应温度下,该反应的平衡常数 为
为___________ (用分数表示结果)。
I.氨分解制备氢。
在铁或钨催化剂作用下,氨分解过程中能量变化如图所示。
(1)根据图推知,
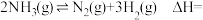
 。
。 键能为
键能为 。
。
 ,实验测得氨气分解反应半衰期与温度(T)、初始压强(
,实验测得氨气分解反应半衰期与温度(T)、初始压强(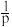 )的关系如图所示。
)的关系如图所示。
 ,
, 温度下,反应进行到
温度下,反应进行到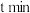 时容器内反应体系总压强为
时容器内反应体系总压强为 。
。
(3)
 界面协同催化
界面协同催化 键断裂促进甲醇重整高效产氢的反应历程如图所示(
键断裂促进甲醇重整高效产氢的反应历程如图所示( 代表过渡态,*表示吸附在催化剂
代表过渡态,*表示吸附在催化剂 表面):控速步骤的化学方程式为
表面):控速步骤的化学方程式为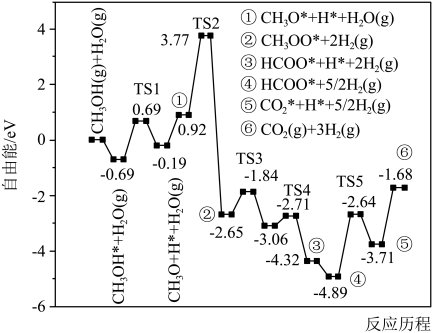
 的转化率与压强关系如图所示。进料组成
的转化率与压强关系如图所示。进料组成 ;进料组成
;进料组成 ,
, 。[物质i的物质的量分数:
。[物质i的物质的量分数: ]
]
②M点
 的体积分数为
的体积分数为 为
为
您最近半年使用:0次
解题方法
7 . Ⅰ.二氧化硫可用于“接触法制硫酸”,核心反应是2SO2+O2 2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如下:
2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如下:
Ⅱ.也可以用电化学原理,使用SO2制备硫酸,同时精制粗铜,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触,质子交换膜只允许H+通过。___________ ,与___________ (填“精铜”或“粗铜”)连接;
(3)假设粗铜中含有铁、锌杂质,工作一段时间后CuSO4溶液中的Cu2+浓度___________ (填“不变”或“增大”“减小”)。
 2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如下:
2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如下: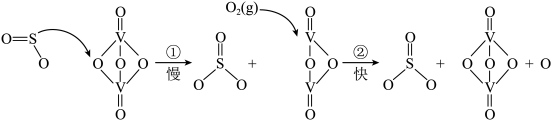
| A.SO2和SO3都属于酸性氧化物,通到BaCl2溶液中都会产生白色沉淀 |
| B.增大O2的浓度可以明显提高SO3的生成速率 |
| C.图示过程中既有V-O键的断裂又有V-O键的形成 |
| D.V2O5的作用是降低该反应的活化能,提高SO2的平衡转化率 |
Ⅱ.也可以用电化学原理,使用SO2制备硫酸,同时精制粗铜,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触,质子交换膜只允许H+通过。
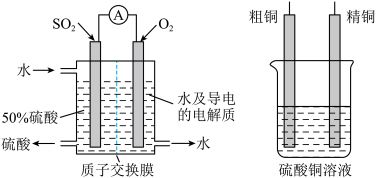
(3)假设粗铜中含有铁、锌杂质,工作一段时间后CuSO4溶液中的Cu2+浓度
您最近半年使用:0次
8 . 目前生产钛的方法之一是先将TiO2转化为TiCl4,再进一步还原得到钛。以下是碳氯化法制备TiCl4:TiO2(s)+2Cl2(g)+2C(s) TiCl4(g)+2CO(g) ∆H
TiCl4(g)+2CO(g) ∆H kJ·mol−1。
kJ·mol−1。
(1)对于该反应:增大压强,平衡___________ 移动(填“正向”“不”或“逆向”);温度升高,平衡转化率___________ (填“增大”“减小”或“不变”)。
(2)恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是______。
(3)在某温度下,该恒容体系已经达到平衡,若向其中加入少量碳,TiCl4的体积分数将___________ (填选项);若加入少量氯气,TiCl4的体积分数将___________ (填选项)。
A.减小 B.不变 C.增大
 TiCl4(g)+2CO(g) ∆H
TiCl4(g)+2CO(g) ∆H kJ·mol−1。
kJ·mol−1。(1)对于该反应:增大压强,平衡
(2)恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是______。
| A.混合气体的压强保持不变 | B.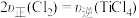 |
| C.混合气体的密度保持不变 | D.Cl2和CO物质的量相等 |
A.减小 B.不变 C.增大
您最近半年使用:0次
9 . 氮及其化合物的研究对于生态环境保护和工农业生产发展非常重要。
(1)已知:2NH3(g) N2(g)+3H2(g),活化能Ea1=600 kJ/mol,合成氨有关化学键的键能如下表:
N2(g)+3H2(g),活化能Ea1=600 kJ/mol,合成氨有关化学键的键能如下表:
则合成氨反应:N2(g)+3H2(g) 2NH3(g)的活化能Ea2=
2NH3(g)的活化能Ea2=___________ 。
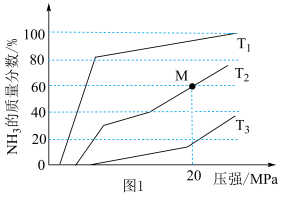
(2)在一定条件下,向某反应容器中投入1 mol N2、3mol H2在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图1所示。___________ , M点N2的转化率为___________ 。
(3)采用催化剂存在下臭氧氧化—碱吸收法同时脱除SO2和NO。
反应I:NO(g)+O3(g) NO2(g)+O2(g)
NO2(g)+O2(g)  = -200.9 kJ/mol
= -200.9 kJ/mol
反应II:SO2(g)+O3(g) SO3(g)+O2(g)
SO3(g)+O2(g)  =-241.6 kJ/mol
=-241.6 kJ/mol
一定条件下,向容积为2 L的反应器充如2.0 mol NO、2.0molSO2的模拟烟气和4.0molO3,升高温度,体系中NO和SO2的转化率随温度T变化如图2所示。___________ 。
A.温度越高,脱除SO2和NO的效果越好
B.相同温度下, NO的转化率远高于SO2
C.可根据不同温度下的转化率选择最佳温度脱除SO2和NO
(4)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)  H=-746.8 kJ/mol。
H=-746.8 kJ/mol。
实验测得:v正=k正p2(NO)·p2(CO),v逆=k逆p(N2)。p2(CO2)。其中k正、k逆分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压)。
①达到平衡后,仅升高温度,k正增大的倍数___________ (选填“大于”“小于”或“等于”) k逆增大的倍数。
②一定温度下在刚性密闭容器中充入CO、NO和N2物质的量之比为2:2:1,压强为p0 kPa.达平衡时压强为0.9p0 kPa,则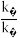 =
=___________ 。
(5)氮的氧化物脱除可用电化学原理处理,如图3装置可同时吸收SO2和NO。直流电源的正极为__________ (选填“a”或“b”),阳极的电极反应式___________ 。该电解装置选择___________ (选填“阳”或“阴")离子交换膜。
(1)已知:2NH3(g)
 N2(g)+3H2(g),活化能Ea1=600 kJ/mol,合成氨有关化学键的键能如下表:
N2(g)+3H2(g),活化能Ea1=600 kJ/mol,合成氨有关化学键的键能如下表:| 化学键 | H-H | N≡N | N-H |
| 键能/kJ/mol | 436 | 946 | 391 |
 2NH3(g)的活化能Ea2=
2NH3(g)的活化能Ea2=(2)在一定条件下,向某反应容器中投入1 mol N2、3mol H2在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图1所示。
(3)采用催化剂存在下臭氧氧化—碱吸收法同时脱除SO2和NO。
反应I:NO(g)+O3(g)
 NO2(g)+O2(g)
NO2(g)+O2(g)  = -200.9 kJ/mol
= -200.9 kJ/mol反应II:SO2(g)+O3(g)
 SO3(g)+O2(g)
SO3(g)+O2(g)  =-241.6 kJ/mol
=-241.6 kJ/mol一定条件下,向容积为2 L的反应器充如2.0 mol NO、2.0molSO2的模拟烟气和4.0molO3,升高温度,体系中NO和SO2的转化率随温度T变化如图2所示。
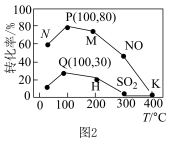
A.温度越高,脱除SO2和NO的效果越好
B.相同温度下, NO的转化率远高于SO2
C.可根据不同温度下的转化率选择最佳温度脱除SO2和NO
(4)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)
N2(g)+2CO2(g)  H=-746.8 kJ/mol。
H=-746.8 kJ/mol。实验测得:v正=k正p2(NO)·p2(CO),v逆=k逆p(N2)。p2(CO2)。其中k正、k逆分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压)。
①达到平衡后,仅升高温度,k正增大的倍数
②一定温度下在刚性密闭容器中充入CO、NO和N2物质的量之比为2:2:1,压强为p0 kPa.达平衡时压强为0.9p0 kPa,则
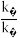 =
=(5)氮的氧化物脱除可用电化学原理处理,如图3装置可同时吸收SO2和NO。直流电源的正极为

您最近半年使用:0次
解题方法
10 . 苯乙烯是重要的有机化工原料,可用乙苯为原料制备苯乙烯。常见的方法有直接脱氢法和氧化脱氢法。反应原理表示如下:
反应①(氧化脱氢):
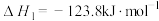
反应②(直接脱氢):
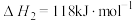
(1)H2的燃烧反应: 的焓变
的焓变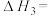
__________  。
。
(2)判断反应①能否自发进行,并说明理由。______________
(3)欲提高反应①中乙苯平衡转化率,可采用的措施有_____________ 、_____________ 。
(4)某温度下,向2L容器中通入2mol气态乙苯与2mol O2发生反应①,10min后反应达到平衡,此时混合气体中乙苯和苯乙烯的物质的量相等。
①可以判断反应①达到化学平衡状态的标志是_____________
A.正反应与逆反应不再进行 B.气体密度不再改变
C.体系压强不再改变 D.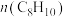 与
与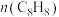 之和保持不变
之和保持不变
②从开始反应至达到平衡时间段内平均反应速率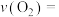
_____________ 。
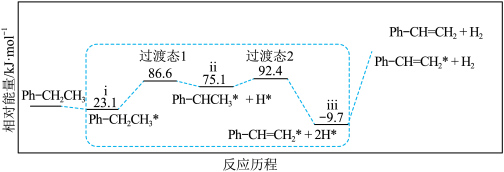
(5)中国化学家提出了在某催化剂表面反应②的机理(Ph-代表苯基,*代表吸附态):___________ 步反应。
A.1 B.2 C.3 D.4
②虚线框内化学反应速率最慢的一步活化能的值为_____________ kJ·mol-1。
A.11.5 B.17.3 C.63.5 D.102.1
③关于上述反应历程说法正确的是___________ (不定项)。
A.物质吸附在催化剂表面时通常比其形成的过渡态稳定
B.使用催化剂后,有效提升了乙苯的平衡转化率
C.状态ⅱ→状态ⅲ过程中形成了π键
D.状态ⅲ→状态ⅳ的能量变化说明形成H-H键是吸热过程
④若工业上采用反应②来生产苯乙烯,常伴有乙苯的裂解副反应,且一般情况下,该副反应的反应速率与程度都比反应②大。生产中可____________ (填措施名称)来提高反应②的选择性。
反应①(氧化脱氢):

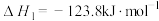
反应②(直接脱氢):

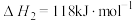
(1)H2的燃烧反应:
 的焓变
的焓变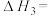
 。
。(2)判断反应①能否自发进行,并说明理由。
(3)欲提高反应①中乙苯平衡转化率,可采用的措施有
(4)某温度下,向2L容器中通入2mol气态乙苯与2mol O2发生反应①,10min后反应达到平衡,此时混合气体中乙苯和苯乙烯的物质的量相等。
①可以判断反应①达到化学平衡状态的标志是
A.正反应与逆反应不再进行 B.气体密度不再改变
C.体系压强不再改变 D.
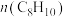 与
与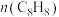 之和保持不变
之和保持不变②从开始反应至达到平衡时间段内平均反应速率
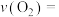
(5)中国化学家提出了在某催化剂表面反应②的机理(Ph-代表苯基,*代表吸附态):
A.1 B.2 C.3 D.4
②虚线框内化学反应速率最慢的一步活化能的值为
A.11.5 B.17.3 C.63.5 D.102.1
③关于上述反应历程说法正确的是
A.物质吸附在催化剂表面时通常比其形成的过渡态稳定
B.使用催化剂后,有效提升了乙苯的平衡转化率
C.状态ⅱ→状态ⅲ过程中形成了π键
D.状态ⅲ→状态ⅳ的能量变化说明形成H-H键是吸热过程
④若工业上采用反应②来生产苯乙烯,常伴有乙苯的裂解副反应,且一般情况下,该副反应的反应速率与程度都比反应②大。生产中可
您最近半年使用:0次



