解题方法
1 . 天然气、石油钻探过程会释放出CO2、H2S等气体。某种将CO2和H2S共活化的工艺涉及如下反应:
①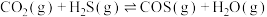
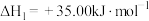
②

③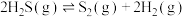
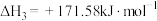
④

回答下列问题:
(1)已知:298K时,18g气态水转化为液态水释放出44kJ的能量;H2S(g)的标准摩尔燃烧焓(△H)为-586kJ·mol-1,则COS(g)的标准摩尔燃烧焓( )为
)为___________ kJ·mol-1,反应②在___________ (填“高温”“低温”或“任意温度”)下能自发进行。
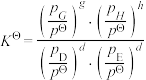
(2)一定条件下,向起始压强为200kPa的恒容密闭容器中通入等物质的量的CO2(g)和H2S(g)混合气体,发生上述反应,25min时,测得体系总压强为210kPa,S2(g)的平均反应速率为___________ kPa·min-1.达到平衡时,测得体系总压强为230kPa,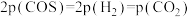 ,此时H2S(g)的平衡转化率为
,此时H2S(g)的平衡转化率为___________ ,反应②的标准平衡常数
___________ (已知:分压=总压×该组分物质的量分数,对于反应 ,
, ,其中
,其中 ,
,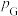 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
(3)将等物质的量的CO2(g)和H2S(g)混合气体充入恒压密闭容器中,发生上述反应,反应物的平衡转化率、COS或H2O的选择性与温度关系如图所示。COS的选择性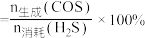 ,H2O的选择性
,H2O的选择性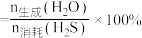 。
。___________ (填“曲线a”或“曲线b”);
②温度低于500℃时,H2S的转化率与CO2的相等,原因是___________ 。
①
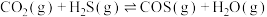
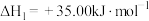
②


③
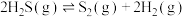
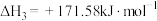
④


回答下列问题:
(1)已知:298K时,18g气态水转化为液态水释放出44kJ的能量;H2S(g)的标准摩尔燃烧焓(△H)为-586kJ·mol-1,则COS(g)的标准摩尔燃烧焓(
 )为
)为(2)一定条件下,向起始压强为200kPa的恒容密闭容器中通入等物质的量的CO2(g)和H2S(g)混合气体,发生上述反应,25min时,测得体系总压强为210kPa,S2(g)的平均反应速率为
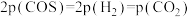 ,此时H2S(g)的平衡转化率为
,此时H2S(g)的平衡转化率为
 ,
, ,其中
,其中 ,
,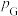 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。(3)将等物质的量的CO2(g)和H2S(g)混合气体充入恒压密闭容器中,发生上述反应,反应物的平衡转化率、COS或H2O的选择性与温度关系如图所示。COS的选择性
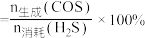 ,H2O的选择性
,H2O的选择性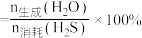 。
。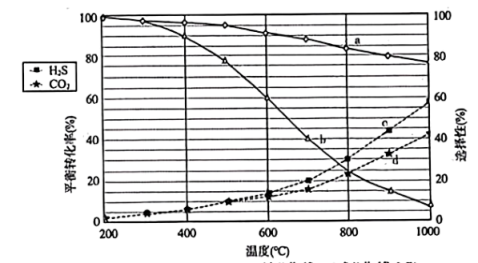
②温度低于500℃时,H2S的转化率与CO2的相等,原因是
您最近半年使用:0次
名校
解题方法
2 .  是一种脱硝性能较好的催化剂。采用共沉淀法等比掺入金属M后,催化剂的脱硝性能会发生改变。烟气脱硝主要副产物为
是一种脱硝性能较好的催化剂。采用共沉淀法等比掺入金属M后,催化剂的脱硝性能会发生改变。烟气脱硝主要副产物为 。主反应如下:
。主反应如下:
反应Ⅰ.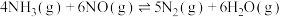
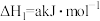
反应Ⅱ.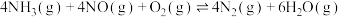
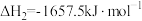
(1)已知:
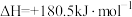 。则
。则
_______  。某条件下对于反应Ⅰ,
。某条件下对于反应Ⅰ, ,
,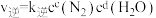 ,
, 、
、 为速率常数。升高温度时,
为速率常数。升高温度时, 增大m倍,
增大m倍, 增大n倍,则m
增大n倍,则m_______ n(填“>”、“<”或“=”)。
(2)将模拟烟气按一定的流量通入掺杂不同金属的催化剂,在不同温度下进行反应并测定相关物质浓度,得出不同情况下NO的转化率、 的选择性、
的选择性、 的生成量随温度变化关系如下图。
的生成量随温度变化关系如下图。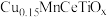 时,温度高于260℃时NO转化率下降的原因可能是
时,温度高于260℃时NO转化率下降的原因可能是_______ 。
②综合考虑应选择_______ 为该脱硝过程的催化剂,选择合适的催化剂_______ (填写“能”或“不能”)提高 的平衡产率。
的平衡产率。
③为探究氨的催化脱硝过程中生成 的机理,将含有不同同位素原子的物质(
的机理,将含有不同同位素原子的物质(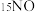 与
与 、
、 )通入反应容器进行一系列温度编程实验,通过质谱仪测定产物气体分子的含量随温度的变化曲线如下图。
)通入反应容器进行一系列温度编程实验,通过质谱仪测定产物气体分子的含量随温度的变化曲线如下图。 与NO、
与NO、 反应生成
反应生成 的化学方程式为
的化学方程式为_______ (需标出N原子的质量数)。
(3)当温度为273℃,在恒容密闭的容器中,假设仅发生两个主反应。通入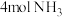 、
、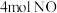 、
、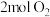 ,初始压强为
,初始压强为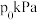 情况下,达到平衡后测定
情况下,达到平衡后测定 转化率为30%,平衡体系中
转化率为30%,平衡体系中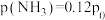 。则NO的转化率为
。则NO的转化率为______ ,反应Ⅱ的
______ (写出计算式即可)。
 是一种脱硝性能较好的催化剂。采用共沉淀法等比掺入金属M后,催化剂的脱硝性能会发生改变。烟气脱硝主要副产物为
是一种脱硝性能较好的催化剂。采用共沉淀法等比掺入金属M后,催化剂的脱硝性能会发生改变。烟气脱硝主要副产物为 。主反应如下:
。主反应如下:反应Ⅰ.
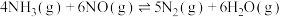
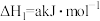
反应Ⅱ.
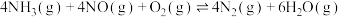
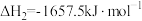
(1)已知:

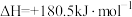 。则
。则
 。某条件下对于反应Ⅰ,
。某条件下对于反应Ⅰ, ,
,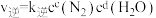 ,
, 、
、 为速率常数。升高温度时,
为速率常数。升高温度时, 增大m倍,
增大m倍, 增大n倍,则m
增大n倍,则m(2)将模拟烟气按一定的流量通入掺杂不同金属的催化剂,在不同温度下进行反应并测定相关物质浓度,得出不同情况下NO的转化率、
 的选择性、
的选择性、 的生成量随温度变化关系如下图。
的生成量随温度变化关系如下图。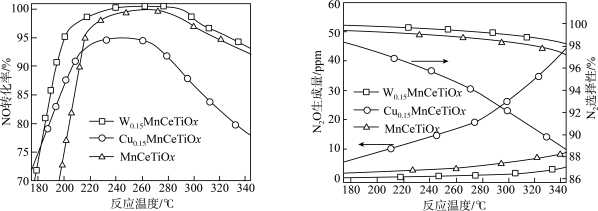
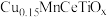 时,温度高于260℃时NO转化率下降的原因可能是
时,温度高于260℃时NO转化率下降的原因可能是②综合考虑应选择
 的平衡产率。
的平衡产率。③为探究氨的催化脱硝过程中生成
 的机理,将含有不同同位素原子的物质(
的机理,将含有不同同位素原子的物质(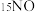 与
与 、
、 )通入反应容器进行一系列温度编程实验,通过质谱仪测定产物气体分子的含量随温度的变化曲线如下图。
)通入反应容器进行一系列温度编程实验,通过质谱仪测定产物气体分子的含量随温度的变化曲线如下图。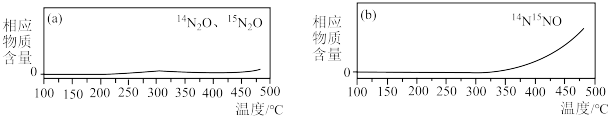
 与NO、
与NO、 反应生成
反应生成 的化学方程式为
的化学方程式为(3)当温度为273℃,在恒容密闭的容器中,假设仅发生两个主反应。通入
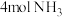 、
、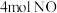 、
、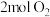 ,初始压强为
,初始压强为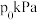 情况下,达到平衡后测定
情况下,达到平衡后测定 转化率为30%,平衡体系中
转化率为30%,平衡体系中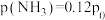 。则NO的转化率为
。则NO的转化率为
您最近半年使用:0次
名校
3 . Ⅰ. 甲醇是重要的化工原料,发展前景广阔。
温度为T1时,向容积为2L的密闭容器甲、乙中分别充入一定量的CO和H2O(g),发生反应:CO(g) + H2O(g)⇌CO2(g) + H2(g)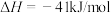 。相关数据如下:
。相关数据如下:
(1)甲容器中,反应在t1 min 内的平均速率v(H2)= ___________ mol/(L·min)。
(2)甲容器中,平衡时,反应放出的热量___________ kJ。
(3)T1时,反应的平衡常数K甲=___________ 。
(4)乙容器中,a=___________ mol。
II.已知:①N2(g)+O2(g) ⇌2NO(g) △H1=+180kJ mol-1
mol-1
②C(s)+O2(g)=CO2(g) △H2=-393kJ mol-1
mol-1
③2C(s)+O2(g)=2CO(g) △H3=-221kJ mol-1
mol-1
(5)若某反应的平衡常数表达式为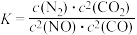 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:___________ 。
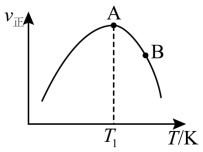
(6)欲研究在某催化剂作用下2CO(g)+2NO(g)⇌N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如下图所示,A、B两点对应温度下正反应速率变化的原因可能是___________ ,A、B两点对应温度下该反应的活化能Ea(A)___________ Ea(B)(填“>”或“<”)。 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数 =
=___________ 。
(8)用NH3可以消除NO污染:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(1),该反应速率v正=k正 c4(NH3)
c4(NH3) c6(NO),v逆=K逆
c6(NO),v逆=K逆 c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9
c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9 s-1,当平衡时NH3转化率为
s-1,当平衡时NH3转化率为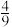 ,v逆=
,v逆=___________ mol L-1
L-1 s-1。
s-1。
温度为T1时,向容积为2L的密闭容器甲、乙中分别充入一定量的CO和H2O(g),发生反应:CO(g) + H2O(g)⇌CO2(g) + H2(g)
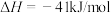 。相关数据如下:
。相关数据如下:| 容器 | 甲 | 乙 | ||
| 反应物 | CO | H2O | CO | H2O |
| 起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
| 平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
| 达到平衡的时间(min) | t1 | t2 | ||
(2)甲容器中,平衡时,反应放出的热量
(3)T1时,反应的平衡常数K甲=
(4)乙容器中,a=
II.已知:①N2(g)+O2(g) ⇌2NO(g) △H1=+180kJ
 mol-1
mol-1②C(s)+O2(g)=CO2(g) △H2=-393kJ
 mol-1
mol-1③2C(s)+O2(g)=2CO(g) △H3=-221kJ
 mol-1
mol-1(5)若某反应的平衡常数表达式为
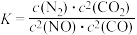 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:(6)欲研究在某催化剂作用下2CO(g)+2NO(g)⇌N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如下图所示,A、B两点对应温度下正反应速率变化的原因可能是
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数 =
=(8)用NH3可以消除NO污染:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(1),该反应速率v正=k正
 c4(NH3)
c4(NH3) c6(NO),v逆=K逆
c6(NO),v逆=K逆 c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9
c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9 s-1,当平衡时NH3转化率为
s-1,当平衡时NH3转化率为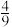 ,v逆=
,v逆= L-1
L-1 s-1。
s-1。
您最近半年使用:0次
名校
4 . 油气开采、石油化工、煤化工等行业的废气中普遍含有 ,需要对
,需要对 回收处理并加以利用。
回收处理并加以利用。
已知:①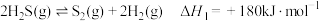
②
③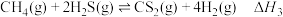
回答下列问题:
(1)反应③的
___________ 。
(2)下列叙述不能说明反应③达到平衡状态的是___________(填标号)。
(3)在不同温度、反应压强为 ,进料
,进料 的物质的量分数为
的物质的量分数为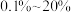 的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为
的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为___________ 。温度一定时,H2S的物质的量分数越大,H2S分解的平衡转化率越小,原因是___________ 。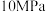 时,向恒压密闭容器中充入
时,向恒压密闭容器中充入 发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表
发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表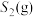 的是曲线
的是曲线___________ (填“I”“II”或“III”)。X点对应温度下,反应①的压强平衡常数
___________  。
。
(5)反应①的速率方程为 ,
,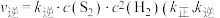 为速率常数)。
为速率常数)。
①某温度下,反应①的化学平衡常数K=10,k逆=3,则k正=___________ 。
②已知: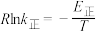 (式中,R为常数,
(式中,R为常数,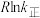 单位为
单位为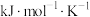 ,温度
,温度 单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度(
单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度( )关系如图3所示。相同条件下,催化效率较高的是
)关系如图3所示。相同条件下,催化效率较高的是___________ (填“Catl”或“Cat2”),判断依据是___________ 。在催化剂Cat2作用下,正反应的活化能为___________  。
。
 ,需要对
,需要对 回收处理并加以利用。
回收处理并加以利用。已知:①
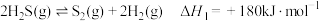
②

③
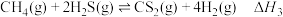
回答下列问题:
(1)反应③的

(2)下列叙述不能说明反应③达到平衡状态的是___________(填标号)。
A.断裂 键的同时断裂 键的同时断裂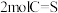 键 键 |
| B.恒容恒温条件下,反应体系的气体压强不再变化 |
| C.恒容条件下,反应体系的气体密度不再变化 |
D.反应速率: |
(3)在不同温度、反应压强为
 ,进料
,进料 的物质的量分数为
的物质的量分数为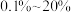 的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为
的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为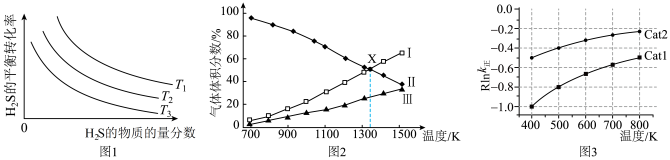
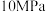 时,向恒压密闭容器中充入
时,向恒压密闭容器中充入 发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表
发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表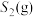 的是曲线
的是曲线
 。
。(5)反应①的速率方程为
 ,
,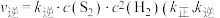 为速率常数)。
为速率常数)。①某温度下,反应①的化学平衡常数K=10,k逆=3,则k正=
②已知:
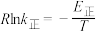 (式中,R为常数,
(式中,R为常数,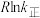 单位为
单位为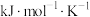 ,温度
,温度 单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度(
单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度( )关系如图3所示。相同条件下,催化效率较高的是
)关系如图3所示。相同条件下,催化效率较高的是 。
。
您最近半年使用:0次
名校
解题方法
5 . 在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应: ,已知反应平衡常数与温度的关系如下表,下列说法不正确的是
,已知反应平衡常数与温度的关系如下表,下列说法不正确的是
 ,已知反应平衡常数与温度的关系如下表,下列说法不正确的是
,已知反应平衡常数与温度的关系如下表,下列说法不正确的是| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A.上述生成Ni(CO)4的反应为放热反应 |
B.25℃时,反应 的逆反应平衡常数为2×10-5 的逆反应平衡常数为2×10-5 |
| C.80℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol∙L−1 |
D.80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol∙L−1,则此时 (正)> (正)> (逆) (逆) |
您最近半年使用:0次
名校
6 . 湿法提银工艺中,浸出的 需加入
需加入 进行沉淀。
进行沉淀。 与
与 可结合生成多种配合物,在水溶液中存在如下平衡:
可结合生成多种配合物,在水溶液中存在如下平衡:
I.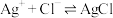 平衡常数
平衡常数 II.
II.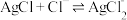 平衡常数
平衡常数
III. 平衡常数
平衡常数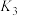 IV.
IV. 平衡常数
平衡常数
 时,平衡体系中含Ag微粒的分布系数
时,平衡体系中含Ag微粒的分布系数 随
随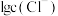 的变化曲线如图所示。已知;沉淀最彻底时,溶液中
的变化曲线如图所示。已知;沉淀最彻底时,溶液中 下列说法错误的是
下列说法错误的是
 需加入
需加入 进行沉淀。
进行沉淀。 与
与 可结合生成多种配合物,在水溶液中存在如下平衡:
可结合生成多种配合物,在水溶液中存在如下平衡:I.
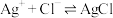 平衡常数
平衡常数 II.
II.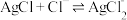 平衡常数
平衡常数
III.
 平衡常数
平衡常数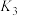 IV.
IV. 平衡常数
平衡常数
 时,平衡体系中含Ag微粒的分布系数
时,平衡体系中含Ag微粒的分布系数 随
随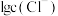 的变化曲线如图所示。已知;沉淀最彻底时,溶液中
的变化曲线如图所示。已知;沉淀最彻底时,溶液中 下列说法错误的是
下列说法错误的是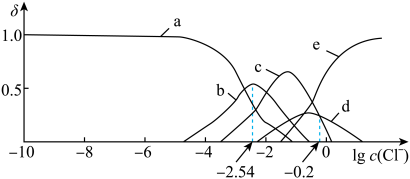
A.曲线a、b、c、d、e分别表示 、 、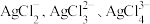 |
B. 时, 时, |
C. 时,平衡常数 时,平衡常数 |
D. 时,随着 时,随着 的不断加入,溶液中 的不断加入,溶液中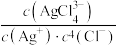 的比值保持不变 的比值保持不变 |
您最近半年使用:0次
7 . Ⅰ.工业上用CO生产燃料甲醇,一定条件下发生反应: 。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入4molH2和一定量的CO后,CO和
。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入4molH2和一定量的CO后,CO和 的浓度随时间变化。
的浓度随时间变化。
(1)在图1中,曲线________ (填“a”或“b”)表示使用了催化剂。
(2)该反应属于________ (填“吸热”或“放热”)反应。
(3)增大反应体系压强,则该反应化学平衡常数________ (填“增大”“减小”或“不变”)。根据图2计算该反应的化学平衡常数数值为K=________
Ⅱ.CuSO4溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用CuSO4溶液进行以下实验探究:
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________ (填字母)。
a.溶液中Cu2+向阳极移动
b.粗铜接电源正极,发生还原反应
c.电解后CuSO4溶液的浓度减小
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)图中,A是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在B中实现铁上镀铜:________ (填“CH4”或“O2),a处的电极反应式为________ 。
②当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为________ 。
 。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入4molH2和一定量的CO后,CO和
。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入4molH2和一定量的CO后,CO和 的浓度随时间变化。
的浓度随时间变化。 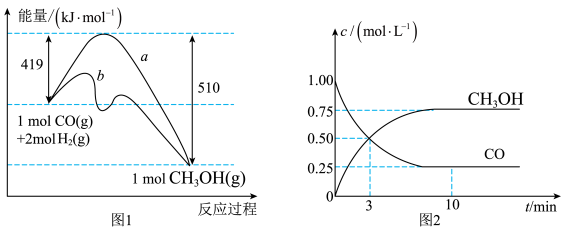
(1)在图1中,曲线
(2)该反应属于
(3)增大反应体系压强,则该反应化学平衡常数
Ⅱ.CuSO4溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用CuSO4溶液进行以下实验探究:
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
a.溶液中Cu2+向阳极移动
b.粗铜接电源正极,发生还原反应
c.电解后CuSO4溶液的浓度减小
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)图中,A是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在B中实现铁上镀铜:

②当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为
您最近半年使用:0次
名校
8 . 中国科学家首次实现了二氧化碳到淀粉的从头合成,CO2的捕集、利用与封存成为科学家研究的重要课题。
以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
I.CO2(g)+C2H6(g) C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)
C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)
II.C2H6(g) CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)
(1)反应I的反应历程可分为如下两步:
i. C2H6(g) C2H4(g)+H2(g) ΔH1 (反应速率较快)
C2H4(g)+H2(g) ΔH1 (反应速率较快)
ii. H2(g)+CO2(g) H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)
H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)
①∆H1=_______
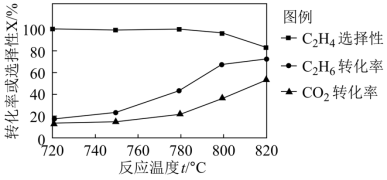
②相比于提高c(C2H6),提高c(CO2)对反应I速率影响更大,原因是_______ 。
(2)向恒压密闭容器中充入CO2和C2H6合成C2H4,发生主反应,温度对催化剂K-Fe-Mn/Si-2性能的影响如图所示,工业生产综合各方面的因素,反应选择800℃的原因是_______ 。 C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示: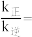
____ (用含有x的代数式表示);当温度升高时,k正增大m倍,k逆增大n倍,则m_____ n(填“>”、“<”或“=”)。
以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
I.CO2(g)+C2H6(g)
 C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)
C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)II.C2H6(g)
 CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)(1)反应I的反应历程可分为如下两步:
i. C2H6(g)
 C2H4(g)+H2(g) ΔH1 (反应速率较快)
C2H4(g)+H2(g) ΔH1 (反应速率较快)ii. H2(g)+CO2(g)
 H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)
H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)①∆H1=
②相比于提高c(C2H6),提高c(CO2)对反应I速率影响更大,原因是
(2)向恒压密闭容器中充入CO2和C2H6合成C2H4,发生主反应,温度对催化剂K-Fe-Mn/Si-2性能的影响如图所示,工业生产综合各方面的因素,反应选择800℃的原因是
 C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示: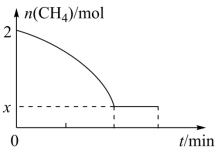
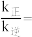
您最近半年使用:0次
名校
9 . 将等物质的量浓度等体积的甘氨酸溶液与盐酸混合,发生反应: ,取上述溶液(含0.04mol
,取上述溶液(含0.04mol  ),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以
),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以 的形式存在)。
的形式存在)。
 ,取上述溶液(含0.04mol
,取上述溶液(含0.04mol  ),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以
),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以 的形式存在)。
的形式存在)。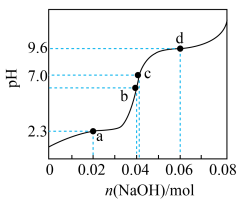
A. 中解离出 中解离出 的能力: 的能力: |
B.b点溶液pH<7,推测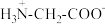 中 中 解离出 解离出 的程度大于-COO-水解的程度 的程度大于-COO-水解的程度 |
C.c点溶液中存在: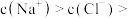 c( c(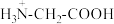 ) )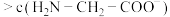 |
D.由d点可知: 的 的 |
您最近半年使用:0次
10 . 乙烯是世界上产量最大的化学产品之一,是合成纤维、合成橡胶基本化工原料。二氧化碳氧化乙烷脱氢制乙烯为生产乙烯提供了新途径。一定温度下, 与
与 在催化剂表面发生如下反应:
在催化剂表面发生如下反应:
Ⅰ.
Ⅱ.
Ⅲ.
Ⅳ.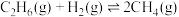
已知部分共价键的键能如下表所示:
回答下列问题:
(1)反应Ⅱ:

________  ,该反应的反应物和生成物中,属于
,该反应的反应物和生成物中,属于 杂化的原子种类有
杂化的原子种类有________ 种。
(2)用惰性气体与 混合作为反应气体时只发生反应Ⅰ:
混合作为反应气体时只发生反应Ⅰ: ,在923K、100kpa恒温恒压条件下,将
,在923K、100kpa恒温恒压条件下,将 的混合气体进行
的混合气体进行 脱氢反应,平衡时
脱氢反应,平衡时 的转化率为b,则该反应平衡常数
的转化率为b,则该反应平衡常数
________ kpa(用含a、b的代数式表示)。
(3)在一定条件下
 反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。
反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。
(4)反应Ⅱ:
 是提高乙烯产率的关键,但同时发生副反应Ⅲ。
是提高乙烯产率的关键,但同时发生副反应Ⅲ。
①为提高反应Ⅱ的平衡转化率,应选择的反应条件为________ 。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
②基于上述反应,在催化剂表面 与
与 发生脱氢制乙烯的总反应为:
发生脱氢制乙烯的总反应为: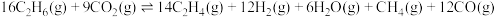 ,该反应温度常控制在600℃左右,其原因是
,该反应温度常控制在600℃左右,其原因是________ 。
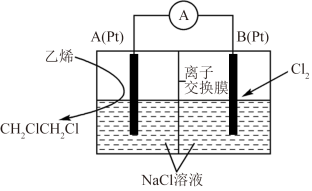
(5)乙烯氯化反应合成1,2-二氯乙烷电化学装置如图所示,A、B为多孔铂电极分别通入乙烯和氯气。A电极的电极反应式为________ ,离子交换膜为________ (填“阴离子”或“阳离子”)交换膜。
 与
与 在催化剂表面发生如下反应:
在催化剂表面发生如下反应:Ⅰ.

Ⅱ.

Ⅲ.

Ⅳ.
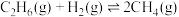
已知部分共价键的键能如下表所示:
共价键 | C-H | H-H | H-O | C=O |
键能 | 413 | 436 | 464 | 799 |
(1)反应Ⅱ:


 ,该反应的反应物和生成物中,属于
,该反应的反应物和生成物中,属于 杂化的原子种类有
杂化的原子种类有(2)用惰性气体与
 混合作为反应气体时只发生反应Ⅰ:
混合作为反应气体时只发生反应Ⅰ: ,在923K、100kpa恒温恒压条件下,将
,在923K、100kpa恒温恒压条件下,将 的混合气体进行
的混合气体进行 脱氢反应,平衡时
脱氢反应,平衡时 的转化率为b,则该反应平衡常数
的转化率为b,则该反应平衡常数
(3)在一定条件下

 反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。
反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。| A.正反应速率先增大后减小 | B.混合气体密度增大 |
| C.反应物的体积百分数增大 | D.化学平衡常数K值增大 |
(4)反应Ⅱ:

 是提高乙烯产率的关键,但同时发生副反应Ⅲ。
是提高乙烯产率的关键,但同时发生副反应Ⅲ。①为提高反应Ⅱ的平衡转化率,应选择的反应条件为
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
②基于上述反应,在催化剂表面
 与
与 发生脱氢制乙烯的总反应为:
发生脱氢制乙烯的总反应为: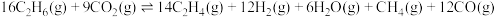 ,该反应温度常控制在600℃左右,其原因是
,该反应温度常控制在600℃左右,其原因是(5)乙烯氯化反应合成1,2-二氯乙烷电化学装置如图所示,A、B为多孔铂电极分别通入乙烯和氯气。A电极的电极反应式为
您最近半年使用:0次




