2024高三下·全国·专题练习
1 . 雾霾主要成分为灰尘、SO2、NOx和有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一、
(1)以臭氧为烟气脱硝剂时,脱硝过程涉及的反应之一为:2NO2(g)+O3(g)⇌N2O5(g)+O2(g)。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:
①T1___________ T2(填“<"、“>”或“无法确定”),该反应的 H
H___________ 0(填“<”或“>”)。
②0~25min内乙容器中反应的平均速率:v(NO2)=___________ 。
③T1温度下,混合气体的起始总压为p,则达到平衡时,NO2的转化率为___________ ,平衡常数Kp=___________ (以分压表示,分压=总压×物质的量分数)。
(1)以臭氧为烟气脱硝剂时,脱硝过程涉及的反应之一为:2NO2(g)+O3(g)⇌N2O5(g)+O2(g)。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:

| 容器 | 甲 | 乙 |
| 温度/K | T1 | T2 |
| 容积/L | 2 | |
| 起始充入量 | 4molNO2和2molO3 | |
 H
H②0~25min内乙容器中反应的平均速率:v(NO2)=
③T1温度下,混合气体的起始总压为p,则达到平衡时,NO2的转化率为
您最近半年使用:0次
2 . 工业上以1,4-丁二醇(BD)为原料催化脱氢制备γ-丁内酯(BL),其副反应产物为四氢呋喃( ,THF)、正丁醇(BuOH)以及其他四碳有机物。其他条件相同时,不同温度下,向1L容器中通入4×10-2molBD反应2h,测得BL、THF、BuOH在四碳有机产物中的物质的量分数如下:
,THF)、正丁醇(BuOH)以及其他四碳有机物。其他条件相同时,不同温度下,向1L容器中通入4×10-2molBD反应2h,测得BL、THF、BuOH在四碳有机产物中的物质的量分数如下:
| 温度/℃ | 220 | 240 | 250 | 255 |
| BL/% | 60.2 | 84.6 | 92.6 | 95.2 |
| THF/% | 1.2 | 1.8 | 1.9 | 2.1 |
| BuOH/% | 0.2 | 0.3 | 0.4 | 0.6 |
已知:HO(CH2)4OH(g,BD)
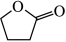 (g,BL)+2H2(g) ΔH>0
(g,BL)+2H2(g) ΔH>0
| A.220℃,2h时n(BL)=9.03×10-3mol,则BD的总转化率为37.5% |
| B.250℃,2h时n(BD)+n(BL)+n(THF)+n(BuOH)<4×10-2mol |
| C.255℃,2h时n(BL)=1.5×10-2mol,则0~2h内υ(H2)主反应=1.5×10-2mol·L−1·h−1 |
| D.由表中数据可知,220~255℃,催化剂活性、选择性均随着温度的升高而提高 |
您最近半年使用:0次
名校
3 . 已知反应2CH3OH(g) CH3OCH3(g)+H2O(g),某温度下的平衡常数为400。此温度下,在2L的密闭容器中充入amol CH3OH,反应到某时刻测得各组分的浓度如下表。下列说法错误的是
CH3OCH3(g)+H2O(g),某温度下的平衡常数为400。此温度下,在2L的密闭容器中充入amol CH3OH,反应到某时刻测得各组分的浓度如下表。下列说法错误的是
 CH3OCH3(g)+H2O(g),某温度下的平衡常数为400。此温度下,在2L的密闭容器中充入amol CH3OH,反应到某时刻测得各组分的浓度如下表。下列说法错误的是
CH3OCH3(g)+H2O(g),某温度下的平衡常数为400。此温度下,在2L的密闭容器中充入amol CH3OH,反应到某时刻测得各组分的浓度如下表。下列说法错误的是| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol/L) | 0.44 | 0.6 | 0.6 |
| A.a=1.64 |
| B.此时刻v正>v逆 |
| C.若起始时加入2amolCH3OH,则达到平衡时CH3OH的转化率不变 |
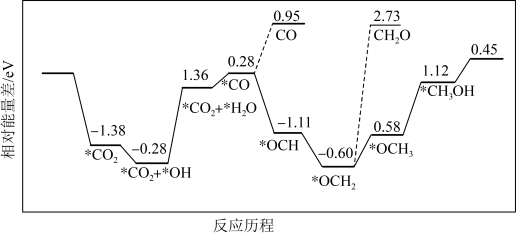
| D.CO2与H2合成原料甲醇反应历程如图所示,要使合成甲醇的反应速率加快,主要是降低*CO+*OH→*CO+*H2O的能量变化 |
您最近半年使用:0次
解题方法
4 . 某温度下,在2L恒容密闭容器中投入4mol 发生如下反应
发生如下反应
 有关数据如下:
有关数据如下:
下列说法错误的是
 发生如下反应
发生如下反应
 有关数据如下:
有关数据如下:| 时间段/min |  的平均生成速率/ 的平均生成速率/ |
| 0-1 | 0.4 |
| 0-2 | 0.3 |
| 0-3 | 0.2 |
A.30秒时, 的浓度大于 的浓度大于 |
B.0-1min内,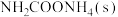 的反应速率为 的反应速率为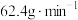 |
C.2min30秒时 物质的量等于2.8mol 物质的量等于2.8mol |
D.当 的体积百分数不变时,说明此反应达到了平衡状态 的体积百分数不变时,说明此反应达到了平衡状态 |
您最近半年使用:0次
解题方法
5 . 将氨水逐滴加入 的硫酸铜溶液中,测得混合液中五种微粒的物质的量分数
的硫酸铜溶液中,测得混合液中五种微粒的物质的量分数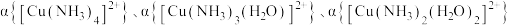 、
、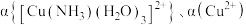 随
随 的变化曲线如图.下列说法正确的是
的变化曲线如图.下列说法正确的是
 的硫酸铜溶液中,测得混合液中五种微粒的物质的量分数
的硫酸铜溶液中,测得混合液中五种微粒的物质的量分数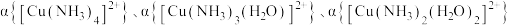 、
、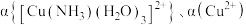 随
随 的变化曲线如图.下列说法正确的是
的变化曲线如图.下列说法正确的是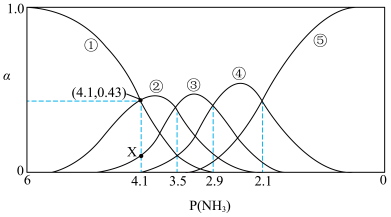
A.图中X点坐标为 |
B.曲线④表示 随 随 变化的曲线 变化的曲线 |
C. 值从小到大过程中, 值从小到大过程中,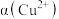 逐渐增大,溶液的蓝色逐渐变深 逐渐增大,溶液的蓝色逐渐变深 |
D.反应 的平衡常数 的平衡常数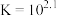 |
您最近半年使用:0次
名校
解题方法
6 . T℃时,往2L的恒容密闭容器中充入 ,发生反应
,发生反应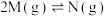 ,7min时仅改变某一条件,
,7min时仅改变某一条件, 的浓度随时间的变化曲线如图,下列说法正确的是
的浓度随时间的变化曲线如图,下列说法正确的是
 ,发生反应
,发生反应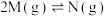 ,7min时仅改变某一条件,
,7min时仅改变某一条件, 的浓度随时间的变化曲线如图,下列说法正确的是
的浓度随时间的变化曲线如图,下列说法正确的是
| A.5min时,该反应的反应速率为零 |
B.7min时,改变的条件是再充入一部分 |
C.5min时,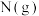 的体积分数约为28.6% 的体积分数约为28.6% |
D.7~10min内,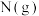 的平均反应速率 的平均反应速率 |
您最近半年使用:0次
7 .  分解的热化学方程式为
分解的热化学方程式为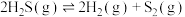
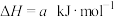 。向体积为1L恒容密闭容器中加入
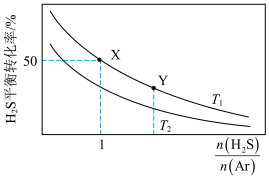
。向体积为1L恒容密闭容器中加入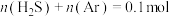 的混合气体(Ar不参与反应),测得不同温度(
的混合气体(Ar不参与反应),测得不同温度( )的平衡转化率随
)的平衡转化率随 比值的变化如图所示。下列说法正确的是
比值的变化如图所示。下列说法正确的是
 分解的热化学方程式为
分解的热化学方程式为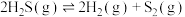
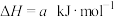 。向体积为1L恒容密闭容器中加入
。向体积为1L恒容密闭容器中加入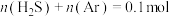 的混合气体(Ar不参与反应),测得不同温度(
的混合气体(Ar不参与反应),测得不同温度( )的平衡转化率随
)的平衡转化率随 比值的变化如图所示。下列说法正确的是
比值的变化如图所示。下列说法正确的是
| A.该反应的a<0 |
B.平衡常数 |
C. ,到达平衡时, ,到达平衡时, 的体积分数为 的体积分数为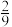 |
D.维持Y点时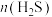 不变,向容器中充入Ar, 不变,向容器中充入Ar, 的平衡转化率减小 的平衡转化率减小 |
您最近半年使用:0次
解题方法
8 . 氮及其化合物与人们的生活生产密切相关。回答下列问题:
(1)微生物作用下,废水中的NH 可转化为NO
可转化为NO ,该反应分两步反应:
,该反应分两步反应:
Ⅰ步:2 NH (aq)+3O2(g)=2NO
(aq)+3O2(g)=2NO (aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/mol
(aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/mol
Ⅱ步:2NO (aq)+O2(g)=2NO
(aq)+O2(g)=2NO (aq) ΔH=-146 kJ/mol。
(aq) ΔH=-146 kJ/mol。
则低浓度氨氮废水中的NH (aq)氧化生成NO
(aq)氧化生成NO (aq)的热化学方程式为:NH
(aq)的热化学方程式为:NH (aq)+2O2(g)=2H+(aq)+H2 O(l)+NO
(aq)+2O2(g)=2H+(aq)+H2 O(l)+NO (aq) ΔH=
(aq) ΔH=___________ kJ/mol。
(2)氮与氧能形成多种二元化合物,这些化合物往往不稳定,其中NO2比较稳定。
已知可逆反应N2O4(g) 2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
α(N2O4)随温度的变化的正确曲线是___________ (填“i”或“ii”)。若该容器中通入N2O4的起始浓度为2mol/L,则a点温度下的平衡常数K=___________ 。若加入催化剂,图中的曲线会___________ (填“上移”、“下移”或“不移”)。
(3)机动车尾气是造成雾霾的主要因素之一,CO、NO在催化剂作用下可转化为无害气体:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
则反应温度高的容器是___________ (填“甲”或“乙”);甲容器中,0~120 min的速率v(N2)=___________ mol/(L·min),达到化学平衡后,乙容器中各物质均加倍,则平衡向___________ (“正反应”或“逆反应”)方向移动。
(4)500 ℃时,恒容密闭容器中通入1 mol N2和3 mol H2,模拟合成氨的反应,已知该反应放热,且随着反应的进行合成氨的正反应速率与NH3的体积分数的关系如下图所示,若升高温度再次达到平衡时,可能的点为___________ (从点“A、B、C、D”中选择)。
(1)微生物作用下,废水中的NH
 可转化为NO
可转化为NO ,该反应分两步反应:
,该反应分两步反应:Ⅰ步:2 NH
 (aq)+3O2(g)=2NO
(aq)+3O2(g)=2NO (aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/mol
(aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/molⅡ步:2NO
 (aq)+O2(g)=2NO
(aq)+O2(g)=2NO (aq) ΔH=-146 kJ/mol。
(aq) ΔH=-146 kJ/mol。则低浓度氨氮废水中的NH
 (aq)氧化生成NO
(aq)氧化生成NO (aq)的热化学方程式为:NH
(aq)的热化学方程式为:NH (aq)+2O2(g)=2H+(aq)+H2 O(l)+NO
(aq)+2O2(g)=2H+(aq)+H2 O(l)+NO (aq) ΔH=
(aq) ΔH=(2)氮与氧能形成多种二元化合物,这些化合物往往不稳定,其中NO2比较稳定。
已知可逆反应N2O4(g)
 2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
α(N2O4)随温度的变化的正确曲线是
(3)机动车尾气是造成雾霾的主要因素之一,CO、NO在催化剂作用下可转化为无害气体:2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:| t/min | 0 | 40 | 80 | 120 | 160 |
| n甲(CO)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n乙(CO)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
(4)500 ℃时,恒容密闭容器中通入1 mol N2和3 mol H2,模拟合成氨的反应,已知该反应放热,且随着反应的进行合成氨的正反应速率与NH3的体积分数的关系如下图所示,若升高温度再次达到平衡时,可能的点为

您最近半年使用:0次
解题方法
9 . 苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,常用如下反应来制备: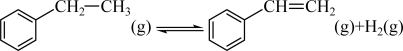 。在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1∶1、1∶4、1∶9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。
。在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1∶1、1∶4、1∶9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。
下列说法正确的是
 。在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1∶1、1∶4、1∶9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。
。在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1∶1、1∶4、1∶9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。| 10min | 20min | 30min | 40min | 50min | |
| 甲 | 20.5% | 39.0% | 54.5% | 60.0% | 60.0% |
| 乙 | 23.5% | 44.5% | 61.0% | 66.8% | x |
| 丙 | 25.0% | 45.5% | 63.8% | 74.0% | 80.0% |
A.20min内,乙苯的平均反应速率 从大到小的顺序是丙>乙>甲 从大到小的顺序是丙>乙>甲 |
| B.若其他条件不变,把容器甲改为恒容容器,则平衡转化率变小 |
C.T1℃时,该反应的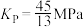 |
| D.50min时,容器丙中的反应已达到平衡状态 |
您最近半年使用:0次
10 . 氮及其化合物在工农业生产、生活中有着重要作用。
1.下列元素中电负性最大的是____。
2.NH3和PH3都具有四面体结构,NH3比PH3的分解温度高的原因是____。
3.配合物Ni(CO)4也具有四面体结构,常温下Ni(CO)4为液态,易溶于CCl4、苯等有机溶剂。写出基态Ni的电子排布式____ ;Ni(CO)4属于____ 晶体。
4.Zn(NH3)42+离子也具有四面体结构,Zn2+可提供4个能量最低的空轨道与NH3参与形成配位键,这4个空轨道是____。
氨在某催化剂作用下只发生如下反应:
主反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =-905kJ/mol
4NO(g)+6H2O(g) △H =-905kJ/mol
副反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H =-1268kJ/mol
2N2(g)+6H2O(g) △H =-1268kJ/mol
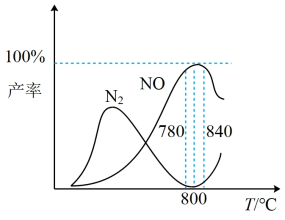
有关物质产率与温度的关系如图。
5.氮气被氧气氧化为NO的热化学方程式为_________ 。
6.工业上采用物料比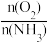 在1.7~2.0,主要目的是:
在1.7~2.0,主要目的是:______________ 。
7.下列说法正确的是______________ 。
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
C. 选择合适的催化剂,可以大幅度提高NO在最终产物中的比率
8.一定温度下,在3.0L密闭容器中,通入0.10molCH4和0.20molNO2进行反应,CH4(g)+2NO2(g) CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
表中数据计算0~4min内υ(NO2)=_________ 。
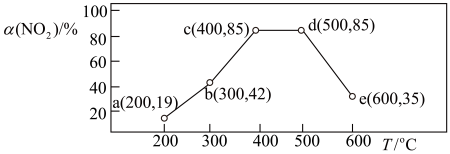
9.在一恒容密闭容器中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率 [α(NO2)/%] 如下图;c点___ (填“是”或“不是”)反应达平衡的点。d点之后,转化率随温度升高而降低的原因是___ 。
1.下列元素中电负性最大的是____。
| A.N | B.P | C.Si | D.C |
| A.NH3分子间有氢键 | B.NH3分子极性强 |
| C.N-H键键能大于P-H键 | D.氨极易液化 |
4.Zn(NH3)42+离子也具有四面体结构,Zn2+可提供4个能量最低的空轨道与NH3参与形成配位键,这4个空轨道是____。
| A.3p | B.3d | C.4s | D.4p |
氨在某催化剂作用下只发生如下反应:
主反应:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H =-905kJ/mol
4NO(g)+6H2O(g) △H =-905kJ/mol副反应:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H =-1268kJ/mol
2N2(g)+6H2O(g) △H =-1268kJ/mol有关物质产率与温度的关系如图。

5.氮气被氧气氧化为NO的热化学方程式为
6.工业上采用物料比
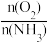 在1.7~2.0,主要目的是:
在1.7~2.0,主要目的是:7.下列说法正确的是
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
C. 选择合适的催化剂,可以大幅度提高NO在最终产物中的比率
8.一定温度下,在3.0L密闭容器中,通入0.10molCH4和0.20molNO2进行反应,CH4(g)+2NO2(g)
 CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:| 时间(t/min) | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强(p/100kPa) | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
9.在一恒容密闭容器中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率 [α(NO2)/%] 如下图;c点

您最近半年使用:0次



