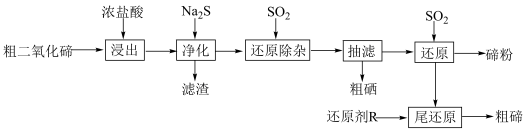
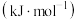1 . 碲(Te)是半导体、红外探测等领域的重要战略元素。从阳极泥或冶炼烟尘中提取的粗二氧化碲中含有SeO2、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
化学反应的吉布斯自由能变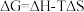 。SO2还原TeCl4和SeCl4的∆G随温度T的变化曲线如下图所示。则“还原除杂”步骤的温度不宜超过
。SO2还原TeCl4和SeCl4的∆G随温度T的变化曲线如下图所示。则“还原除杂”步骤的温度不宜超过_______ K,该步骤控制在此温度以下的原因是_______ 。
化学反应的吉布斯自由能变
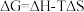 。SO2还原TeCl4和SeCl4的∆G随温度T的变化曲线如下图所示。则“还原除杂”步骤的温度不宜超过
。SO2还原TeCl4和SeCl4的∆G随温度T的变化曲线如下图所示。则“还原除杂”步骤的温度不宜超过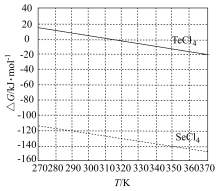
您最近半年使用:0次
名校
2 . 合成氨工业中有关催化剂的性质、作用的说法不正确的是
| A.合成氨反应若不使用催化剂,该反应就不能自发进行 |
| B.反应前后催化剂的质量和化学性质都不改变 |
| C.催化剂不能使化学平衡发生移动,但能缩短反应达到平衡所用的时间 |
| D.催化剂可以同等程度地改变正、逆反应速率 |
您最近半年使用:0次
名校
解题方法
3 . 我国含硫天然气资源丰富,甲烷与硫化氢重整制氢和天然气脱硫具有重要的现实意义。甲烷与硫化氢重整制氢反应为 ,其过程中反应ⅰ、ⅱ及其相对能量变化示意图为:
,其过程中反应ⅰ、ⅱ及其相对能量变化示意图为: 在
在_____ 下可自发进行。
A.高温 B.低温
在恒压条件下,起始时按 (同时通入一定量的
(同时通入一定量的 进行稀释,
进行稀释, 不参与反应)向某密闭容器中充入反应混合物,温度变化对平衡时反应混合物中
不参与反应)向某密闭容器中充入反应混合物,温度变化对平衡时反应混合物中 、
、 、
、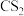 、
、 的物质的量分数
的物质的量分数 的影响如图所示:
的影响如图所示: 温度区间内,随温度升高,
温度区间内,随温度升高, 在平衡时反应混合物中含量迅速下降,而
在平衡时反应混合物中含量迅速下降,而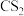 的含量几乎为0,根据图2分析其可能的原因是
的含量几乎为0,根据图2分析其可能的原因是_____ 。
(3)已知每1克 燃烧放热
燃烧放热 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_____ 。
 ,其过程中反应ⅰ、ⅱ及其相对能量变化示意图为:
,其过程中反应ⅰ、ⅱ及其相对能量变化示意图为: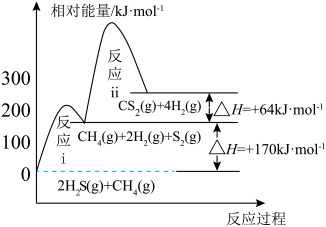
 在
在A.高温 B.低温
在恒压条件下,起始时按
 (同时通入一定量的
(同时通入一定量的 进行稀释,
进行稀释, 不参与反应)向某密闭容器中充入反应混合物,温度变化对平衡时反应混合物中
不参与反应)向某密闭容器中充入反应混合物,温度变化对平衡时反应混合物中 、
、 、
、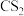 、
、 的物质的量分数
的物质的量分数 的影响如图所示:
的影响如图所示: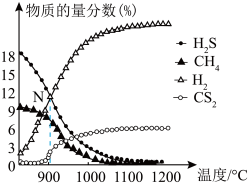
 温度区间内,随温度升高,
温度区间内,随温度升高, 在平衡时反应混合物中含量迅速下降,而
在平衡时反应混合物中含量迅速下降,而 的含量几乎为0,根据图2分析其可能的原因是
的含量几乎为0,根据图2分析其可能的原因是(3)已知每1克
 燃烧放热
燃烧放热 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为
您最近半年使用:0次
名校
4 . 氢气的制取与储存是氢能源利用领域的研究热点。CH4-H2O(g)催化重整制氢,主要反应如下:
反应I:CH4(g)+H2O(g)⇌3H2(g)+CO(g) ∆H1
反应Ⅱ:CH4(g)+2H2O(g) ⇌4H2(g)+CO2(g) ∆H2
反应Ⅲ:CO(g)+H2O(g) ⇌H2(g)+CO2(g) ∆H=-41.2kJ•mol-1
CH4-H2O(g)重整过程中自由能(∆G=∆H-T∆S,设∆H和∆S不随温度变化)随温度变化趋势如图1所示:
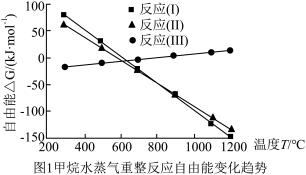
(1)反应Ⅱ焓变的符号:∆H2_______ 0(填“>”或“<”),理由是_______ 。
(2)上述反应体系在一定条件下达到平衡后,下列说法正确的是_______ 。
(3)反应Ⅲ的速率v=v正-v逆=k正c(CO)•c(H2O)-k逆c(CO2)•c(H2),其中k正、k逆分别为正、逆反应速率常数。升高温度时lgk正-lgk逆_______ (填“增大”“减小”或“不变”)。
(4)一定温度下,向恒容密闭反应器中通入CH4和H2O(g),起始时CH4和H2O(g)的分压分别为2MPa、6MPa,发生反应I、Ⅱ、Ⅲ。反应进行t1min时达到平衡状态,此时CO、CO2的分压分别为aMPa、bMPa。
①H2O(g)的平衡分压为_______ MPa(用含a、b的代数式表示,下同)。
②反应I的Kp=_______ (用平衡时各物质的分压代替物质的量浓度)。
(5)70~80℃,利用HCO 与HCOO-的相互转化实现H2的储存与释放,其释放H2的一种机理如图1所示,该过程中使用的Pd/Ag/TiO2复合催化剂的结构及各部分所带电荷如图2所示。
与HCOO-的相互转化实现H2的储存与释放,其释放H2的一种机理如图1所示,该过程中使用的Pd/Ag/TiO2复合催化剂的结构及各部分所带电荷如图2所示。
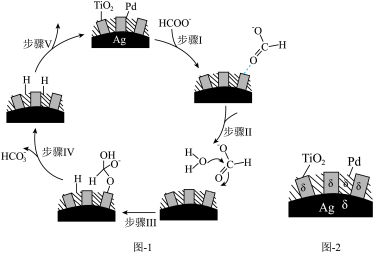
①写出释氢反应的离子方程式:_______ 。
②根据元素电负性的变化规律,步骤I、Ⅱ可以描述为_______ 。
反应I:CH4(g)+H2O(g)⇌3H2(g)+CO(g) ∆H1
反应Ⅱ:CH4(g)+2H2O(g) ⇌4H2(g)+CO2(g) ∆H2
反应Ⅲ:CO(g)+H2O(g) ⇌H2(g)+CO2(g) ∆H=-41.2kJ•mol-1
CH4-H2O(g)重整过程中自由能(∆G=∆H-T∆S,设∆H和∆S不随温度变化)随温度变化趋势如图1所示:

(1)反应Ⅱ焓变的符号:∆H2
(2)上述反应体系在一定条件下达到平衡后,下列说法正确的是
| A.及时分离出二氧化碳,可以使得反应I的正反应速率增大 |
| B.降低温度,反应I逆向移动,反应Ⅲ正向移动 |
| C.加入反应Ⅲ的催化剂,可以降低该反应的活化能和反应热 |
| D.增大水蒸气的浓度,有利于提高甲烷的平衡转化率 |
(4)一定温度下,向恒容密闭反应器中通入CH4和H2O(g),起始时CH4和H2O(g)的分压分别为2MPa、6MPa,发生反应I、Ⅱ、Ⅲ。反应进行t1min时达到平衡状态,此时CO、CO2的分压分别为aMPa、bMPa。
①H2O(g)的平衡分压为
②反应I的Kp=
(5)70~80℃,利用HCO
 与HCOO-的相互转化实现H2的储存与释放,其释放H2的一种机理如图1所示,该过程中使用的Pd/Ag/TiO2复合催化剂的结构及各部分所带电荷如图2所示。
与HCOO-的相互转化实现H2的储存与释放,其释放H2的一种机理如图1所示,该过程中使用的Pd/Ag/TiO2复合催化剂的结构及各部分所带电荷如图2所示。
①写出释氢反应的离子方程式:
②根据元素电负性的变化规律,步骤I、Ⅱ可以描述为
您最近半年使用:0次
5 . 以羰基化合物为载体运用化学平衡分离、提纯某纳米级活性铁粉,反应原理为 装置如下:
装置如下:
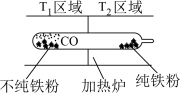
已知温度: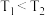 .对于该过程理解不正确的是
.对于该过程理解不正确的是
 装置如下:
装置如下:
已知温度:
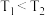 .对于该过程理解不正确的是
.对于该过程理解不正确的是A. 为放热反应 为放热反应 |
B. 是以 是以 为中心原子, 为中心原子, 为配体的配合物 为配体的配合物 |
C.工作时, 区域和 区域和 区域发生反应的平衡常数互为倒数关系 区域发生反应的平衡常数互为倒数关系 |
D. ,温度升高,反应 ,温度升高,反应 增大 增大 |
您最近半年使用:0次
6 . 一氯甲烷主要用于生产甲基氯硅烷,一氯乙烯主要用于生产聚氯乙烯等高聚物,1,2-二氯乙烷常用作有机溶剂和化工原料。回答下列问题:
I.在加热或光照条件下,“甲烷一氯气”法得到一氯甲烷是按自由基机理进行的,即CH4(g)+Cl2(g) CH3Cl(g)+HCl(g) △H。该反应涉及两个基元步骤①②,其相对能量一反应历程图如图:
CH3Cl(g)+HCl(g) △H。该反应涉及两个基元步骤①②,其相对能量一反应历程图如图:
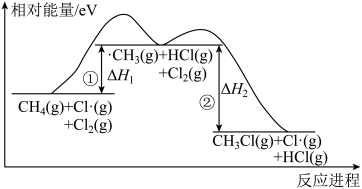
(1)已知H3C-H键能为4.56eV,H-Cl键能为4.46eV,1eV相当于96.5kJ/mol。则步骤①的焓变△H1=_______ kJ/mol;一氯取代反应的总焓变△H=______ (用△H1、△H2表示)。
Ⅱ.一氯乙烯(CH2=CHC1)的工业生产方法之一是乙烯氯化裂解法,该方法分以下两个过程进行:
乙烯氯化加成:CH2=CH2(g)+Cl2(g) ClCH2CH2Cl(g) △H1=-171.7kJ/mol
ClCH2CH2Cl(g) △H1=-171.7kJ/mol
1,2-二氯乙烷裂解:ClCH2CH2Cl(g) CH2=CHCl(g)+HCl(g) △H2=+73.4kJ/mol
CH2=CHCl(g)+HCl(g) △H2=+73.4kJ/mol
(2)乙烯氯化加成反应在热力学上进行的趋势很大,原因是______ 。1,2-二氯乙烷裂解反应的△S=+145.7J mol/K,则该裂解反应能自发进行的最低温度约为
mol/K,则该裂解反应能自发进行的最低温度约为______ K(保留整数)。
(3)在某恒压密闭容器中通入一定量的ClCH2CH2Cl(g),仅发生1,2-二氯乙烷裂解生成氯乙烯和氯化氢,实验测得ClCH2CH2Cl(g)的转化率随温度和反应时间的关系如图所示。

①T1、T2、T3的大小关系为_______ ,原因是_______ 。
②若M点刚好达到平衡状态,则N点的v正_____ v逆(填“大于”“小于”或“等于”)。Ka是以物质的量分数表示的平衡常数,则T2温度下1,2-二氯乙烷裂解生成氯乙烯和氯化氢的反应的Kx=_____ 保留2位小数)。
Ⅲ.一种电化学合成1,2-二氯乙婉的实验装置如图所示
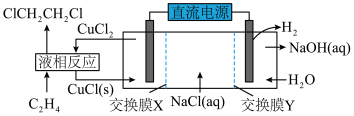
(4)交换膜X是______ 离子交换膜(填“阴”或“阳”),该实验装置合成1,2-二氯乙烷的总反应的化学方程式为______ 。
I.在加热或光照条件下,“甲烷一氯气”法得到一氯甲烷是按自由基机理进行的,即CH4(g)+Cl2(g)
 CH3Cl(g)+HCl(g) △H。该反应涉及两个基元步骤①②,其相对能量一反应历程图如图:
CH3Cl(g)+HCl(g) △H。该反应涉及两个基元步骤①②,其相对能量一反应历程图如图:
(1)已知H3C-H键能为4.56eV,H-Cl键能为4.46eV,1eV相当于96.5kJ/mol。则步骤①的焓变△H1=
Ⅱ.一氯乙烯(CH2=CHC1)的工业生产方法之一是乙烯氯化裂解法,该方法分以下两个过程进行:
乙烯氯化加成:CH2=CH2(g)+Cl2(g)
 ClCH2CH2Cl(g) △H1=-171.7kJ/mol
ClCH2CH2Cl(g) △H1=-171.7kJ/mol1,2-二氯乙烷裂解:ClCH2CH2Cl(g)
 CH2=CHCl(g)+HCl(g) △H2=+73.4kJ/mol
CH2=CHCl(g)+HCl(g) △H2=+73.4kJ/mol(2)乙烯氯化加成反应在热力学上进行的趋势很大,原因是
 mol/K,则该裂解反应能自发进行的最低温度约为
mol/K,则该裂解反应能自发进行的最低温度约为(3)在某恒压密闭容器中通入一定量的ClCH2CH2Cl(g),仅发生1,2-二氯乙烷裂解生成氯乙烯和氯化氢,实验测得ClCH2CH2Cl(g)的转化率随温度和反应时间的关系如图所示。

①T1、T2、T3的大小关系为
②若M点刚好达到平衡状态,则N点的v正
Ⅲ.一种电化学合成1,2-二氯乙婉的实验装置如图所示

(4)交换膜X是
您最近半年使用:0次
2024-03-18更新
|
109次组卷
|
2卷引用:河北省石家庄市辛集中学、衡水中学2023-2024高三上学期期末联考化学试题
7 . 丙烷价格低廉且产量大,而丙烯及其衍生物具有较高的经济附加值,因此丙烷脱氢制丙烯具有重要的价值。
已知下列反应的热化学方程式:
①直接脱氢: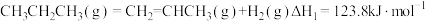
②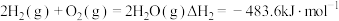
③ 氧化脱氢:
氧化脱氢:
(1)反应①_______正向自发进行。
(2)计算反应③的
_______ 。
(3)已知下列键能数据,结合反应①数据,计算 的键能是
的键能是_______ 。
(4)研究人员尝试利用 氧化丙烷脱氢制丙烯,与
氧化丙烷脱氢制丙烯,与 氧化丙烷脱氢制丙烯相比,使用
氧化丙烷脱氢制丙烯相比,使用 氧化丙烷脱氢制丙烯的优点是
氧化丙烷脱氢制丙烯的优点是_______ 。
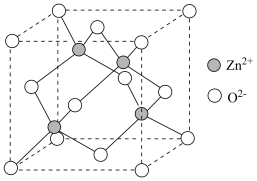
(5)一种基于 的锌基催化剂可高效催化丙烷转化为丙烯,立方
的锌基催化剂可高效催化丙烷转化为丙烯,立方 的晶胞如图所示,晶胞的边长为
的晶胞如图所示,晶胞的边长为 。每个
。每个 晶胞中
晶胞中 的数目为
的数目为_______ 个,晶体的密度
_______  。(设
。(设 为阿伏加德罗常数,用含
为阿伏加德罗常数,用含 的代数式表示,
的代数式表示, )。
)。
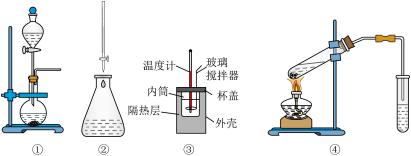
(6)下列实验装置使用不正确的是_______。
碰撞理论指出,一定温度下,气体的平均能量一定,但每个气体分子的能量大小不同
(7)标准状况下,恒容密闭容器内不同分子的能量与数目的分布情况如下图表示,其中阴影部分代表活化分子:
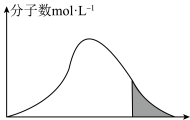
若升高温度,图像将最有可能变成(选填下图中的序号,下同)_______ ;若再继续充入适量气体,图像将最有可能变成_______ 。
A. B.
B.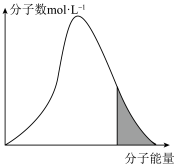 C.
C.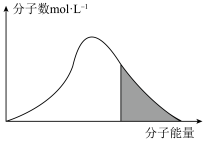
电解尿素是一种低能耗制 的方法,总反应:
的方法,总反应: 。
。

(8)写出b电极的电极方程式_______ 。
(9)已知尿素中 元素为
元素为 价,一段时间后在
价,一段时间后在 电极收集到标准状况下
电极收集到标准状况下 气体,则整个电路中转移的电子数为
气体,则整个电路中转移的电子数为_______ 个。
已知下列反应的热化学方程式:
①直接脱氢:
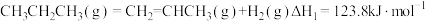
②
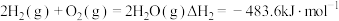
③
 氧化脱氢:
氧化脱氢:
(1)反应①_______正向自发进行。
| A.低温下能 | B.高温下能 | C.任何温度下都能 | D.任何温度下都不能 |
(2)计算反应③的

(3)已知下列键能数据,结合反应①数据,计算
 的键能是
的键能是化学键 |
|
|
|
键能 | 347.7 | 413.4 | 436.0 |
(4)研究人员尝试利用
 氧化丙烷脱氢制丙烯,与
氧化丙烷脱氢制丙烯,与 氧化丙烷脱氢制丙烯相比,使用
氧化丙烷脱氢制丙烯相比,使用 氧化丙烷脱氢制丙烯的优点是
氧化丙烷脱氢制丙烯的优点是(5)一种基于
 的锌基催化剂可高效催化丙烷转化为丙烯,立方
的锌基催化剂可高效催化丙烷转化为丙烯,立方 的晶胞如图所示,晶胞的边长为
的晶胞如图所示,晶胞的边长为 。每个
。每个 晶胞中
晶胞中 的数目为
的数目为
 。(设
。(设 为阿伏加德罗常数,用含
为阿伏加德罗常数,用含 的代数式表示,
的代数式表示, )。
)。
(6)下列实验装置使用不正确的是_______。

| A.图①装置用于二氧化锰和浓盐酸反应制氯气 |
| B.图②装置用于标准酸溶液滴定未知碱溶液 |
| C.图③装置用于测定中和反应的反应热 |
| D.图④装置用于制备乙酸乙酯 |
碰撞理论指出,一定温度下,气体的平均能量一定,但每个气体分子的能量大小不同
(7)标准状况下,恒容密闭容器内不同分子的能量与数目的分布情况如下图表示,其中阴影部分代表活化分子:

若升高温度,图像将最有可能变成(选填下图中的序号,下同)
A.
 B.
B. C.
C.
电解尿素是一种低能耗制
 的方法,总反应:
的方法,总反应: 。
。
(8)写出b电极的电极方程式
(9)已知尿素中
 元素为
元素为 价,一段时间后在
价,一段时间后在 电极收集到标准状况下
电极收集到标准状况下 气体,则整个电路中转移的电子数为
气体,则整个电路中转移的电子数为
您最近半年使用:0次
名校
8 . 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为:N2(g)+3H2(g)⇌2NH3(g) ∆H=-92.4kJ·mol-1 ∆S=-200J·K-1·mol-1。回答下列问题:
(1)合成氨反应在常温下_______ (填“能”或“不能”)自发。
(2)_______ 温(填“高”或“低”,下同)有利于提高反应速率,_______ 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用 。
。
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
(3)方案二: 复合催化剂。
复合催化剂。

下列说法正确的是_______ 。
a. 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为: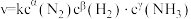 ,根据表中数据,
,根据表中数据,
_______ ;
在合成氨过程中,需要不断分离出氨的原因为_______ 。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
(5)在初始压强为20MPa、450℃、容积恒定、催化剂条件下发生合成氨反应,按物质的量比值n(N2):n(H2)=1:3充入反应物,氢气的平衡转化率为60%,则Kp=_______ (保留三位小数)。
(1)合成氨反应在常温下
(2)
 。
。针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
(3)方案二:
 复合催化剂。
复合催化剂。
下列说法正确的是
a.
 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为:
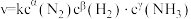 ,根据表中数据,
,根据表中数据,
| 实验 | 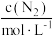 | 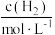 |  | 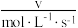 |
| 1 | m | n | p | q |
| 2 | 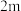 | n | p |  |
| 3 | m | n |  | 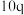 |
| 4 | m |  | p | 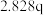 |
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
(5)在初始压强为20MPa、450℃、容积恒定、催化剂条件下发生合成氨反应,按物质的量比值n(N2):n(H2)=1:3充入反应物,氢气的平衡转化率为60%,则Kp=
您最近半年使用:0次
9 . 磷酸二氢钾在工农业生产及国防工业等领域都有广泛的应用。某研究小组用 的磷酸与
的磷酸与 反应制备
反应制备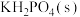 ,反应方程式为:
,反应方程式为: ,一定条件下的实验结果如图所示(忽略溶液体积变化)。
,一定条件下的实验结果如图所示(忽略溶液体积变化)。
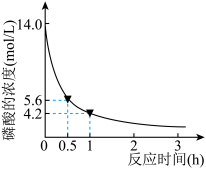
回答问题:
(1)该条件下, 内,用
内,用 表示的反应速率为
表示的反应速率为_______ 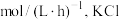 的转化率为
的转化率为_______  。
。
(2)若该反应仅在一定条件下自发进行,则该反应为_______ (选填“吸热”或“放热”)反应。
(3)向系统中不断通入水蒸气可以提高原料转化率的原因是:_______ 。
(4) 时,
时, 的平衡常数
的平衡常数
_______ 。(已知 的
的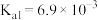 )
)
 的磷酸与
的磷酸与 反应制备
反应制备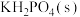 ,反应方程式为:
,反应方程式为: ,一定条件下的实验结果如图所示(忽略溶液体积变化)。
,一定条件下的实验结果如图所示(忽略溶液体积变化)。
回答问题:
(1)该条件下,
 内,用
内,用 表示的反应速率为
表示的反应速率为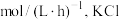 的转化率为
的转化率为 。
。(2)若该反应仅在一定条件下自发进行,则该反应为
(3)向系统中不断通入水蒸气可以提高原料转化率的原因是:
(4)
 时,
时, 的平衡常数
的平衡常数
 的
的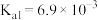 )
)
您最近半年使用:0次
10 . CO2的资源化利用能有效减少CO2排放,对碳循环经济技术的发展具有重要意义。
I.利用CO2和CH4制备合成气(CO、H2),反应分两步进行:[其中C(ads)为吸附性活性炭]
反应① CH4(g) C(ads)+2H2(g)
C(ads)+2H2(g)  >0
>0
反应② C(ads)+CO2(g) 2CO(g)
2CO(g)  >0
>0
(1)研究表明,总反应速率由反应①决定,在图a上画出有关物质的相对能量与反应历程的变化(起始已给出)___________ :
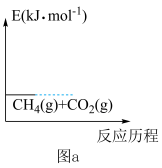
(2)判断总反应CH4(g)+CO2(g) 2CO(g)+2H2(g)自发进行的条件并说明理由
2CO(g)+2H2(g)自发进行的条件并说明理由___________ 。
II.工业上可利用CO2生产燃料甲醇。该过程发生下列反应:
反应③ CO2(g)+3H2(g) CH3OH(g)+H2O
CH3OH(g)+H2O  =-49.5kJ·mol-1
=-49.5kJ·mol-1
反应④ CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)  =+41.2kJ·mol-l
=+41.2kJ·mol-l
在4MPa的恒压反应器中,按照n(CO2):n(H2)=1∶3投料,测得体系中平衡时CH3OH和CO的选择性[S(CO)= ,S(CH3OH)=
,S(CH3OH)=  ]及CO2的平衡转化率随温度的变化如图b所示。
]及CO2的平衡转化率随温度的变化如图b所示。
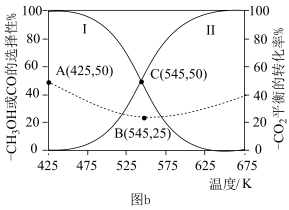
(3)研究表明,增大压强可降低CO的选择性,说明其可能的原因:___________ 。
(4)下列说法正确的是___________。
(5)反应④在545K时的平衡常数K=___________ 。
I.利用CO2和CH4制备合成气(CO、H2),反应分两步进行:[其中C(ads)为吸附性活性炭]
反应① CH4(g)
 C(ads)+2H2(g)
C(ads)+2H2(g)  >0
>0反应② C(ads)+CO2(g)
 2CO(g)
2CO(g)  >0
>0(1)研究表明,总反应速率由反应①决定,在图a上画出有关物质的相对能量与反应历程的变化(起始已给出)

(2)判断总反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)自发进行的条件并说明理由
2CO(g)+2H2(g)自发进行的条件并说明理由II.工业上可利用CO2生产燃料甲醇。该过程发生下列反应:
反应③ CO2(g)+3H2(g)
 CH3OH(g)+H2O
CH3OH(g)+H2O  =-49.5kJ·mol-1
=-49.5kJ·mol-1反应④ CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)  =+41.2kJ·mol-l
=+41.2kJ·mol-l在4MPa的恒压反应器中,按照n(CO2):n(H2)=1∶3投料,测得体系中平衡时CH3OH和CO的选择性[S(CO)=
 ,S(CH3OH)=
,S(CH3OH)=  ]及CO2的平衡转化率随温度的变化如图b所示。
]及CO2的平衡转化率随温度的变化如图b所示。
(3)研究表明,增大压强可降低CO的选择性,说明其可能的原因:
(4)下列说法正确的是___________。
| A.曲线II代表S(CO)随温度变化 |
| B.温度越低,越有利于工业生产CH3OH |
| C.上述反应条件下,CO2的平衡转化率始终高于H2的平衡转化率 |
| D.若向体系中充入惰性气体,将减慢CH3OH的生成速率并降低CH3OH的平衡产率 |
(5)反应④在545K时的平衡常数K=
您最近半年使用:0次