名校
1 . 25 ℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)H2S的一级电离常数表达式为Ka1=____________________
(2)CH3COOH、H2C2O4、H2S的酸性由强到弱的顺序________________________
(3)H2C2O4与少量的KOH溶液反应的化学方程式:_______________________
(4)NaHS溶液与NaHC2O4溶液反应的离子方程式:_______________________
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是__________ (填写序号)。
①反应所需要的时间B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A
⑤B中有锌剩余
| 化学式 | CH3COOH | H2C2O4 | H2S |
| 电离平衡常数 | 1.8×10-5 | Ka1=5.4×10-2 Ka2=5.4×10-5 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
请回答下列问题:
(1)H2S的一级电离常数表达式为Ka1=
(2)CH3COOH、H2C2O4、H2S的酸性由强到弱的顺序
(3)H2C2O4与少量的KOH溶液反应的化学方程式:
(4)NaHS溶液与NaHC2O4溶液反应的离子方程式:
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A
⑤B中有锌剩余
您最近一年使用:0次
2016-12-09更新
|
631次组卷
|
3卷引用:作业(十三) 电离平衡常数
12-13高二上·河南濮阳·期末
名校
2 . 常温下,向 100 mL0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
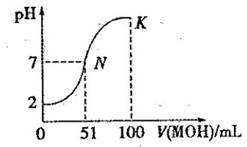
(1)由图中信息可知HA为_________ 酸(填“强”或“弱”),理由是________ 。
(2)常温下一定浓度的MA稀溶液的pH=a,则a_______ 7(填“>”、“<”或“=”),用离子方程式表示其原因:________________ ,此时,溶液中由水电离出的c(OH-)=_________ 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________________ 。
(4)K点对应的溶液中,c(M+)+c(MOH)__________ 2c(A-)(填“>”“<或“=”);若此时溶液的pH=10,则c(MOH)+c(OH-)=________ mol·L-1。

(1)由图中信息可知HA为
(2)常温下一定浓度的MA稀溶液的pH=a,则a
(3)请写出K点所对应的溶液中离子浓度的大小关系:
(4)K点对应的溶液中,c(M+)+c(MOH)
您最近一年使用:0次
2016-12-09更新
|
1550次组卷
|
17卷引用:同步君 选修4 第3章 第3节 盐类水解的影响因素
(已下线)同步君 选修4 第3章 第3节 盐类水解的影响因素高中化学人教版 选修四 第三章 水溶液中的离子反应 第三节 盐类的水解 盐类的水解第二课时(盐类的水解的影响因素和应用)鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时4 溶液中粒子浓度的大小关系人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时3 溶液中粒子浓度的大小关系选择性必修1(SJ)专题3第三单元课时3 溶液中粒子浓度的大小关系(已下线)3.3.1 盐类的水解-同步学习必备知识(已下线)2011-2012学年河南省濮阳市高二上学期期末考试化学试卷(已下线)2011-2012学年江西省丰城、樟树、高安中学高二上学期期末联考化学试卷2015-2016学年河南省周口市高二下期末化学试卷2016-2017学年江西省临川二中高二上期中化学试卷2016-2017学年河南省郑州市第一中学高二下学期入学测试理综化学试卷甘肃省武山一中2017-2018学年度高二上学期期末考试化学试题云南省临沧市双江县第一中学2019-2020学年高二上学期12月月考化学试题2020届高三化学一轮复习 三大守恒定律及离子浓度比较问题云南省红河县一中2020-2021学年高二下学期6月份考试化学试题四川省大竹中学2021-2022学年高二上学期期中达标测化学试题(基础卷)(已下线)第4讲 溶液中离子的浓度大小比较-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)
3 . 某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向_______ (填“正”、“逆”)反应方向移动。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向_______ (填“正向”、“逆向”、或“不移动”)移动,溶液pH将_______ 中(填“增大”、“减小”或“不变”),溶液中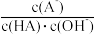 比值
比值_______ (填“增大”、“减小”或“不变”)。
(3)在25℃下,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH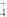 )=c(Cl-),则溶液呈中性,用含a的代数式表示NH3•H2O的电离常数Kb=
)=c(Cl-),则溶液呈中性,用含a的代数式表示NH3•H2O的电离常数Kb=_______ 。
 H++A-,回答下列问题:
H++A-,回答下列问题:(1)向溶液中加入适量NaA固体,以上平衡将向
(2)若向溶液中加入适量NaCl溶液,以上平衡将向
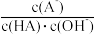 比值
比值(3)在25℃下,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH
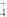 )=c(Cl-),则溶液呈中性,用含a的代数式表示NH3•H2O的电离常数Kb=
)=c(Cl-),则溶液呈中性,用含a的代数式表示NH3•H2O的电离常数Kb=
您最近一年使用:0次
2016-12-09更新
|
448次组卷
|
4卷引用:苏教版高三单元精练检测八化学试题
13-14高二·全国·课时练习
4 . 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示,请回答:
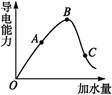
(1)“O”点导电能力为0的理由是______ 。
(2)A、B、C三点溶液c(H+)由小到大的顺序为______ 。
(3)若使C点溶液中c(CH3COO-)增大的同时溶液的c(H+)减小,可采取的措施是:①______ ;②______ ;③______ 。
(4)经实验测得C点处:c(CH3COOH)=0.1mol·L-1,c(CH3COO-)=0.01mol·L-1,则该条件下CH3COOH的电离常数Ka=______ 。

(1)“O”点导电能力为0的理由是
(2)A、B、C三点溶液c(H+)由小到大的顺序为
(3)若使C点溶液中c(CH3COO-)增大的同时溶液的c(H+)减小,可采取的措施是:①
(4)经实验测得C点处:c(CH3COOH)=0.1mol·L-1,c(CH3COO-)=0.01mol·L-1,则该条件下CH3COOH的电离常数Ka=
您最近一年使用:0次
2016-12-09更新
|
906次组卷
|
4卷引用:2014年高二化学人教版选修四 11弱电解质的电离练习卷
(已下线)2014年高二化学人教版选修四 11弱电解质的电离练习卷(已下线)2015安徽望江中学同步课时练(人教选修4)3.1弱电解质的电离试卷人教版高二选修4 第三章 第一节 弱电解质的电离练习题福建省莆田第十五中学2019-2020学年高二下学期期末考试化学试题
13-14高二·全国·课时练习
5 . 回答下列问题
(1)下列物质:①石墨 ②三氧化硫 ③液态氯化氢 ④氯气 ⑤熔融的硫酸钾 ⑥食盐晶体 ⑦硫酸溶液 ⑧乙醇 ⑨冰醋酸 ⑩NH3·H2O,其中能够导电的是___________ ,强电解质是___________ ,弱电解质是___________ ,非电解质是___________ 。
(2)H2S溶于水的电离方程式为___________ 。
①向H2S溶液中加入CuSO4溶液时,电离平衡向___________ 移动,c(H+)___________ ,c(S2-)___________ 。
②向H2S溶液中加入NaOH固体时,电离平衡向___________ 移动,c(H+)___________ ,c(S2-)___________ 。
③若将H2S溶液加热至沸腾,c(H2S)___________ 。
④若要增大H2S溶液中c(S2-),最好加入___________ 。
(1)下列物质:①石墨 ②三氧化硫 ③液态氯化氢 ④氯气 ⑤熔融的硫酸钾 ⑥食盐晶体 ⑦硫酸溶液 ⑧乙醇 ⑨冰醋酸 ⑩NH3·H2O,其中能够导电的是
(2)H2S溶于水的电离方程式为
①向H2S溶液中加入CuSO4溶液时,电离平衡向
②向H2S溶液中加入NaOH固体时,电离平衡向
③若将H2S溶液加热至沸腾,c(H2S)
④若要增大H2S溶液中c(S2-),最好加入
您最近一年使用:0次
13-14高三·全国·课时练习
名校
6 . 根据下列化合物:
①NaCl;②NaOH;③HCl;④NH4Cl;⑤CH3COONa;⑥CH3COOH;⑦NH3·H2O;⑧H2O
回答下列问题。
(1)NH4Cl溶液显_______ 性,用离子方程式表示原因_______ ,其溶液中离子浓度大小顺序为_______ 。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=_______ ,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_______ 。
(3)已知纯水中存在如下平衡:H2O+H2O H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是_______ (填字母序号)。
(4)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m_______ (填“<”、“>”或“=”)n。
(5)除⑧H2O外,若其余7种物质的溶液的物质的量浓度相同,则这7种物质的溶液按pH由大到小的顺序为_______ 。
①NaCl;②NaOH;③HCl;④NH4Cl;⑤CH3COONa;⑥CH3COOH;⑦NH3·H2O;⑧H2O
回答下列问题。
(1)NH4Cl溶液显
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=
(3)已知纯水中存在如下平衡:H2O+H2O
 H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是| A.向水中加入NaHSO4固体 |
| B.向水中加Na2CO3固体 |
| C.加热至100 ℃[其中c(H+)=1×10-6mol·L-1] |
| D.向水中加入(NH4)2SO4固体 |
(4)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m
(5)除⑧H2O外,若其余7种物质的溶液的物质的量浓度相同,则这7种物质的溶液按pH由大到小的顺序为
您最近一年使用:0次
2016-12-09更新
|
1128次组卷
|
5卷引用:2014年高考化学一轮复习课后规范训练8-3练习卷
9-10高三·江苏·阶段练习
解题方法
7 . 锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4]2+。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为__________ (用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式___________ 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是___________ 。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式_____________ 。试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因_______ 。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为
(2)写出锌和氢氧化钠溶液反应的化学方程式
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式
您最近一年使用:0次
12-13高二上·河南许昌·期末
8 . 在25℃时,对于0. 1mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中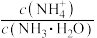 将
将____ (填“增大”、 “减小”或“不变”);
(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,此时溶液的pH____ 7(填“大于”、“小于”或“等于”),用离子方程式表示其原因___________ ,此时溶液中各离子浓度由大到小的顺序为___________________ ;
(3)若向氨水中加入0.05mol·L-1稀硫酸至溶液正好呈中性,所用氨水的体积V1与稀硫酸的体积V2的关系为V1_____ V2(填“大于”、“小于”或“等于”),写出溶液中各离子浓度之间满足的电荷守恒表达式为______________________________________ 。
(1)若向氨水中加入少量硫酸铵固体,此时溶液中
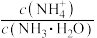 将
将(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,此时溶液的pH
(3)若向氨水中加入0.05mol·L-1稀硫酸至溶液正好呈中性,所用氨水的体积V1与稀硫酸的体积V2的关系为V1
您最近一年使用:0次
9 . H2S溶于水的电离方程式为_______________________ 。
(1)向H2S溶液中加入CuSO4溶液时,电离平衡向_______ (左或右,下同)移动,c(H+)_______ ,c(S2-)________ 。(填偏大、偏小、不变,下同)
(2)向H2S溶液中加入NaOH固体时,电离平衡向________ 移动,c(H+)_________ ,c(S2-)__________ 。
(3)若将H2S溶液加热至沸腾,c(H2S)____________ 。
(1)向H2S溶液中加入CuSO4溶液时,电离平衡向
(2)向H2S溶液中加入NaOH固体时,电离平衡向
(3)若将H2S溶液加热至沸腾,c(H2S)
您最近一年使用:0次
2016-12-09更新
|
440次组卷
|
2卷引用:人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第一节 电离平衡 课时1 弱电解质的电离平衡
10 . 现有十种物质:①水;②石墨;③氯气;④硫酸钡晶体;⑤醋酸;⑥二氧化碳;⑦氨水;⑧ 氯化钠固体;⑨熔化的氯化钠;⑩氯化钠溶液。请用序号按要求填空:
(1)其中能导电的是________
(2)属于强电解质的是____________ 属于弱电解质的是____________
(3)属于非电解质的是______
(4)既不是电解质也不是非电解质的是___________________ 。
(1)其中能导电的是
(2)属于强电解质的是
(3)属于非电解质的是
(4)既不是电解质也不是非电解质的是
您最近一年使用:0次



