名校
解题方法
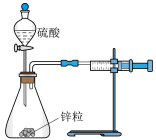
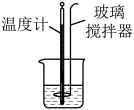
1 . 下列实验装置(部分夹持装置已略去)可以达到对应实验目的是
| A | B | C | D | |
| 实验目的 | 测定锌与稀硫酸反应速率 | 测定中和反应的反应热 | 比较 和 和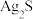 溶解度大小 溶解度大小 | 探究铁的析氢腐蚀 |
| 实验装置 |
|
|
|
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-27更新
|
97次组卷
|
16卷引用:湖南省宁乡市2022-2023学年高二上学期期末考试化学试题
湖南省宁乡市2022-2023学年高二上学期期末考试化学试题北京市西城区2021—2022学年高二上学期期末化学试题吉林省德惠市实验中学2022-2023学年高二上学期第三次月考化学试题吉林省长春市实验中学2022-2023学年高二上学期期末考试化学试题广东省广州市协和中学等3校2022-2023学年高二上学期(12月)期末考试化学试题北京师范大学第二附属中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属实验中学顺义学校2023-2024学年高二上学期12月月考化学试题 重庆市杨家坪中学2023-2024学年高二上学期第三次月考化学试题天津市南开区2023-2024学年高二上学期期末测试化学试题四川省射洪中学校2023-2024学年高二上学期第三次月考化学试题天津市重点校2023-2024学年高二上学期期末考试化学试题吉林省珲春市第二高级中学校2023-2024学年高二上学期期末考试化学试题四川省成都市锦江区嘉祥外国语高级中学2023-2024学年高二下学期期末考试化学试题天津市南开区2023-2024学年高二上学期期末考试化学试题宁夏银川市2023-2024学年高二上学期期末考试化学试卷 天津市2023-2024学年高二上学期重点校联考化学试题
2 . 工业上常用 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的
。通过调节溶液的 可使
可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 ,体系中
,体系中 、
、 、
、 、
、 浓度(mol/L)的负对数
浓度(mol/L)的负对数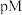 与
与 的关系如图所示。已知:
的关系如图所示。已知: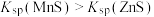 。下列说法错误的是
。下列说法错误的是
 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的
。通过调节溶液的 可使
可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 ,体系中
,体系中 、
、 、
、 、
、 浓度(mol/L)的负对数
浓度(mol/L)的负对数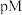 与
与 的关系如图所示。已知:
的关系如图所示。已知: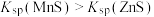 。下列说法错误的是
。下列说法错误的是
A.Ⅱ表示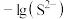 与 与 的关系曲线 的关系曲线 |
B. 点对应 点对应 的数量级为 的数量级为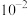 |
C.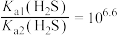 |
D.溶液中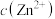 和 和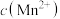 均为 均为 , , 完全沉淀时溶液的最小 完全沉淀时溶液的最小 为2(金属离子的浓度≤10-5mol/L可认为沉淀完全) 为2(金属离子的浓度≤10-5mol/L可认为沉淀完全) |
您最近一年使用:0次
2024-02-06更新
|
308次组卷
|
2卷引用:湖南省长沙市宁乡市第一高级中学2021届高三新高考第一次模拟考试化学试卷
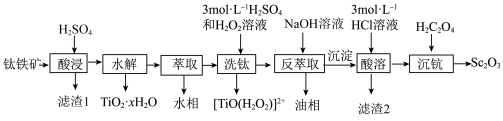
3 . 钪(Sc)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),还含有少量SiO2、Sc2O3等氧化物,从钛铁矿中提取Sc2O3的流程如下:
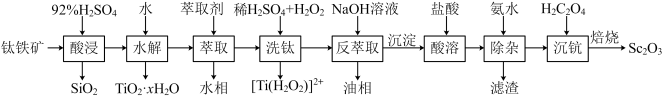
已知:①当离子浓度减小至10-5mol·L-1时可认为沉淀完全
②室温下,溶液中离子沉淀完全的pH如下表所示:
③lg2=0.3,Ksp[Sc(OH)3]=1.25×10-33。回答下列问题:
(1)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是___________ 。
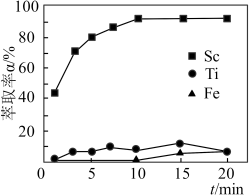
(2)“萃取”时,使用10%P2O4+5%TBP+煤油作为萃取剂,一定条件下萃取率α受振荡时间的影响如图,萃取时选择最佳的振荡时间为___________ min。
(3)若“酸溶”后滤液中Sc3+的浓度为0.01mol·L-1,则“除杂”过程中应控制的pH范围是___________ 。
(4)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为___________ 。

已知:①当离子浓度减小至10-5mol·L-1时可认为沉淀完全
②室温下,溶液中离子沉淀完全的pH如下表所示:
| 离子 | Fe3+ | Fe2+ | TiO2+ |
| 沉淀完全的pH | 3.2 | 9.0 | 1.05 |
(1)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是
(2)“萃取”时,使用10%P2O4+5%TBP+煤油作为萃取剂,一定条件下萃取率α受振荡时间的影响如图,萃取时选择最佳的振荡时间为

(3)若“酸溶”后滤液中Sc3+的浓度为0.01mol·L-1,则“除杂”过程中应控制的pH范围是
(4)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为
您最近一年使用:0次
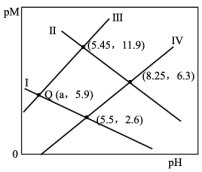
4 . 一定温度下, 和
和 的沉淀溶解平衡曲线如图所示
的沉淀溶解平衡曲线如图所示
 和
和 的沉淀溶解平衡曲线如图所示
的沉淀溶解平衡曲线如图所示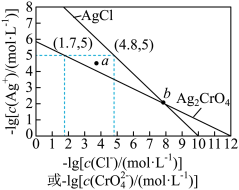
A.a点条件下能生成 沉淀,不能生成 沉淀,不能生成 沉淀 沉淀 |
B.b点时,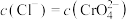 , ,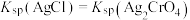 |
C.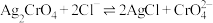 的平衡常数 的平衡常数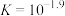 |
D.向 、 、 的混合溶液中滴加 的混合溶液中滴加 溶液,一定先产生 溶液,一定先产生 沉淀 沉淀 |
您最近一年使用:0次
2024-01-20更新
|
236次组卷
|
3卷引用:湖南省岳阳市岳阳县第一中学2025届高三上学期入学考试化学试题
名校
解题方法
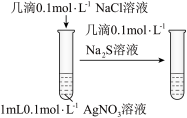
5 . 下列实验装置(部分夹持装置已略去)可以达到对应实验目的的是
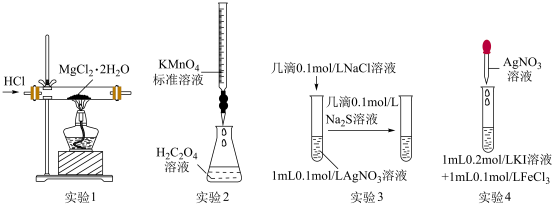
| A.实验1制取MgCl2 | B.实验2测定H2C2O4溶液的浓度 |
| C.实验3比较AgCl和Ag2S溶解度大小 | D.实验4验证Fe3+与I-的反应是可逆反应 |
您最近一年使用:0次
2024-01-14更新
|
289次组卷
|
4卷引用:湖南省常德市第一中学2023-2024学年高二上学期期末考试化学试题
6 .  时,用
时,用 溶液分别滴定等物质的量浓度的
溶液分别滴定等物质的量浓度的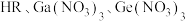 三种溶液pM[p表示负对数,
三种溶液pM[p表示负对数, 表示
表示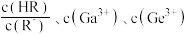 ]随溶液
]随溶液 变化的关系如图所示。已知:常温下,
变化的关系如图所示。已知:常温下,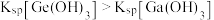 。下列推断正确的是
。下列推断正确的是
 时,用
时,用 溶液分别滴定等物质的量浓度的
溶液分别滴定等物质的量浓度的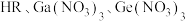 三种溶液pM[p表示负对数,
三种溶液pM[p表示负对数, 表示
表示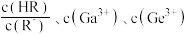 ]随溶液
]随溶液 变化的关系如图所示。已知:常温下,
变化的关系如图所示。已知:常温下,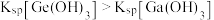 。下列推断正确的是
。下列推断正确的是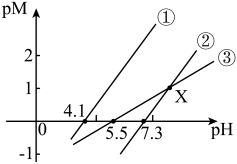
A.曲线③代表 与 与 的关系曲线 的关系曲线 |
B.调节 时,可将废水中 时,可将废水中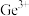 完全沉淀 完全沉淀 |
C.滴定 溶液至X点时,溶液中: 溶液至X点时,溶液中: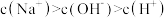 |
D.经计算,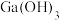 能完全溶于HR溶液 能完全溶于HR溶液 |
您最近一年使用:0次
2024-01-13更新
|
632次组卷
|
9卷引用:湖南省长沙市长郡中学2023-2024学年高三上学期月考(四)化学试题
湖南省长沙市长郡中学2023-2024学年高三上学期月考(四)化学试题山东省齐鲁名校2022-2023学年高三下学期3月大联考化学试题黑龙江省哈尔滨市重点三校(哈九中、哈六中、哈一中)2023-2024学年高三上学期期末联考化学试题题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)黑龙江省哈尔滨市重点三校(哈九中、哈六中、哈一中)2023-2024学年高三上学期 期末化学试卷河南省信阳高级中学2023-2024学年高三下学期3月月考理综试题-高中化学(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届河南省许昌市部分学校高三下学期高考冲刺(一)理科综合试题-高中化学黑龙江省哈尔滨市重点三校(哈九中、哈六中、哈一中)2023-2024学年高三上学期期末联考化学试题
7 . 下列有关电解质溶液的说法正确的是
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小 减小 |
B.将CH3COONa溶液从20℃升温至30℃,溶液中 增大 增大 |
C.向盐酸中加入氨水至中性,溶液中 >1 >1 |
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中 不变 不变 |
您最近一年使用:0次
2024-01-12更新
|
107次组卷
|
45卷引用:湖南省雅礼中学2020-2021学年高二上学期第三次月考化学试题
湖南省雅礼中学2020-2021学年高二上学期第三次月考化学试题湖南省岳阳市华容县2022-2023学年高二上学期期末考试化学试题四川省遂宁市船山区第二中学校2019-2020学年高二下学期期中考试化学试题福建省福清市龙西中学2018-2019学年高二下学期期中考试化学试题广西北流市实验中学2019-2020学年高二下学期期中考试理科综合化学试题广东省湛江市2019-2020学年高二上学期期末考试化学试题黑龙江省伊春市伊美区第二中学2019-2020学年高二上学期第一次月考化学试题(已下线)第03章 水溶液中的离子平衡(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)福建省泰宁第一中学2020届高三上学期第一阶段考试化学试题山西省运城市新绛中学2021届高三上学期8月月考化学试题重庆市万州第二高级中学2020-2021学年高二上学期10月月考化学试题内蒙古通辽市开鲁县第一中学2021届高三上学期第二次阶段性考试化学试题四川省成都实验中学2021届高三上学期10月月考理综化学试题福建师范大学第二附属中学2019-2020学年高二上学期期末考试化学试题重庆市第二十九中学2020-2021学年高二10月月考化学试题四川省邻水实验学校2020-2021学年高二上学期第三阶段考试化学试题山西省运城市临猗县临晋中学2020-2021学年高二上学期12月月考化学试题宁夏银川市长庆高级中学2020-2021学年高二上学期期末考试化学试题福建省莆田第一中学2020-2021学年高二上学期期末考试化学试题云南省保山第九中学2021届高三上学期开学考试化学试题江苏省苏州工业园区星海实验中学2019-2020学年高二下学期期中考试化学试卷西藏日喀则市上海实验学校2019-2020学年高二上学期期末考试化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)四川省遂宁市第二中学2020-2021学年高二下学期期中考试化学试题云南省楚雄天人中学2019-2020学年高二4月学习效果监测化学试题四川省北大成都附属实验学校2020-2021学年高二下学期入学考试化学试题江西省吉安市2020-2021学年高二上学期期中统考化学试题宁夏吴忠中学2021-2022学年高二上学期期末考试化学试题黑龙江省大庆中学2021-2022学年高二下学期开学考试化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)四川省峨眉第二中学校2021-2022学年高二下学期5月月考化学试题广东省揭阳市普宁市华侨中学2021-2022学年高二下学期第三次月考化学试题江苏省天一中学2021-2022学年高二上学期期末考试化学试题黑龙江省哈尔滨市第六中学2022-2023学年高三8月月考化学试题四川省内江市第三中学2021-2022学年高二下学期期中考试化学试题四川省自贡市田家柄中学教育集团2021-2022学年高二下学期入学考试化学试题四川省宜宾市南溪区第二中学校2021-2022学年高二上学期12月月考化学试题(已下线)广东省深圳中学2023届高三年级上学期第二次阶段测试化学试题(A卷)新疆乌鲁木齐市第八中学2022-2023学年高二上学期期末考试化学试题(已下线)专题20 溶液中粒子浓度大小的比较-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)贵州省瓮安中学2022-2023学年高二下学期3月月考化学试题(已下线)专题10 溶液中离子浓度的关系(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练天津市耀华中学2023-2024学年高二上学期12月月考化学试卷广西南宁市第二中学2022-2023学年高二上学期12月月考化学试卷 宁夏回族自治区吴忠市滨河中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
8 . 三氯化钌( )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从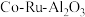 催化剂废料中分离制各
催化剂废料中分离制各 和
和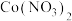 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
(2)“焙烧”后所得固体主要成分为 、
、 、
、 和
和___________ 。
(3)“还原”过程会产生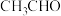 和
和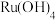 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为______________________ 。
(4)“酸溶”过程中,先加入盐酸溶解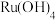 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为___________ 。
(5)“蒸发结晶”在真空度为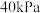 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是___________ 。
(6)若维持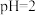 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于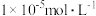 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于___________ 。[已知: ,
,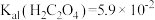 ,
, 结果保留三位小数]
结果保留三位小数]
(7)“沉钴”时,若得到的是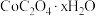 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为______________________ 。
(8)该流程中,还有一种重要成分 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:___________ 。
 )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从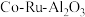 催化剂废料中分离制各
催化剂废料中分离制各 和
和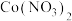 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)“焙烧”后所得固体主要成分为
 、
、 、
、 和
和(3)“还原”过程会产生
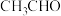 和
和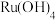 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为(4)“酸溶”过程中,先加入盐酸溶解
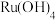 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为(5)“蒸发结晶”在真空度为
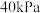 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是(6)若维持
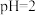 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于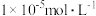 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于 ,
,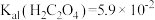 ,
, 结果保留三位小数]
结果保留三位小数](7)“沉钴”时,若得到的是
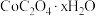 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为(8)该流程中,还有一种重要成分
 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:
您最近一年使用:0次
2024-01-09更新
|
1383次组卷
|
7卷引用:湖南省株洲市2024届高三上学期教学质量统一检测化学试题
湖南省株洲市2024届高三上学期教学质量统一检测化学试题湖南省株洲市2023-2024学年高三上学期教学质量统一检测化学试卷2024届湖南省长沙市雅礼中学高三下学期3月综合测试(一)化学试题专题8 水溶液中的离子反应与平衡-工业流程题解题策略(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)大题01 化工流程综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)2024届江西省贵溪市实验中学高三下学期5月模拟考试压轴(三)化学试卷
9 . 草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:
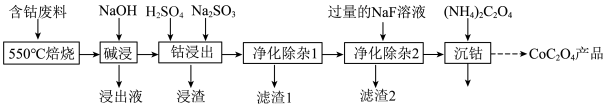
(1)“550℃焙烧”的目的是_________ 。
(2)“碱浸”过程中发生反应的化学方程式______ 。
(3)“钴浸出”过程中,不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2污染环境,该反应的离子方程式为________ 。
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5.滤渣1的主要成分是_______ 。金属离子与H2O2反应的离子方程式为________ 。
(5)“净化除杂2”过程中,加入NaF以除去原溶液中Ca2+(浓度为1.0×10﹣3mol⋅L﹣1)和Mg2+,若控制溶液中c(F﹣)=2.0×10﹣3mol⋅L﹣1,则Ca2+的去除率准确值为________ 。[已知某温度下,Ksp(CaF2)=4.0×10﹣11]
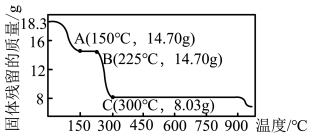
(6)如图为二水合草酸钴(CoC2O4⋅2H2O摩尔质量为183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。写出B点物质与O2在一定温度下发生反应生成C点物质的化学方程式_________ 。

(1)“550℃焙烧”的目的是
(2)“碱浸”过程中发生反应的化学方程式
(3)“钴浸出”过程中,不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2污染环境,该反应的离子方程式为
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5.滤渣1的主要成分是
(5)“净化除杂2”过程中,加入NaF以除去原溶液中Ca2+(浓度为1.0×10﹣3mol⋅L﹣1)和Mg2+,若控制溶液中c(F﹣)=2.0×10﹣3mol⋅L﹣1,则Ca2+的去除率准确值为
(6)如图为二水合草酸钴(CoC2O4⋅2H2O摩尔质量为183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。写出B点物质与O2在一定温度下发生反应生成C点物质的化学方程式

您最近一年使用:0次
2024-01-07更新
|
215次组卷
|
2卷引用:湖南省长沙市雅礼中学2023-2024学年高三上学期月考试卷(六)化学试题
名校
解题方法
10 . 氧化钪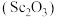 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为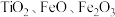 ,还含有
,还含有 等元素)中提取
等元素)中提取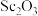 的流程如下图。
的流程如下图。
已知:
①当离子浓度减小至 时可认为沉淀完全。
时可认为沉淀完全。
②室温下 完全沉淀的
完全沉淀的 为1.05。
为1.05。
③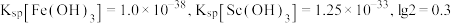 。
。
回答下列问题:
(1)“酸浸”后 元素转化为
元素转化为 ,其水解反应的离子方程式是
,其水解反应的离子方程式是_______ 。
(2) 既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式
既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式_______ 。
(3)萃取剂萃取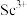 的反应原理为阳离子交换:
的反应原理为阳离子交换: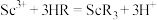 (
( 代表萃取剂)。在“反萃取”中反应生成含
代表萃取剂)。在“反萃取”中反应生成含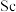 化合物的化学方程式是
化合物的化学方程式是_______ 。
(4)“酸溶”后滤液中存在的金属阳离子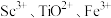 浓度均小于
浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而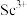 不沉淀,则调
不沉淀,则调 应控制的范围是
应控制的范围是_______ 。
(5)由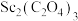 在空气中煅烧生成
在空气中煅烧生成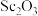 的化学反应方程式
的化学反应方程式_______ 。
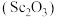 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为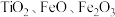 ,还含有
,还含有 等元素)中提取
等元素)中提取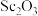 的流程如下图。
的流程如下图。
已知:
①当离子浓度减小至
 时可认为沉淀完全。
时可认为沉淀完全。②室温下
 完全沉淀的
完全沉淀的 为1.05。
为1.05。③
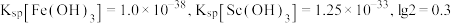 。
。回答下列问题:
(1)“酸浸”后
 元素转化为
元素转化为 ,其水解反应的离子方程式是
,其水解反应的离子方程式是(2)
 既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式
既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式(3)萃取剂萃取
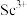 的反应原理为阳离子交换:
的反应原理为阳离子交换: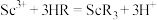 (
( 代表萃取剂)。在“反萃取”中反应生成含
代表萃取剂)。在“反萃取”中反应生成含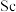 化合物的化学方程式是
化合物的化学方程式是(4)“酸溶”后滤液中存在的金属阳离子
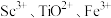 浓度均小于
浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而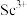 不沉淀,则调
不沉淀,则调 应控制的范围是
应控制的范围是(5)由
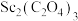 在空气中煅烧生成
在空气中煅烧生成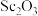 的化学反应方程式
的化学反应方程式
您最近一年使用:0次
2023-12-19更新
|
332次组卷
|
2卷引用:湖南省雅礼教育集团2023-2024学年高二上学期期中考试化学试题