解题方法
1 . 草酸钴可用于指示剂和催化剂的制备。用含钴废料(主要成分为 ,含有一定量的
,含有一定量的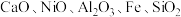 等)制备草酸钴晶体
等)制备草酸钴晶体 的流程如下:
的流程如下:
②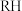 为有机物(难电离)、
为有机物(难电离)、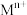 代表金属离子,
代表金属离子, 。
。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的 见下表:
见下表:
④滤液中 元素以
元素以 形式存在。
形式存在。
回答下列问题:
(1)为提高浸出速率,除将含钴废料粉碎外,还可采取的措施有___________ 。
(2)“浸出液”中加入 后发生反应的离子方程式为
后发生反应的离子方程式为___________ 。
(3)加入氧化钴调节溶液的 ,调节的
,调节的 范围是
范围是___________ 。
(4)滤渣Ⅰ主要为___________ (填化学式)。
(5)可向溶有 的有机层中加入
的有机层中加入___________ 使 从有机相返回水相,实现金属回收利用。
从有机相返回水相,实现金属回收利用。
(6)可否考虑先将 转化为
转化为 ,再利用反应
,再利用反应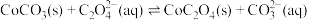 ,将
,将 转化为
转化为 :
:___________ (填“能”或“不能”,并说明理由)。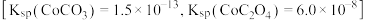
(7)若改用草酸“沉钴”, 时
时 的草酸溶液中
的草酸溶液中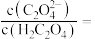
___________ 。[已知: 时,
时,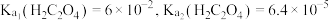 ]
]
 ,含有一定量的
,含有一定量的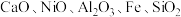 等)制备草酸钴晶体
等)制备草酸钴晶体 的流程如下:
的流程如下: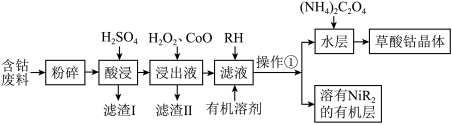
②
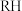 为有机物(难电离)、
为有机物(难电离)、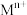 代表金属离子,
代表金属离子, 。
。③流程中部分阳离子以氢氧化物形式沉淀时溶液的
 见下表:
见下表:| 沉淀物 |  |  |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.5 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 8.0 |
 元素以
元素以 形式存在。
形式存在。回答下列问题:
(1)为提高浸出速率,除将含钴废料粉碎外,还可采取的措施有
(2)“浸出液”中加入
 后发生反应的离子方程式为
后发生反应的离子方程式为(3)加入氧化钴调节溶液的
 ,调节的
,调节的 范围是
范围是(4)滤渣Ⅰ主要为
(5)可向溶有
 的有机层中加入
的有机层中加入 从有机相返回水相,实现金属回收利用。
从有机相返回水相,实现金属回收利用。(6)可否考虑先将
 转化为
转化为 ,再利用反应
,再利用反应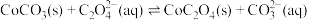 ,将
,将 转化为
转化为 :
: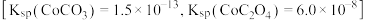
(7)若改用草酸“沉钴”,
 时
时 的草酸溶液中
的草酸溶液中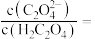
 时,
时,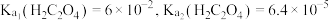 ]
]
您最近一年使用:0次
2 . Ⅰ.研究化学平衡是中学化学中非常重要的课题。请回答下列问题:
(1)已知: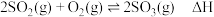 ,不同条件下反应进程的能量变化如图所示,则该反应在
,不同条件下反应进程的能量变化如图所示,则该反应在___________ (填“低温”或“高温”)下能自发进行。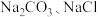 )不利于植物生长,盐碱地呈碱性的原因:
)不利于植物生长,盐碱地呈碱性的原因:___________ (用离子方程式说明)。
(3) 时,
时, 的电离常数为
的电离常数为 ;
; 的电离常数为
的电离常数为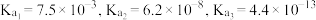 。在
。在 溶液加入过量
溶液加入过量 溶液的离子反应方程式为
溶液的离子反应方程式为___________ 。
(4)相同条件下,下列四种溶液中 由大到小的顺序是
由大到小的顺序是___________ (填序号)。
①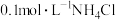 溶液
溶液
② 溶液
溶液
③ 溶液
溶液
④ 氨水
氨水
(5) 时,有
时,有 的盐酸和
的盐酸和 的
的 溶液中由水电离出的
溶液中由水电离出的 之比为
之比为___________ 。
(6)某温度时,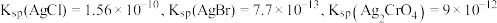 。某溶液中含有
。某溶液中含有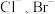 和
和 浓度均为
浓度均为 ,向该溶液中逐滴加入
,向该溶液中逐滴加入 的
的 溶液,三种阴离子产生沉淀的先后顺序为
溶液,三种阴离子产生沉淀的先后顺序为___________ (用阴离子符号表示)。
Ⅱ.电化学技术在处理污染气体领域的应用广泛。
(7)利用反应 构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。___________ 。
(1)已知:
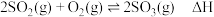 ,不同条件下反应进程的能量变化如图所示,则该反应在
,不同条件下反应进程的能量变化如图所示,则该反应在
 )不利于植物生长,盐碱地呈碱性的原因:
)不利于植物生长,盐碱地呈碱性的原因:(3)
 时,
时, 的电离常数为
的电离常数为 ;
; 的电离常数为
的电离常数为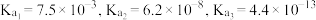 。在
。在 溶液加入过量
溶液加入过量 溶液的离子反应方程式为
溶液的离子反应方程式为(4)相同条件下,下列四种溶液中
 由大到小的顺序是
由大到小的顺序是①
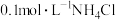 溶液
溶液②
 溶液
溶液③
 溶液
溶液④
 氨水
氨水(5)
 时,有
时,有 的盐酸和
的盐酸和 的
的 溶液中由水电离出的
溶液中由水电离出的 之比为
之比为(6)某温度时,
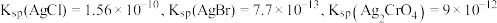 。某溶液中含有
。某溶液中含有 和
和 浓度均为
浓度均为 ,向该溶液中逐滴加入
,向该溶液中逐滴加入 的
的 溶液,三种阴离子产生沉淀的先后顺序为
溶液,三种阴离子产生沉淀的先后顺序为Ⅱ.电化学技术在处理污染气体领域的应用广泛。
(7)利用反应
 构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。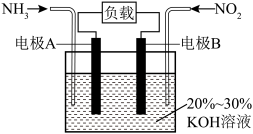
您最近一年使用:0次
名校
解题方法
3 .  是生产多晶硅的副产物。可以利用
是生产多晶硅的副产物。可以利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理、进而回收Li、Co等金属,工艺路线如图所示:
进行氯化处理、进而回收Li、Co等金属,工艺路线如图所示: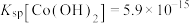 ,
,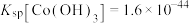 。
。
(1)Co的价电子排布式为_______ 。
(2)烧渣是 、
、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾。用化学方程式表示其原因:
应先除去,否则水浸时会产生大量烟雾。用化学方程式表示其原因:_______ 。
(3)常温下,若“滤液2”中 浓度为:
浓度为: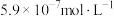 ,“沉钴”时应控制pH为
,“沉钴”时应控制pH为_______ 。“850℃煅烧”时的化学方程式为_______ 。
(4)利用碳酸锂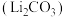 与
与 按
按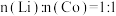 的比例配合,然后在空气中于700℃烧结可合成锂电池正极材料
的比例配合,然后在空气中于700℃烧结可合成锂电池正极材料 ,反应方程式为
,反应方程式为_______ 。
(5)海水中有丰富的锂资源,我国科学家研发出利用太阳能从海水中提取金属锂的技术,提取原理如图所示。金属锂在电极_______ (填“A”或“B”)上生成,阳极产生两种气体单质,电极反应式是_______ 。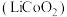 的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有
的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有 的个数为
的个数为_______ 。
 是生产多晶硅的副产物。可以利用
是生产多晶硅的副产物。可以利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理、进而回收Li、Co等金属,工艺路线如图所示:
进行氯化处理、进而回收Li、Co等金属,工艺路线如图所示: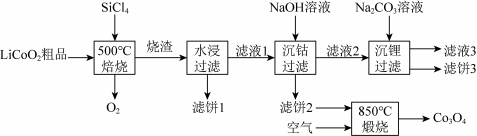
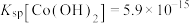 ,
,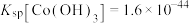 。
。(1)Co的价电子排布式为
(2)烧渣是
 、
、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾。用化学方程式表示其原因:
应先除去,否则水浸时会产生大量烟雾。用化学方程式表示其原因:(3)常温下,若“滤液2”中
 浓度为:
浓度为: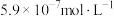 ,“沉钴”时应控制pH为
,“沉钴”时应控制pH为(4)利用碳酸锂
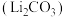 与
与 按
按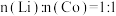 的比例配合,然后在空气中于700℃烧结可合成锂电池正极材料
的比例配合,然后在空气中于700℃烧结可合成锂电池正极材料 ,反应方程式为
,反应方程式为(5)海水中有丰富的锂资源,我国科学家研发出利用太阳能从海水中提取金属锂的技术,提取原理如图所示。金属锂在电极

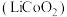 的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有
的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有 的个数为
的个数为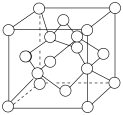
您最近一年使用:0次
名校
解题方法
4 . 一定温度下, 在不同pH的
在不同pH的 溶液中存在形式不同,
溶液中存在形式不同, 溶液中
溶液中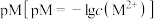 随pH的变化如图1,
随pH的变化如图1, 溶液中含A微粒的物质的量分数随pH的变化如图2。
溶液中含A微粒的物质的量分数随pH的变化如图2。
 均为难溶物;②初始
均为难溶物;②初始 。
。
下列说法错误的是
 在不同pH的
在不同pH的 溶液中存在形式不同,
溶液中存在形式不同, 溶液中
溶液中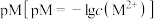 随pH的变化如图1,
随pH的变化如图1, 溶液中含A微粒的物质的量分数随pH的变化如图2。
溶液中含A微粒的物质的量分数随pH的变化如图2。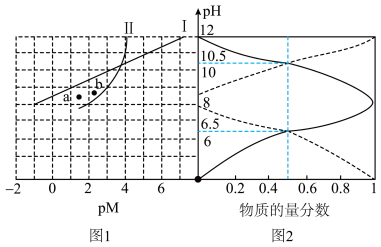
 均为难溶物;②初始
均为难溶物;②初始 。
。下列说法错误的是
A.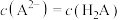 时, 时, |
B.初始状态a点发生反应: |
C.Ⅰ曲线上的点满足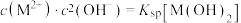 |
D.初始状态的b点,平衡后溶液中存在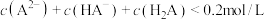 |
您最近一年使用:0次
2024-08-08更新
|
275次组卷
|
4卷引用:湖南省长沙市雅礼中学2024-2025学年高三上学期入学考试化学试题
5 . 我国科学家研究和开发的锰氧化物分子筛(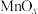 @MS)材料,可大大提升分子筛对含酚废水的处理能力。工业上可由二氧化锰粉末与硫化锰矿(含Fe,Al,Mg,Ni,Zn,Si等元素的硫化物或氧化物以及C和少量有机物)和4A级分子筛为原料制备该材料。
@MS)材料,可大大提升分子筛对含酚废水的处理能力。工业上可由二氧化锰粉末与硫化锰矿(含Fe,Al,Mg,Ni,Zn,Si等元素的硫化物或氧化物以及C和少量有机物)和4A级分子筛为原料制备该材料。
 .高纯
.高纯 制备
制备 。
。
附:①一些相关物质的
②相关金属离子形成氢氧化物沉淀的pH
(1)将MnS矿与 粉进行“联合焙烧”的目的有
粉进行“联合焙烧”的目的有___________ (答出1点即可);为了提高焙烧效率可采取的措施有___________ (答出2点即可),“尾气”中所含气体中除 外还有
外还有___________ 。
(2)“酸浸”时所得“滤渣1”的主要成分为___________ ;“除杂1”中“滤渣3”的主要成分为___________ 。
(3)除杂2的目的是生成 ,从而除去
,从而除去 。请通过计算解释选用
。请通过计算解释选用 可行的原因。
可行的原因。___________
(4)沉锰过程中选用X为氨水和碳酸氢钠的混合溶液,请写出该过程的离子方程式___________ 。
 .@MS材料的制备
.@MS材料的制备
(5)将一定量的 溶于蒸馏水中,加入预处理的分子筛和NaClO溶液,再加入
溶于蒸馏水中,加入预处理的分子筛和NaClO溶液,再加入 和NaOH调节溶液pH为7.2,在室温下搅拌2h,反应结束后经过滤洗涤干燥得
和NaOH调节溶液pH为7.2,在室温下搅拌2h,反应结束后经过滤洗涤干燥得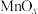 @MS材料。若发生反应的
@MS材料。若发生反应的 与NaClO物质的量之比为
与NaClO物质的量之比为 ,则
,则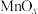 @MS中Mn的化合价为
@MS中Mn的化合价为___________ 。
 .流程评价
.流程评价
(6)有同学认为此流程不适宜大规模工业生产,请从物质利用角度谈谈你的看法。___________
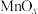 @MS)材料,可大大提升分子筛对含酚废水的处理能力。工业上可由二氧化锰粉末与硫化锰矿(含Fe,Al,Mg,Ni,Zn,Si等元素的硫化物或氧化物以及C和少量有机物)和4A级分子筛为原料制备该材料。
@MS)材料,可大大提升分子筛对含酚废水的处理能力。工业上可由二氧化锰粉末与硫化锰矿(含Fe,Al,Mg,Ni,Zn,Si等元素的硫化物或氧化物以及C和少量有机物)和4A级分子筛为原料制备该材料。 .高纯
.高纯 制备
制备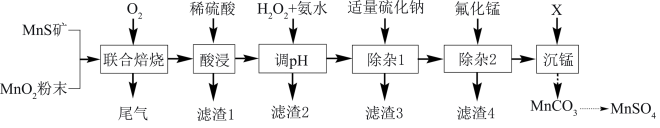
 。
。附:①一些相关物质的

| 物质 | MnS | NiS | ZnS |  |  |
 | 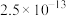 | 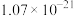 | 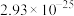 | 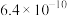 | 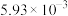 |
| 金属离子 |  |  |  |  |  |  |  |
| 开始沉淀 | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全 | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)将MnS矿与
 粉进行“联合焙烧”的目的有
粉进行“联合焙烧”的目的有 外还有
外还有(2)“酸浸”时所得“滤渣1”的主要成分为
(3)除杂2的目的是生成
 ,从而除去
,从而除去 。请通过计算解释选用
。请通过计算解释选用 可行的原因。
可行的原因。(4)沉锰过程中选用X为氨水和碳酸氢钠的混合溶液,请写出该过程的离子方程式
 .@MS材料的制备
.@MS材料的制备(5)将一定量的
 溶于蒸馏水中,加入预处理的分子筛和NaClO溶液,再加入
溶于蒸馏水中,加入预处理的分子筛和NaClO溶液,再加入 和NaOH调节溶液pH为7.2,在室温下搅拌2h,反应结束后经过滤洗涤干燥得
和NaOH调节溶液pH为7.2,在室温下搅拌2h,反应结束后经过滤洗涤干燥得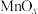 @MS材料。若发生反应的
@MS材料。若发生反应的 与NaClO物质的量之比为
与NaClO物质的量之比为 ,则
,则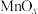 @MS中Mn的化合价为
@MS中Mn的化合价为 .流程评价
.流程评价(6)有同学认为此流程不适宜大规模工业生产,请从物质利用角度谈谈你的看法。
您最近一年使用:0次
6 . 常温下,向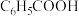 、
、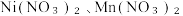 的混合溶液中滴加NaOH溶液,溶液中pX
的混合溶液中滴加NaOH溶液,溶液中pX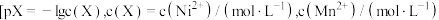 与pH的关系如图所示,下列叙述正确的是
与pH的关系如图所示,下列叙述正确的是
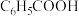 、
、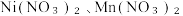 的混合溶液中滴加NaOH溶液,溶液中pX
的混合溶液中滴加NaOH溶液,溶液中pX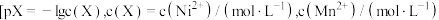 与pH的关系如图所示,下列叙述正确的是
与pH的关系如图所示,下列叙述正确的是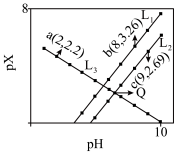
A.L1代表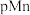 和pH的关系 和pH的关系 |
B.苯甲酸的 为 为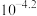 |
C.反应 的化学平衡常数K为 的化学平衡常数K为 |
| D.Q点坐标为(5.65,-1.45) |
您最近一年使用:0次
2024-07-26更新
|
243次组卷
|
4卷引用:湖南省衡阳县第一中学2025届高三上学期开学考试化学试卷
7 . 常温下,向含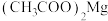 、CH3COOH的混合液中滴加氨水,混合液中[,
、CH3COOH的混合液中滴加氨水,混合液中[, ,
,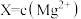 、
、 、
、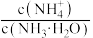 ]与pH关系如图所示。下列叙述错误的是
]与pH关系如图所示。下列叙述错误的是
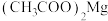 、CH3COOH的混合液中滴加氨水,混合液中[,
、CH3COOH的混合液中滴加氨水,混合液中[, ,
,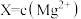 、
、 、
、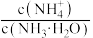 ]与pH关系如图所示。下列叙述错误的是
]与pH关系如图所示。下列叙述错误的是
A. 代表 代表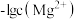 与 与 关系 关系 |
B. 点对应的溶液中 点对应的溶液中 |
C.常温下,电离常数比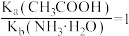 |
D. 的平衡常数 的平衡常数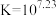 |
您最近一年使用:0次
8 . 可溶性钡盐有毒,医院中常用硫酸钡作为内服造影剂。已知: 、
、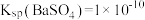 ,在饱和的BaSO4溶液中,下列说法错误的是
,在饱和的BaSO4溶液中,下列说法错误的是
 、
、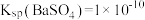 ,在饱和的BaSO4溶液中,下列说法错误的是
,在饱和的BaSO4溶液中,下列说法错误的是A.BaSO4的溶解方程式为: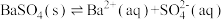 |
B.向饱和的BaSO4溶液中加入固体BaSO4, 不变 不变 |
C.不用碳酸钡作为内服造影剂,是因为 |
D.向BaCO3、BaSO4的饱和混合溶液中加入少量BaCl2,溶液中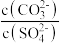 不变 不变 |
您最近一年使用:0次
2024-07-01更新
|
116次组卷
|
3卷引用: 湖南省岳阳市2023-2024学年高二下学期期末考试化学试题
名校
解题方法
9 . 稀土是“工业味精”,邓小平同志曾说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
| A.工业上可以电解Ce(SO4)2溶液制备铈单质 |
B.向Ce(SO4)2溶液中通入SO2,其离子方程式为2Ce4++SO2+2H2O=2Ce3++ +4H+ +4H+ |
| C.常温下,已知Ksp[Ce(OH)3]=1.0×10-20,则Ce3+在pH为5.0时恰好完全沉淀 |
| D.四种铈的核素13658Ce、13858Ce、14058Ce、14258Ce之间可以通过化学反应进行转化 |
您最近一年使用:0次
2024-06-22更新
|
256次组卷
|
3卷引用:湖南省长沙市雅礼中学2021-2022学年高三第九次月考(一模)化学试题
名校
10 . 利用含锌废水制备ZnCO3·2Zn(OH)2的工艺流程如图,下列有关说法正确的是
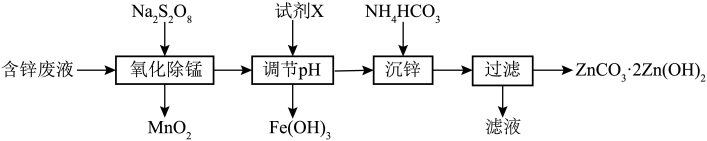
已知:①
②Zn2+ 可以与氨水反应生成[ Zn(NH3)4 ]2+

已知:①
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 |
| Ksp | 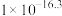 | 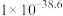 | 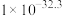 | 1.2 x 10-17 |
| A.Na2S2O8中硫元素的化合价为+7价 |
| B.氧化除锰步骤中氧化剂和还原剂的物质的量之比为2:1 |
C.沉锌时发生反应的离子方程式主要是: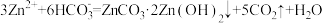 |
| D.调节pH值除铁时,应选用的试剂X为氨水,调节pH值应大于9,以便将铁完全沉淀。 |
您最近一年使用:0次
2024-05-30更新
|
209次组卷
|
2卷引用:湖南省部分学校2024届高三下学期高考临考模拟预测化学试题



