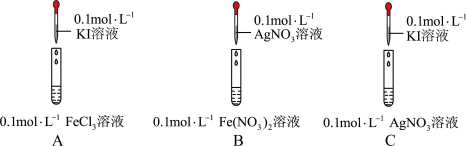
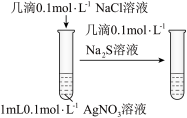
1 . 化学是一门以实验为基础的学科。某学习小组探究Ag+、Fe3+能否将I-氧化,开展如下探究。
【试剂准备】
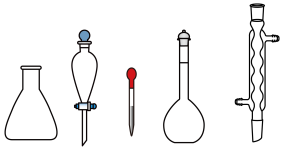
(1)分别配制480 mL浓度均为0.1 mol/L KI和AgNO3溶液,下边仪器中用到的有_______ (填名称)。
【实验分析】
(2)实验A中发生反应的离子方程式为:_______ 。
(3)根据实验A、B的现象说明:_______。
(4)依据实验C,说明Ag+与I-并不发生氧化还原反应,而是生成AgI沉淀。学习小组通过实验C,对上述(2)的结论产生了质疑。于是查阅资料并重新实验
【查找资料】
①资料1:AgI的沉淀溶解衡常数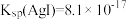 ,若将0.1 mol/L KI和0.1 mol/L AgNO3溶液等体积混合,混合后溶液中
,若将0.1 mol/L KI和0.1 mol/L AgNO3溶液等体积混合,混合后溶液中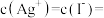
_______ mol/L。
②资料2:氧化剂的氧化性强弱除受本身性质影响外,还与温度、浓度、溶液的酸碱度等外界条件有关。试解释实验C中溶液没有变蓝的主要原因可能是_______ 。
【实验操作二】
(5)为避免Ag+、I-二者直接接触发生沉淀反应,学习小组设计将KI和 溶液分别装在两个不同的溶液中,实验装置如图:
溶液分别装在两个不同的溶液中,实验装置如图:_______ (填“KCl”、“KNO3”或“ ”)。
”)。
②闭合开关K,观察到硝酸银溶液的颜色无明显变化但插在硝酸银溶液中的石墨电极逐渐变亮,说明“石墨2”电极反应式为_______ 。
【实验结论】
综上所述:Ag+、 都能将I-氧化,但Ag+与I-直接接触时主要发生沉淀反应。
都能将I-氧化,但Ag+与I-直接接触时主要发生沉淀反应。
【试剂准备】
(1)分别配制480 mL浓度均为0.1 mol/L KI和AgNO3溶液,下边仪器中用到的有
| 实验现象 |
| A中溶液呈棕黄色,滴加淀粉溶液,变蓝 | |
| B中产生黑色沉淀,滴加KSCN溶液,变红 | |
| C中产生黄色沉淀,滴加淀粉溶液,未变蓝 |
(2)实验A中发生反应的离子方程式为:
(3)根据实验A、B的现象说明:_______。
A.氧化性顺序: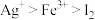 | B.氧化性顺序: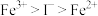 |
C.还原性顺序: | D.还原性顺序: |
(4)依据实验C,说明Ag+与I-并不发生氧化还原反应,而是生成AgI沉淀。学习小组通过实验C,对上述(2)的结论产生了质疑。于是查阅资料并重新实验
【查找资料】
①资料1:AgI的沉淀溶解衡常数
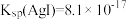 ,若将0.1 mol/L KI和0.1 mol/L AgNO3溶液等体积混合,混合后溶液中
,若将0.1 mol/L KI和0.1 mol/L AgNO3溶液等体积混合,混合后溶液中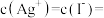
②资料2:氧化剂的氧化性强弱除受本身性质影响外,还与温度、浓度、溶液的酸碱度等外界条件有关。试解释实验C中溶液没有变蓝的主要原因可能是
【实验操作二】
(5)为避免Ag+、I-二者直接接触发生沉淀反应,学习小组设计将KI和
 溶液分别装在两个不同的溶液中,实验装置如图:
溶液分别装在两个不同的溶液中,实验装置如图: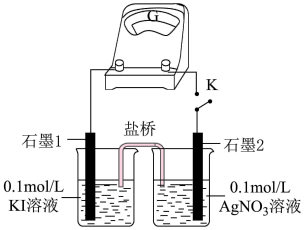
 ”)。
”)。②闭合开关K,观察到硝酸银溶液的颜色无明显变化但插在硝酸银溶液中的石墨电极逐渐变亮,说明“石墨2”电极反应式为
【实验结论】
综上所述:Ag+、
 都能将I-氧化,但Ag+与I-直接接触时主要发生沉淀反应。
都能将I-氧化,但Ag+与I-直接接触时主要发生沉淀反应。
您最近一年使用:0次
2 . 根据下列实验操作及现象,得出的结论正确的是
| 选项 | 操作及现象 | 结论 |
| A | 向FeSO4溶液中滴加苯酚溶液,溶液变紫色 | FeSO4已变质 |
| B | 向某溶液中加入NaOH稀溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 该溶液中一定没有 |
| C | 向NaCl、NaBr的混合稀溶液中滴入少量稀AgNO3溶液,有浅黄色沉淀生成 | 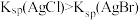 |
| D | 向盛有2 mL一定浓度的Na3[Ag(S2O3)2]溶液的试管中,滴入5滴2 mol/L KI溶液,产生黄色沉淀 | 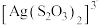 能够完全电离 能够完全电离 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 可溶性钡盐有毒,医院中常用硫酸钡作为内服造影剂。已知: 、
、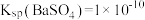 ,在饱和的BaSO4溶液中,下列说法错误的是
,在饱和的BaSO4溶液中,下列说法错误的是
 、
、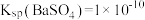 ,在饱和的BaSO4溶液中,下列说法错误的是
,在饱和的BaSO4溶液中,下列说法错误的是A.BaSO4的溶解方程式为: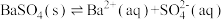 |
B.向饱和的BaSO4溶液中加入固体BaSO4, 不变 不变 |
C.不用碳酸钡作为内服造影剂,是因为 |
D.向BaCO3、BaSO4的饱和混合溶液中加入少量BaCl2,溶液中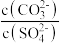 不变 不变 |
您最近一年使用:0次
2024-07-01更新
|
116次组卷
|
3卷引用: 湖南省岳阳市2023-2024学年高二下学期期末考试化学试题
名校
解题方法
4 . 下列物质性质实验对应的离子方程式书写正确的是
A.漂白粉溶液吸收 后产生白色沉淀: 后产生白色沉淀: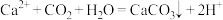 |
B. 溶于氢碘酸: 溶于氢碘酸: |
C. 溶液与稀硫酸反应: 溶液与稀硫酸反应: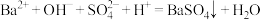 |
D.用 溶液处理锅炉水垢: 溶液处理锅炉水垢: |
您最近一年使用:0次
2024-06-06更新
|
879次组卷
|
2卷引用:湖南省长沙市雅礼中学2023-2024学年高二下学期期末考试化学试题
5 . 回答下列问题:
(1)25℃时,CH3COOH的电离平衡常数为:K=1.8×10-5,H3PO3的电离平衡常数为:K1=8.3×10-3、K2=5.6×10-6;则:
①写出CH3COOH的电离方程式:___________
②25℃时,0.02mol/L的CH3COOH溶液的电离度约为______ %。
③往Na2HPO3溶液中滴加足量CH3COOH溶液的离子反应方程式为:____________
(2)①某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4加入下列物质中:
a.5 mL水 b.40mL 0. 2 mol·L-1的Ba(OH)2溶液
c.20mL 0.5 mol·L-1的Na2SO4溶液 d.40mL 0.1 mol·L-1的H2SO4溶液中
溶解BaSO4后形成的溶液中,Ba2+的浓度由大到小的顺序为_____ (填字母)。
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
②已知298K时,Ksp(BaSO4)=1.1×10-10,此时,溶液b中加入BaSO4固体后,c( )为
)为______________ mol·L-1。
(3)新型高效的乙烷燃料电池采用铂为电极材料,两电极上分别通入C2H6和O2 ,电解质溶液为KOH溶液。
①请写出乙烷燃料电池的负极反应式:_______________ 。
②利用此乙烷燃料电池给铅蓄电池充电,若充电过程中有3.0g乙烷完全反应,且不考虑能量损耗,则此充电过程消耗的O2在标况下的体积为_________ L(保留3位有效数字)、铅蓄电池的阳极质量减小________ g(保留3位有效数字)。
(1)25℃时,CH3COOH的电离平衡常数为:K=1.8×10-5,H3PO3的电离平衡常数为:K1=8.3×10-3、K2=5.6×10-6;则:
①写出CH3COOH的电离方程式:
②25℃时,0.02mol/L的CH3COOH溶液的电离度约为
③往Na2HPO3溶液中滴加足量CH3COOH溶液的离子反应方程式为:
(2)①某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4加入下列物质中:
a.5 mL水 b.40mL 0. 2 mol·L-1的Ba(OH)2溶液
c.20mL 0.5 mol·L-1的Na2SO4溶液 d.40mL 0.1 mol·L-1的H2SO4溶液中
溶解BaSO4后形成的溶液中,Ba2+的浓度由大到小的顺序为
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
②已知298K时,Ksp(BaSO4)=1.1×10-10,此时,溶液b中加入BaSO4固体后,c(
 )为
)为(3)新型高效的乙烷燃料电池采用铂为电极材料,两电极上分别通入C2H6和O2 ,电解质溶液为KOH溶液。
①请写出乙烷燃料电池的负极反应式:
②利用此乙烷燃料电池给铅蓄电池充电,若充电过程中有3.0g乙烷完全反应,且不考虑能量损耗,则此充电过程消耗的O2在标况下的体积为
您最近一年使用:0次
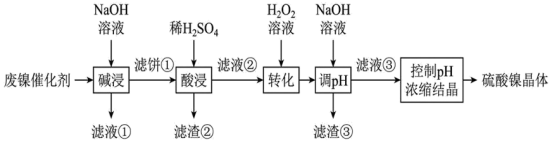
6 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属 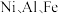 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体 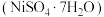 :
: 如表所示:
如表所示:
回答下列问题:
(1)“滤液②”中除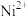 外还含有的金属离子
外还含有的金属离子___________ ;
(2)“转化”中可替代 的物质是
的物质是___________ (不能引入新的杂质离子);
由表格中的数据可求得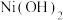 的
的 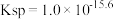 。如果“转化”后的溶液中
。如果“转化”后的溶液中 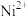 浓度为
浓度为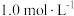 ,则除去杂质金属阳离子时“调
,则除去杂质金属阳离子时“调 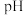 ”应控制的
”应控制的  范围是
范围是___________ 。
(3)硫酸镍在强碱溶液中用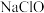 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 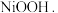 写出该反应的离子方程式
写出该反应的离子方程式___________ 。
(4)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是___________ 。
(5)第Ⅷ族元素单质及其化合物在工业生产和科研领域有重要的用途。
①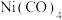 (该物质是配位化合物,且
(该物质是配位化合物,且  的结构式为
的结构式为  )常用作制备高纯镍粉,其熔点为
)常用作制备高纯镍粉,其熔点为 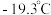 ,沸点为
,沸点为 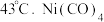 中
中  键和
键和  键的数目之比为
键的数目之比为___________ 。
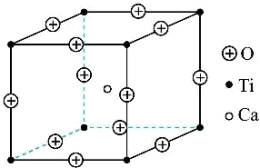
②在高温超导领域中,有一种化合物叫钙钛矿,其晶胞如图所示,在该晶胞中氧、钙、钛的粒子个数比是___________ 。
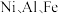 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体 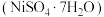 :
:
 如表所示:
如表所示:| 金属离子 | 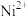 |  | 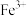 | 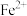 |
开始沉淀时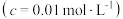 的  | 7.2 | 3.7 | 2.2 | 7.5 |
完全沉淀时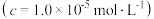 的  | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“滤液②”中除
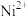 外还含有的金属离子
外还含有的金属离子(2)“转化”中可替代
 的物质是
的物质是由表格中的数据可求得
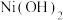 的
的 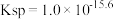 。如果“转化”后的溶液中
。如果“转化”后的溶液中 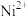 浓度为
浓度为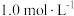 ,则除去杂质金属阳离子时“调
,则除去杂质金属阳离子时“调 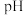 ”应控制的
”应控制的  范围是
范围是(3)硫酸镍在强碱溶液中用
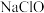 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 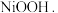 写出该反应的离子方程式
写出该反应的离子方程式(4)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
(5)第Ⅷ族元素单质及其化合物在工业生产和科研领域有重要的用途。
①
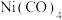 (该物质是配位化合物,且
(该物质是配位化合物,且  的结构式为
的结构式为  )常用作制备高纯镍粉,其熔点为
)常用作制备高纯镍粉,其熔点为 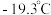 ,沸点为
,沸点为 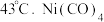 中
中  键和
键和  键的数目之比为
键的数目之比为②在高温超导领域中,有一种化合物叫钙钛矿,其晶胞如图所示,在该晶胞中氧、钙、钛的粒子个数比是
您最近一年使用:0次
7 . 室温下,向Mg(NO3)2溶液、HF溶液、CH3CH2COOH溶液中分别滴加NaOH溶液,测得溶液中pH与pX[pX=-lgX,X代表 、
、 、
、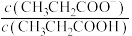 ]的关系如图所示。
]的关系如图所示。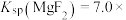
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是
已知:
 、
、 、
、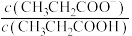 ]的关系如图所示。
]的关系如图所示。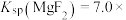
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是已知:

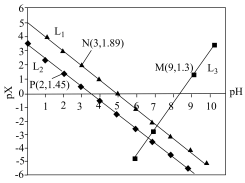
A. 代表的是pH与 代表的是pH与 的关系 的关系 |
B. 的 的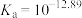 |
C.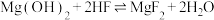 的 的 |
| D.含相同浓度NaF、HF的混合溶液的pH>7 |
您最近一年使用:0次
2024-04-01更新
|
718次组卷
|
7卷引用:湖南省衡阳市衡阳县2023-2024学年高二下学期7月期末化学试题
8 . 宏观辨识与微观探析是化学学科核心素养之一。下列生活和生产中化学知识应用的解释和反应方程式书写不正确的是
| A.自然界中的Cu2+遇到深层的方铅矿转化为铜蓝:PbS(s)+Cu2+(aq)=CuS(s)+Pb2+(aq) |
| B.电解精炼铜时,阳极材料是粗铜,发生的电极反应式只有:Cu-2e-=Cu2+ |
C.红热的木炭放入盛有浓硝酸的试管中,有红棕色气体产生,可能发生反应:4HNO3 4NO2↑+O2↑+2H2O 4NO2↑+O2↑+2H2O |
| D.海水提溴中用二氧化硫水溶液吸收溴蒸气:Br2+SO2+2H2O=2HBr+H2SO4 |
您最近一年使用:0次
2024-03-20更新
|
173次组卷
|
7卷引用:湖南省株洲市渌口区第五中学2023-2024学年高二下学期期末考试化学试题
名校
9 . 近日,科学家利用光催化剂 实现高选择性制备氢气。某小组以辉铋矿(主要成分是
实现高选择性制备氢气。某小组以辉铋矿(主要成分是 ,含少量
,含少量 和
和 等杂质)为原料制备钒酸铋(
等杂质)为原料制备钒酸铋( )的流程如下:
)的流程如下: 和
和 。
。
②几种氢氧化物沉淀的 如表所示。
如表所示。
回答下列问题:
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为_________ 。浸渣1中,除了 外还有一种单质为
外还有一种单质为_________ 。
(2)调 的最低值为
的最低值为_________ 。滤液3可以循环用于“_________ ”工序(填名称)。
(3)“氯化”的化学方程式为___________________________ 。
(4)已知辉铋矿中所含 元素的质量分数为
元素的质量分数为 这种矿石经上述转化最终制得
这种矿石经上述转化最终制得 ,则铋的收率为
,则铋的收率为_________ ( )。
)。
(5) 的立方晶胞结构如图所示。已知晶体密度为
的立方晶胞结构如图所示。已知晶体密度为 ,设
,设 为阿伏加德罗常数的值,则该晶体中与
为阿伏加德罗常数的值,则该晶体中与 距离最近且相等的
距离最近且相等的 有
有_________ 个,相邻2个 的核间距为
的核间距为_________  。
。
 实现高选择性制备氢气。某小组以辉铋矿(主要成分是
实现高选择性制备氢气。某小组以辉铋矿(主要成分是 ,含少量
,含少量 和
和 等杂质)为原料制备钒酸铋(
等杂质)为原料制备钒酸铋( )的流程如下:
)的流程如下:
 和
和 。
。②几种氢氧化物沉淀的
 如表所示。
如表所示。氢氧化物 |
|
|
|
开始沉淀 | 7.5 | 1.6 | 4.0 |
沉淀完全 | 9.7 | 3.1 | 5.5 |
(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为 外还有一种单质为
外还有一种单质为(2)调
 的最低值为
的最低值为(3)“氯化”的化学方程式为
(4)已知辉铋矿中所含
 元素的质量分数为
元素的质量分数为 这种矿石经上述转化最终制得
这种矿石经上述转化最终制得 ,则铋的收率为
,则铋的收率为 )。
)。(5)
 的立方晶胞结构如图所示。已知晶体密度为
的立方晶胞结构如图所示。已知晶体密度为 ,设
,设 为阿伏加德罗常数的值,则该晶体中与
为阿伏加德罗常数的值,则该晶体中与 距离最近且相等的
距离最近且相等的 有
有 的核间距为
的核间距为 。
。
您最近一年使用:0次
2024-03-17更新
|
188次组卷
|
2卷引用:湖南省衡阳市衡阳县2023-2024学年高二下学期7月期末化学试题
名校
解题方法
10 . 下列实验装置(部分夹持装置已略去)可以达到对应实验目的是
| A | B | C | D | |
| 实验目的 | 测定锌与稀硫酸反应速率 | 测定中和反应的反应热 | 比较 和 和 溶解度大小 溶解度大小 | 探究铁的析氢腐蚀 |
| 实验装置 |
|
|
|
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-27更新
|
97次组卷
|
16卷引用:湖南省宁乡市2022-2023学年高二上学期期末考试化学试题
湖南省宁乡市2022-2023学年高二上学期期末考试化学试题北京市西城区2021—2022学年高二上学期期末化学试题吉林省长春市实验中学2022-2023学年高二上学期期末考试化学试题广东省广州市协和中学等3校2022-2023学年高二上学期(12月)期末考试化学试题天津市南开区2023-2024学年高二上学期期末测试化学试题天津市重点校2023-2024学年高二上学期期末考试化学试题吉林省珲春市第二高级中学校2023-2024学年高二上学期期末考试化学试题四川省成都市锦江区嘉祥外国语高级中学2023-2024学年高二下学期期末考试化学试题天津市南开区2023-2024学年高二上学期期末考试化学试题宁夏银川市2023-2024学年高二上学期期末考试化学试卷 天津市2023-2024学年高二上学期重点校联考化学试题吉林省德惠市实验中学2022-2023学年高二上学期第三次月考化学试题北京师范大学第二附属中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属实验中学顺义学校2023-2024学年高二上学期12月月考化学试题 重庆市杨家坪中学2023-2024学年高二上学期第三次月考化学试题四川省射洪中学校2023-2024学年高二上学期第三次月考化学试题