名校
解题方法
1 . 以湿法炼锌厂所产的钴锰渣(主要成分为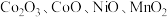 ,含少量
,含少量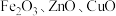 、
、 等)为原料回收制备
等)为原料回收制备 的工艺如下:
的工艺如下: 。
。
回答下列问题:
(1)“酸浸”时其中 ,写出
,写出 反应的化学方程式:
反应的化学方程式:___________ 。
(2)“除铁”时,生成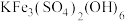 同时有CO2生成,写出该反应离子方程式为:
同时有CO2生成,写出该反应离子方程式为:___________ 。
(3)“除铜锌”时, 主要以
主要以 而不是Cu(OH)2形式除去,结合计算说明其原因:
而不是Cu(OH)2形式除去,结合计算说明其原因:__________ (写出主要计算推理过程)。
(4)“滤渣3”中含有 ,写出“除锰”时生成
,写出“除锰”时生成 的化学方程式:
的化学方程式:___________ 。
(5)P204、P507对金属离子的萃取率与 的关系如图1所示。
的关系如图1所示。___________ 。
②“P507萃取”时,选择合适的 范围为
范围为___________ (填字母)。
A. B.
B. C.
C.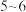 D.
D.
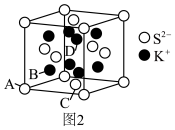
(6) 的立方晶胞结构如图2所示。若
的立方晶胞结构如图2所示。若 晶体密度为d g/cm3 ,则晶胞中
晶体密度为d g/cm3 ,则晶胞中 与
与 之间最近距离为
之间最近距离为___________  。
。
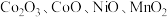 ,含少量
,含少量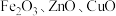 、
、 等)为原料回收制备
等)为原料回收制备 的工艺如下:
的工艺如下: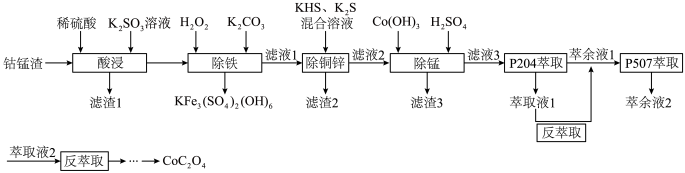
 。
。回答下列问题:
(1)“酸浸”时其中
 ,写出
,写出 反应的化学方程式:
反应的化学方程式:(2)“除铁”时,生成
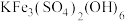 同时有CO2生成,写出该反应离子方程式为:
同时有CO2生成,写出该反应离子方程式为:(3)“除铜锌”时,
 主要以
主要以 而不是Cu(OH)2形式除去,结合计算说明其原因:
而不是Cu(OH)2形式除去,结合计算说明其原因:(4)“滤渣3”中含有
 ,写出“除锰”时生成
,写出“除锰”时生成 的化学方程式:
的化学方程式:(5)P204、P507对金属离子的萃取率与
 的关系如图1所示。
的关系如图1所示。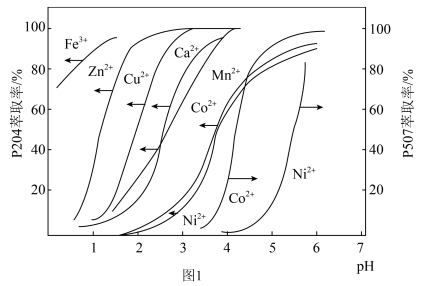
②“P507萃取”时,选择合适的
 范围为
范围为A.
 B.
B. C.
C.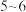 D.
D.
(6)
 的立方晶胞结构如图2所示。若
的立方晶胞结构如图2所示。若 晶体密度为d g/cm3 ,则晶胞中
晶体密度为d g/cm3 ,则晶胞中 与
与 之间最近距离为
之间最近距离为 。
。
您最近一年使用:0次
2 . 某科研团队设计了一种熔盐液相氧化法对铬铁矿(主要成分 ,含
,含 氧化物杂质)进行处理制备高价铬盐的工艺流程如图。
氧化物杂质)进行处理制备高价铬盐的工艺流程如图。 存在,在碱性介质中以
存在,在碱性介质中以 存在:②
存在:② 在水溶液中以
在水溶液中以 的形式存在。
的形式存在。
回答下列问题:
(1)Cr的价电子排布式为_____ 。
(2)铬铁矿在高温反应前需要粉碎处理的目的是_____ 。
(3)“高温连续氧化”工序中 发生反应的化学方程式为
发生反应的化学方程式为_____ 。
(4)气体A是_____ (填化学式)。
(5)工序2中与气体A发生反应的离子除OH-还有_____ 。
(6)若工序2中的铝元素恰好完全转化为沉淀,此时溶液中的
_____  ,(通常认为溶液中离子浓度小于
,(通常认为溶液中离子浓度小于 为沉淀完全;
为沉淀完全;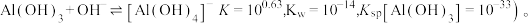
(7)该工艺可以利用滤渣1提取 ,下图是
,下图是 晶胞,已知晶胞密度是
晶胞,已知晶胞密度是 ,用
,用 表示阿伏加德罗常数的值,则d=
表示阿伏加德罗常数的值,则d=_____ nm(写出计算表达式即可)。
 ,含
,含 氧化物杂质)进行处理制备高价铬盐的工艺流程如图。
氧化物杂质)进行处理制备高价铬盐的工艺流程如图。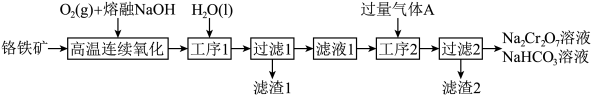
 存在,在碱性介质中以
存在,在碱性介质中以 存在:②
存在:② 在水溶液中以
在水溶液中以 的形式存在。
的形式存在。回答下列问题:
(1)Cr的价电子排布式为
(2)铬铁矿在高温反应前需要粉碎处理的目的是
(3)“高温连续氧化”工序中
 发生反应的化学方程式为
发生反应的化学方程式为(4)气体A是
(5)工序2中与气体A发生反应的离子除OH-还有
(6)若工序2中的铝元素恰好完全转化为沉淀,此时溶液中的

 ,(通常认为溶液中离子浓度小于
,(通常认为溶液中离子浓度小于 为沉淀完全;
为沉淀完全;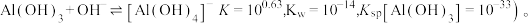
(7)该工艺可以利用滤渣1提取
 ,下图是
,下图是 晶胞,已知晶胞密度是
晶胞,已知晶胞密度是 ,用
,用 表示阿伏加德罗常数的值,则d=
表示阿伏加德罗常数的值,则d=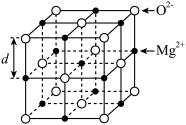
您最近一年使用:0次
解题方法
3 . 铬是最坚硬的金属,金刚石是自然界中最硬的物质。一种由铬铁矿(含 、MgO、
、MgO、 ,
, 等)为原料制备铬单质的流程如图所示。
等)为原料制备铬单质的流程如图所示。 ,
, 等。
等。
②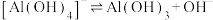
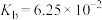 。
。
③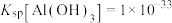
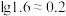 。
。
回答以下问题:
(1)焙烧时将矿料和NaOH进行研磨,目的是__________________ 。
(2)焙烧时生成 的化学方程式是
的化学方程式是__________________ 。
(3)已知0.1 mol/L 溶液中,铝形态的浓度(以
溶液中,铝形态的浓度(以 或
或 计)的对数(
计)的对数(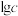 )随溶液pH变化的关系如图。
)随溶液pH变化的关系如图。______ 。(已知: 恰好在a~b的pH范围内完全沉淀)
恰好在a~b的pH范围内完全沉淀)
(4)工业上冶炼Cr的方法是______ 。基态Cr原子的价层电子排布图为____________ 。从原子结构及性质的角度分析金属Cr硬度很大的原因:________________________ 。
(5)晶体硅具有与金刚石相似的晶体结构(如图),已知Si原子半径为r pm,阿伏加德罗常数的值为 ,则晶体硅的密度为
,则晶体硅的密度为______ g/cm (列出计算表达式)。
(列出计算表达式)。____________ 。
 、MgO、
、MgO、 ,
, 等)为原料制备铬单质的流程如图所示。
等)为原料制备铬单质的流程如图所示。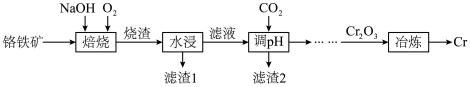
 ,
, 等。
等。②
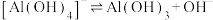
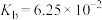 。
。③
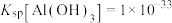
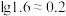 。
。回答以下问题:
(1)焙烧时将矿料和NaOH进行研磨,目的是
(2)焙烧时生成
 的化学方程式是
的化学方程式是(3)已知0.1 mol/L
 溶液中,铝形态的浓度(以
溶液中,铝形态的浓度(以 或
或 计)的对数(
计)的对数(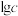 )随溶液pH变化的关系如图。
)随溶液pH变化的关系如图。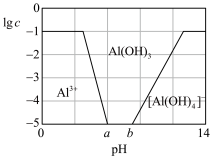
 恰好在a~b的pH范围内完全沉淀)
恰好在a~b的pH范围内完全沉淀)(4)工业上冶炼Cr的方法是
(5)晶体硅具有与金刚石相似的晶体结构(如图),已知Si原子半径为r pm,阿伏加德罗常数的值为
 ,则晶体硅的密度为
,则晶体硅的密度为 (列出计算表达式)。
(列出计算表达式)。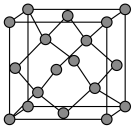
您最近一年使用:0次
2024-06-07更新
|
123次组卷
|
2卷引用:2024届新高考教学教研联盟高三下学期第一次联考化学试卷
4 . 铋 的化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为
的化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为 ,含
,含 、
、 、
、 等杂质)制备
等杂质)制备 的工艺流程如下:
的工艺流程如下: 易水解,
易水解, 难溶于冷水。
难溶于冷水。
ii.“氧化浸取”时,铋元素转化为 ,硫元素转化为硫单质。
,硫元素转化为硫单质。
iii
 。
。
回答下列问题。
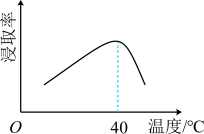
(1)滤渣1的主要成分为______ 。为提高“浸取”速率,采取的措施有:升高温度、__________________ (写出一条)。辉铋矿浸取率随温度的变化曲线如图,高于40℃时浸取率快速下降,其可能的原因是______________________________ 。 和
和 物质的量之比为
物质的量之比为______ 。
(3)“除铜”时发生反应:
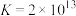 ,则
,则
______ 。
(4)“转化”时,生成 的离子方程式为
的离子方程式为________________________ 。
(5)取 产品
产品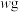 ,加入足量稀硫酸和
,加入足量稀硫酸和 稀溶液使其完全反应,再用
稀溶液使其完全反应,再用
 标准溶液滴定生成的
标准溶液滴定生成的 ,当溶液紫红色恰好褪去时,消耗
,当溶液紫红色恰好褪去时,消耗 标准溶液。该
标准溶液。该
产品的纯度为______ (用含w,a、b的代数式表示)。
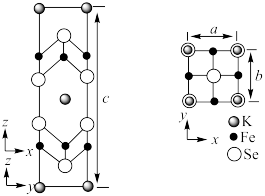
(6)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:__________________ 。
② 的配位数为
的配位数为______ 。
③该晶胞参数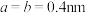 ,
, ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为__________________  (列出计算式)。
(列出计算式)。
 的化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为
的化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为 ,含
,含 、
、 、
、 等杂质)制备
等杂质)制备 的工艺流程如下:
的工艺流程如下: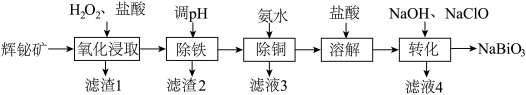
 易水解,
易水解, 难溶于冷水。
难溶于冷水。ii.“氧化浸取”时,铋元素转化为
 ,硫元素转化为硫单质。
,硫元素转化为硫单质。iii

 。
。回答下列问题。
(1)滤渣1的主要成分为
 和
和 物质的量之比为
物质的量之比为(3)“除铜”时发生反应:

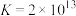 ,则
,则
(4)“转化”时,生成
 的离子方程式为
的离子方程式为(5)取
 产品
产品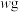 ,加入足量稀硫酸和
,加入足量稀硫酸和 稀溶液使其完全反应,再用
稀溶液使其完全反应,再用
 标准溶液滴定生成的
标准溶液滴定生成的 ,当溶液紫红色恰好褪去时,消耗
,当溶液紫红色恰好褪去时,消耗 标准溶液。该
标准溶液。该产品的纯度为
(6)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
②
 的配位数为
的配位数为③该晶胞参数
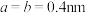 ,
, ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
5 . 锰废渣的硫酸浸出液含有大量 、
、 、
、 以及少量的
以及少量的 、
、 、
、 、
、 。通过沉淀-萃取法可以回收其中的锰、钴、镍,流程如图所示。
。通过沉淀-萃取法可以回收其中的锰、钴、镍,流程如图所示。
①萃取剂a和b均为有机物,可用通式HR表示,萃取金属离子时,发生反应: (M代表被萃取的金属)。
(M代表被萃取的金属)。
②已知常温下部分物质的 如表。
如表。
③不同条件下加入 对钙镁去除率的影响如图1、图2。
对钙镁去除率的影响如图1、图2。___________ 。
(2)写出加入 后发生反应的离子方程式
后发生反应的离子方程式___________ 。
(3)滤渣①的主要成分___________ 。
(4)根据图1、图2,选择除去钙镁离子的最适宜温度和pH分别是___________ 、___________ ,如果pH过低带来影响是___________ 。
(5)用平衡移动原理解释加入反萃取剂的作用___________ 。
(6)最后得到 溶液中,调节溶液
溶液中,调节溶液 ,加入
,加入 让
让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于___________ 。[已知: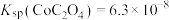 ,
,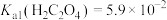 ,
, 结果保留三位小数]
结果保留三位小数]
 、
、 、
、 以及少量的
以及少量的 、
、 、
、 、
、 。通过沉淀-萃取法可以回收其中的锰、钴、镍,流程如图所示。
。通过沉淀-萃取法可以回收其中的锰、钴、镍,流程如图所示。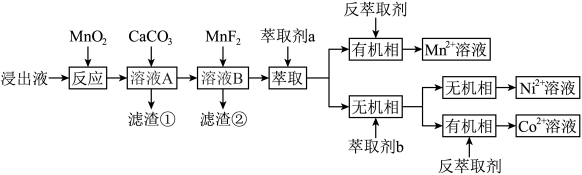
①萃取剂a和b均为有机物,可用通式HR表示,萃取金属离子时,发生反应:
 (M代表被萃取的金属)。
(M代表被萃取的金属)。②已知常温下部分物质的
 如表。
如表。| 物质 |  |  |  |  |  |  |  |
 |  | 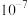 | 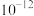 | 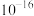 | 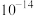 |  | 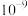 |
 对钙镁去除率的影响如图1、图2。
对钙镁去除率的影响如图1、图2。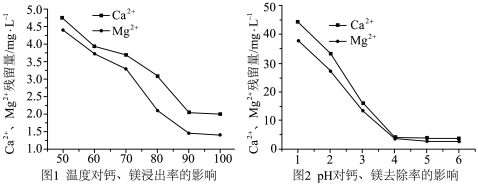
(2)写出加入
 后发生反应的离子方程式
后发生反应的离子方程式(3)滤渣①的主要成分
(4)根据图1、图2,选择除去钙镁离子的最适宜温度和pH分别是
(5)用平衡移动原理解释加入反萃取剂的作用
(6)最后得到
 溶液中,调节溶液
溶液中,调节溶液 ,加入
,加入 让
让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于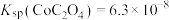 ,
,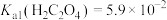 ,
, 结果保留三位小数]
结果保留三位小数]
您最近一年使用:0次
6 . 赤泥是氧化铝生产排放的固体废弃物。由赤泥(主要成分为 、
、 、
、 、FeO、CaO、
、FeO、CaO、 等)制备一种高效净水剂聚合硫酸铝铁(PAFS)的工艺流程如下。
等)制备一种高效净水剂聚合硫酸铝铁(PAFS)的工艺流程如下。 的空间结构是
的空间结构是______ 。
(2)“焙烧”时,需将赤泥粉碎的目的是______ 。
(3)酸浸渣的主要成分是______ (填化学式)。
(4)“氧化”时发生反应的离子方程式为______ 。室温下,向氧化后的溶液中滴加NaOH溶液至pH=4时,溶液中的
______  [已知25℃,
[已知25℃, 的
的 ]。
]。
(5)为了测试所制得的聚合硫酸铝铁的性能,取某水样,在不同pH条件下加入PAFS 并测定其去浊率,结果如图所示(已知去浊率越高,净水效果越好)。由图可知在设定的偏酸性和偏碱性条件下,水样的去浊率均不高。试分析pH<7时,去浊率较低的可能原因是
并测定其去浊率,结果如图所示(已知去浊率越高,净水效果越好)。由图可知在设定的偏酸性和偏碱性条件下,水样的去浊率均不高。试分析pH<7时,去浊率较低的可能原因是______ 。______ ,若晶体密度为 ,则晶胞中最近的两个碳原子的距离为
,则晶胞中最近的两个碳原子的距离为______ pm(阿伏加德罗常数的值用 表示,写出计算式即可)。
表示,写出计算式即可)。
 、
、 、
、 、FeO、CaO、
、FeO、CaO、 等)制备一种高效净水剂聚合硫酸铝铁(PAFS)的工艺流程如下。
等)制备一种高效净水剂聚合硫酸铝铁(PAFS)的工艺流程如下。
 的空间结构是
的空间结构是(2)“焙烧”时,需将赤泥粉碎的目的是
(3)酸浸渣的主要成分是
(4)“氧化”时发生反应的离子方程式为

 [已知25℃,
[已知25℃, 的
的 ]。
]。(5)为了测试所制得的聚合硫酸铝铁的性能,取某水样,在不同pH条件下加入PAFS
 并测定其去浊率,结果如图所示(已知去浊率越高,净水效果越好)。由图可知在设定的偏酸性和偏碱性条件下,水样的去浊率均不高。试分析pH<7时,去浊率较低的可能原因是
并测定其去浊率,结果如图所示(已知去浊率越高,净水效果越好)。由图可知在设定的偏酸性和偏碱性条件下,水样的去浊率均不高。试分析pH<7时,去浊率较低的可能原因是
 ,则晶胞中最近的两个碳原子的距离为
,则晶胞中最近的两个碳原子的距离为 表示,写出计算式即可)。
表示,写出计算式即可)。
您最近一年使用:0次
名校
解题方法
7 . 钪(Sc)是一种稀土金属元素,在国防、航天,核能等领域具有重要应用。氯化钪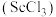 是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有
是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有 、
、 、
、 、
、 、
、 等)中回收
等)中回收 的工艺流程如下:
的工艺流程如下: 难溶于盐酸。
难溶于盐酸。
②常温下,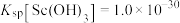 ,
, 。
。
回答下列问题:
(1)某次实验中需要使用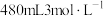 的盐酸,用浓盐酸(密度为
的盐酸,用浓盐酸(密度为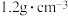 ,质量分数为
,质量分数为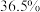 )配制实验所需要的盐酸,则需要量取浓盐酸的体积为
)配制实验所需要的盐酸,则需要量取浓盐酸的体积为___________  。
。
(2)滤渣1的主要成分是___________ (填化学式)。“酸浸”时温度过高,酸浸速率反而减慢,其原因是___________ 。
(3)常温下,“调 ”时,溶液中
”时,溶液中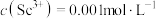 ,为除去杂质离子,应控制的
,为除去杂质离子,应控制的 范围是
范围是___________ (当溶液中某离子浓度c≤1.0×10-5mol/L时,可认为该离子沉淀完全)。
(4)“氧化”时反应的离子方程式为___________ 。
(5)实验室模拟流程中“灼烧”得到 ,用来盛放被灼烧物的仪器为
,用来盛放被灼烧物的仪器为___________ ,“加热氯化”步骤中所加入焦炭过量,写出由 制备三氯化钪反应的化学方程式:
制备三氯化钪反应的化学方程式:___________ 。
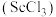 是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有
是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有 、
、 、
、 、
、 、
、 等)中回收
等)中回收 的工艺流程如下:
的工艺流程如下:
 难溶于盐酸。
难溶于盐酸。②常温下,
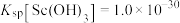 ,
, 。
。回答下列问题:
(1)某次实验中需要使用
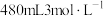 的盐酸,用浓盐酸(密度为
的盐酸,用浓盐酸(密度为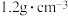 ,质量分数为
,质量分数为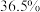 )配制实验所需要的盐酸,则需要量取浓盐酸的体积为
)配制实验所需要的盐酸,则需要量取浓盐酸的体积为 。
。(2)滤渣1的主要成分是
(3)常温下,“调
 ”时,溶液中
”时,溶液中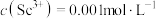 ,为除去杂质离子,应控制的
,为除去杂质离子,应控制的 范围是
范围是(4)“氧化”时反应的离子方程式为
(5)实验室模拟流程中“灼烧”得到
 ,用来盛放被灼烧物的仪器为
,用来盛放被灼烧物的仪器为 制备三氯化钪反应的化学方程式:
制备三氯化钪反应的化学方程式:
您最近一年使用:0次
2024-06-04更新
|
116次组卷
|
3卷引用:T16-工业流程题
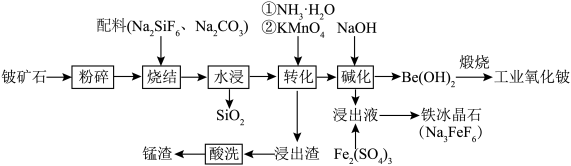
8 . 铍作为一种稀有元素,在航空航天、电子加工等领域具有重要意义。用铍矿石(含BeO及少量Ca、Mg、Mn元素)与配料生产工业氧化铍的工艺流程如下: 的还原产物为
的还原产物为 。回答下列问题:
。回答下列问题:
(1)若缺少粉碎步骤,产生的影响为_______ 。
(2)烧结时,若铍矿石中BeO恰好转化为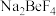 ,Si元素转化为
,Si元素转化为 ,则BeO发生反应的化学方程式为
,则BeO发生反应的化学方程式为_______ 。
(3)水浸后溶液中仍有未反应的 ,加入
,加入 后会转化为
后会转化为 沉淀,所得产物可除去溶液中的钙、镁元素,
沉淀,所得产物可除去溶液中的钙、镁元素, 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(4)水浸后溶液中Mn元素以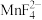 形式存在,加入稍过量
形式存在,加入稍过量 溶液煮沸50min至溶液
溶液煮沸50min至溶液______ 时说明反应结束。结合平衡移动原理解释酸洗时控制溶液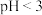 的原因:
的原因:______ 。
(5)碱化时,室温下加入NaOH,控制 ,析出颗粒状的
,析出颗粒状的 ,所得浸出液中
,所得浸出液中 ,此时溶液中
,此时溶液中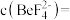
___  。已知
。已知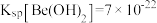 ,
,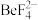 的解离常数
的解离常数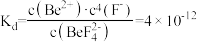
(6)碱化后浸出液中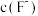 远高于排放标准,向其中加入硫酸铁生成
远高于排放标准,向其中加入硫酸铁生成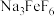 ,
, 为八面体结构,则Fe原子采取的杂化方式为
为八面体结构,则Fe原子采取的杂化方式为____ (填标号)。
A. B.
B. C.
C.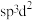
 的还原产物为
的还原产物为 。回答下列问题:
。回答下列问题:(1)若缺少粉碎步骤,产生的影响为
(2)烧结时,若铍矿石中BeO恰好转化为
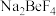 ,Si元素转化为
,Si元素转化为 ,则BeO发生反应的化学方程式为
,则BeO发生反应的化学方程式为(3)水浸后溶液中仍有未反应的
 ,加入
,加入 后会转化为
后会转化为 沉淀,所得产物可除去溶液中的钙、镁元素,
沉淀,所得产物可除去溶液中的钙、镁元素, 发生反应的离子方程式为
发生反应的离子方程式为(4)水浸后溶液中Mn元素以
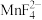 形式存在,加入稍过量
形式存在,加入稍过量 溶液煮沸50min至溶液
溶液煮沸50min至溶液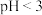 的原因:
的原因:(5)碱化时,室温下加入NaOH,控制
 ,析出颗粒状的
,析出颗粒状的 ,所得浸出液中
,所得浸出液中 ,此时溶液中
,此时溶液中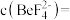
 。已知
。已知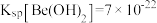 ,
,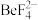 的解离常数
的解离常数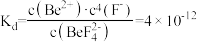
(6)碱化后浸出液中
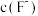 远高于排放标准,向其中加入硫酸铁生成
远高于排放标准,向其中加入硫酸铁生成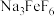 ,
, 为八面体结构,则Fe原子采取的杂化方式为
为八面体结构,则Fe原子采取的杂化方式为A.
 B.
B. C.
C.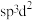
您最近一年使用:0次
2024-05-31更新
|
150次组卷
|
2卷引用:湖南省2024届普通高中高三下学期学业水平选择性考试临考预测押题密卷化学试题(A卷)
名校
解题方法
9 . 高砷烟尘(主要成分有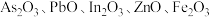 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;
② 在
在 易分解为
易分解为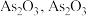 难溶于水;
难溶于水;
③ 。
。
回答下列问题:
(1)滤渣的主要成分为_______ (填化学式)。
(2)“高压酸浸”时, 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为_______ 。 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。已知 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为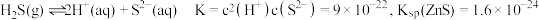 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
_______ 。
(4)“还原”后溶液酸性增强,主要原因是_______ (用离子方程式表示)。
(5)“结晶”操作为_______ 、过滤、洗涤、干燥。
(6)“萃余液”中含有的金属阳离子为_______ (填离子符号),将 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为_______ 。
(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用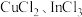 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是_______ ,该晶胞的六个面均为矩形,上、下底面的晶胞参数为 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为_______ (用含a、b、d的式子表示)。
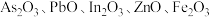 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: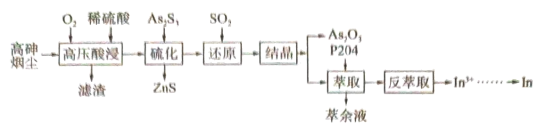
 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;②
 在
在 易分解为
易分解为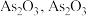 难溶于水;
难溶于水;③
 。
。回答下列问题:
(1)滤渣的主要成分为
(2)“高压酸浸”时,
 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为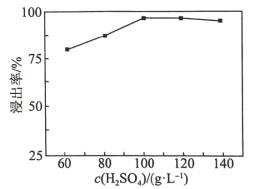
 ,发生反应的离子方程式为
,发生反应的离子方程式为 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为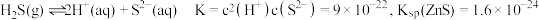 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
(4)“还原”后溶液酸性增强,主要原因是
(5)“结晶”操作为
(6)“萃余液”中含有的金属阳离子为
 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、
 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用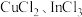 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
2024-05-31更新
|
234次组卷
|
5卷引用: 湖南省北师联盟2024届高三下学期模拟考试三模化学试题
10 . 铊(Tl)本身是一种剧毒物质,为毒性最大的金属元素之一,但是铊在工业中的用途非常广泛,主要存在于一些矿物和工业废水中,也可以从含铊的合金中提取.从某铅锌厂的富铊灰(主要成分为 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示:
①在氯化物-硫酸水溶液中,铊元素以 形式存在;
形式存在;
(2)萃取过程的反应原理为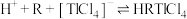 .
.
请回答下列问题:
(1)基态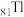 原子核外电子的运动状态有
原子核外电子的运动状态有________ 种.
(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有________________ (写出两条).
(3)写出“浸取I”中 发生反应的化学方程式:
发生反应的化学方程式:________________ ,“滤渣”的主要成分是________ (填化学式).
(4)请从化学平衡的角度解释“反萃取”过程中加入 溶液的原因:
溶液的原因:________________ .
(5)写出“还原氯化沉淀”中反应的离子方程式:________________ .
(6)通过沉淀法也可以去除工业废水中的 和
和 .
.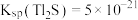 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中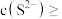
________  (假设污水中铊全部以
(假设污水中铊全部以 形式存在).
形式存在).
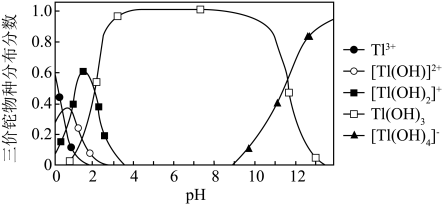
②向含铊废水中加入溴水,使 充分氧化成
充分氧化成 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是________________ .
 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示: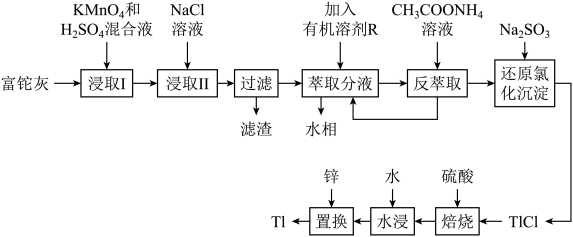
①在氯化物-硫酸水溶液中,铊元素以
 形式存在;
形式存在;(2)萃取过程的反应原理为
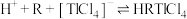 .
.请回答下列问题:
(1)基态
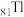 原子核外电子的运动状态有
原子核外电子的运动状态有(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有
(3)写出“浸取I”中
 发生反应的化学方程式:
发生反应的化学方程式:(4)请从化学平衡的角度解释“反萃取”过程中加入
 溶液的原因:
溶液的原因:(5)写出“还原氯化沉淀”中反应的离子方程式:
(6)通过沉淀法也可以去除工业废水中的
 和
和 .
.
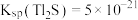 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中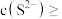
 (假设污水中铊全部以
(假设污水中铊全部以 形式存在).
形式存在).②向含铊废水中加入溴水,使
 充分氧化成
充分氧化成 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
您最近一年使用:0次



