名校
解题方法
1 . 某同学用 0.1000mol/L的 NaOH溶液滴定待测盐酸的浓度。其操作可分解为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.1000mol/L的标准NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2-3次。
请回答:
(1)以上步骤有错误的是_______ ,(填编号),该错误操作会导致测定结果_______ (填“偏大”、“偏小”或“无影响”)。_______ (填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果_______ (填“偏大”、“偏小”或“无影响”)。
(3)滴定中,滴定管液面的位置如图表示,其读数为_______ mL
(4)步骤⑤滴定时眼睛应注视_______ 。
(5)判断到达滴定终点的现象是:_______ 。
(6)该同学三次实验数据如下表。根据表中数据计算待测盐酸的浓度是_______ mol/L
(7)如果配制标准溶液的固体 NaOH 中含有 KOH杂质,会导致测定结果_______ (填“偏大”、“偏小”或“无影响”)。
①用蒸馏水洗涤碱式滴定管,注入0.1000mol/L的标准NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2-3次。
请回答:
(1)以上步骤有错误的是
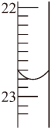
(3)滴定中,滴定管液面的位置如图表示,其读数为
(4)步骤⑤滴定时眼睛应注视
(5)判断到达滴定终点的现象是:
(6)该同学三次实验数据如下表。根据表中数据计算待测盐酸的浓度是
| 实验编号 | 待测盐酸体积/mL | 滴定前 NaOH 溶液体积读数/mL | 滴定后 NaOH 溶液体积读数/mL |
| 1 | 25.00 | 0.98 | 27.70 |
| 2 | 25.00 | 0.71 | 28.02 |
| 3 | 25.00 | 0.64 | 27.42 |
您最近半年使用:0次
解题方法
2 . 用NaOH标准溶液滴定食用白醋,测定其中醋酸含量的操作中正确的是
| A.盛白醋溶液的锥形瓶滴定前用白醋溶液润洗2~3次 |
| B.酸式滴定管在装液前要用白醋溶液润洗2~3次 |
| C.配标准溶液是称取4.0g NaOH固体放入1000mL容量瓶中,然后加水至刻度 |
| D.用甲基橙作指示剂,溶液恰好由红色变为黄色,为滴定终点 |
您最近半年使用:0次
3 . 室温下,在实验室中用0.1mol/L的NaOH溶液滴定10mL 0.1mol/L的盐酸,滴定曲线如图所示,
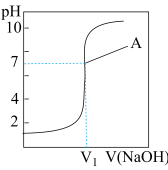
| A.V1=10mL | B.点A处溶质为NaCl |
| C.点A处曲线斜率最大 | D.滴定开始前盐酸pH为1 |
您最近半年使用:0次
名校
解题方法
4 . 25℃, 的HCl溶液滴定等浓度的一元碱MOH溶液的滴定曲线如图所示(“滴定分数”:所加滴定剂与被滴定组分的物质的量之比)。下列说法不正确的是
的HCl溶液滴定等浓度的一元碱MOH溶液的滴定曲线如图所示(“滴定分数”:所加滴定剂与被滴定组分的物质的量之比)。下列说法不正确的是
 的HCl溶液滴定等浓度的一元碱MOH溶液的滴定曲线如图所示(“滴定分数”:所加滴定剂与被滴定组分的物质的量之比)。下列说法不正确的是
的HCl溶液滴定等浓度的一元碱MOH溶液的滴定曲线如图所示(“滴定分数”:所加滴定剂与被滴定组分的物质的量之比)。下列说法不正确的是
| A.滴定操作时,可选用甲基橙做指示剂 |
| B.从x点到z点的滴定过程中,水的电离程度逐渐增大 |
C.x点处的溶液中满足: |
D.根据y点坐标可以得到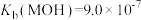 |
您最近半年使用:0次
5 . 向10mLHCOOH-NH4Cl混合溶液(浓度均为0.1mol·L−1)中滴加0.1mol·L−1NaOH溶液,并监测溶液pH变化,实验数据如图。由该实验可得到的结论是
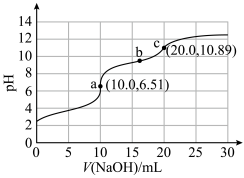
| A.HCOOH电离方程式为HCOOH=H++HCOO− |
| B.由a点数据可推出电离能力:HCOOH>NH3·H2O |
| C.b点溶液中的OH−主要来自HCOO−水解 |
| D.0.05mol·L−1氨水的pH<10.89 |
您最近半年使用:0次
名校
6 . 常温下,用0.1mol/L硝酸溶液滴定25.00mL0.1mol/LMOH(一元弱碱)溶液,滴定过程中,溶液的pH、M+和MOH的物质的量分数与滴加硝酸溶液体积的关系如图所示。下列叙述错误的是

| A.可选择甲基橙为指示剂判断滴定终点 |
| B.溶液导电能力:a点小于b点 |
| C.MOH电离平衡常数的数量级为10-5 |
| D.图中V1>12.5mL |
您最近半年使用:0次
名校
解题方法
7 . 乙二胺四乙酸铁铵(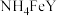 )为土黄色或浅褐色结晶性粉末,易溶于水,一些国家作为有机铁肥用于治疗植物缺铁性黄化病。科学家采用乙二胺四乙酸(俗称EDTA,可表示为
)为土黄色或浅褐色结晶性粉末,易溶于水,一些国家作为有机铁肥用于治疗植物缺铁性黄化病。科学家采用乙二胺四乙酸(俗称EDTA,可表示为 )、氧化铁、碳酸氢铵为主要原料,在相转移催化剂(PTC)存在下催化合成乙二胺四乙酸铁铵。流程如下:
)、氧化铁、碳酸氢铵为主要原料,在相转移催化剂(PTC)存在下催化合成乙二胺四乙酸铁铵。流程如下: 与
与 在催化剂作用下生成了HFeY,请写出铵化过程生成乙二胺四乙酸铁铵的化学反应方程式
在催化剂作用下生成了HFeY,请写出铵化过程生成乙二胺四乙酸铁铵的化学反应方程式______ 。
(2)探究反应物配比对产品质量的影响
当反应温度、催化剂用量、反应时间都在最佳状态时,反应物配比对产品质量的影响如表1,由表1数据得出,当反应物配比为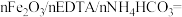
_____ 时,产品铁含量、铵含量及收率达最高,水不溶物含量最低。
表1 反应物配比对产品质量的影响( )
)
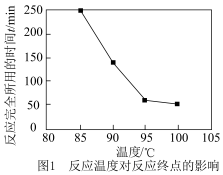
(3)反应温度对反应终点的影响如图1,当反应物配比、催化剂一定的条件下,最适宜温度为_______ ,原因:____ 。 )含量的测定,装置如图。
)含量的测定,装置如图。
Ⅱ.称取mg试样,移入圆底烧瓶内,加约300mL蒸馏水,20mL400g/L氢氧化钠溶液,立即连接冷凝装置。
Ⅲ.加热圆底烧瓶内溶液至沸腾,当收集到约150mL馏分时,馏出物明显减少,把锥形瓶稍微移开,使导出管靠在接收器壁上,再加大火力蒸1分钟,移去热源。
IV.向锥形瓶中加入指示剂甲基红-溴甲酚绿乙醇溶液,用浓度为cmol/L的盐酸标准液进行滴定,消耗盐酸标准液的体积为 。用相同的试剂但不含试样,进行空白试验,消耗盐酸标准液的体积为
。用相同的试剂但不含试样,进行空白试验,消耗盐酸标准液的体积为 。
。
①所用圆底烧瓶规格为____ mL,A装置的名称为____ 。
②步骤Ⅲ中当馏出物明显减少后,使导出管靠在锥形瓶壁上,再加大火力蒸1分钟的目的是____ 。
③请计算铵( )在试样中的质量分数
)在试样中的质量分数____ 。(用字母列出表达式)
④在滴定过程中会有以下操作,下列哪些操作会使测量值偏大____ (填标号)。
A.未润洗盐酸标准液的酸式滴定管 B.滴定过程中有标准液溅出
C.未润洗锥形瓶 D.滴定完成后俯视读数
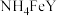 )为土黄色或浅褐色结晶性粉末,易溶于水,一些国家作为有机铁肥用于治疗植物缺铁性黄化病。科学家采用乙二胺四乙酸(俗称EDTA,可表示为
)为土黄色或浅褐色结晶性粉末,易溶于水,一些国家作为有机铁肥用于治疗植物缺铁性黄化病。科学家采用乙二胺四乙酸(俗称EDTA,可表示为 )、氧化铁、碳酸氢铵为主要原料,在相转移催化剂(PTC)存在下催化合成乙二胺四乙酸铁铵。流程如下:
)、氧化铁、碳酸氢铵为主要原料,在相转移催化剂(PTC)存在下催化合成乙二胺四乙酸铁铵。流程如下: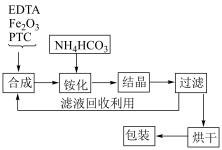
 与
与 在催化剂作用下生成了HFeY,请写出铵化过程生成乙二胺四乙酸铁铵的化学反应方程式
在催化剂作用下生成了HFeY,请写出铵化过程生成乙二胺四乙酸铁铵的化学反应方程式(2)探究反应物配比对产品质量的影响
当反应温度、催化剂用量、反应时间都在最佳状态时,反应物配比对产品质量的影响如表1,由表1数据得出,当反应物配比为
表1 反应物配比对产品质量的影响(
 )
)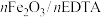 | 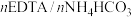 | 铁含量 | 铵含量 | 水不溶物含量 | 收率(%) |
| 0.49:1.0 | 1.0:0.98 | 13.1 | 4.0 | 1.4 | 92.3 |
| 0.49:1.0 | 1.0:1.0 | 13.2 | 4.3 | 0.03 | 91.2 |
| 0.49:1.0 | 1.0:1.02 | 13.2 | 4.4 | 0.03 | 91.6 |
| 0.5:1.0 | 1.0:0.98 | 13.3 | 4.1 | 0.04 | 93.1 |
| 0.5:1.0 | 1.0:1.0 | 13.6 | 4.4 | 0.01 | 96.3 |
| 0.5:1.0 | 1.0:1.02 | 13.5 | 4.4 | 0.05 | 91.7 |
| 0.51:1.0 | 1.0:0.98 | 13.5 | 4.1 | 0.51 | 93.1 |
| 0.51:1.0 | 1.0:1.0 | 13.4 | 4.2 | 0.47 | 93.3 |
| 0.51:1.0 | 1.0:1.02 | 13.4 | 4.2 | 0.54 | 92.1 |
(3)反应温度对反应终点的影响如图1,当反应物配比、催化剂一定的条件下,最适宜温度为
 )含量的测定,装置如图。
)含量的测定,装置如图。
Ⅱ.称取mg试样,移入圆底烧瓶内,加约300mL蒸馏水,20mL400g/L氢氧化钠溶液,立即连接冷凝装置。
Ⅲ.加热圆底烧瓶内溶液至沸腾,当收集到约150mL馏分时,馏出物明显减少,把锥形瓶稍微移开,使导出管靠在接收器壁上,再加大火力蒸1分钟,移去热源。
IV.向锥形瓶中加入指示剂甲基红-溴甲酚绿乙醇溶液,用浓度为cmol/L的盐酸标准液进行滴定,消耗盐酸标准液的体积为
 。用相同的试剂但不含试样,进行空白试验,消耗盐酸标准液的体积为
。用相同的试剂但不含试样,进行空白试验,消耗盐酸标准液的体积为 。
。①所用圆底烧瓶规格为
②步骤Ⅲ中当馏出物明显减少后,使导出管靠在锥形瓶壁上,再加大火力蒸1分钟的目的是
③请计算铵(
 )在试样中的质量分数
)在试样中的质量分数④在滴定过程中会有以下操作,下列哪些操作会使测量值偏大
A.未润洗盐酸标准液的酸式滴定管 B.滴定过程中有标准液溅出
C.未润洗锥形瓶 D.滴定完成后俯视读数
您最近半年使用:0次
2024-04-13更新
|
66次组卷
|
2卷引用:2024届河北省雄安新区雄安部分高中高三下学期一模化学试题
名校
解题方法
8 . 某学生用已知物质的量浓度的NaOH标准溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂。请回答下列问题:
(1)配制480mL 标准溶液。配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、
标准溶液。配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、______ 、胶头滴管等。
(2)观察下图,标准液NaOH溶液应放入______ 滴定管中。(填“甲”或“乙”)。
依据表中数据计算该盐酸溶液的物质的量浓度______ 。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有______ (填序号)。
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体中混有 固体
固体
D.滴定终点读数时俯视读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(5)滴定过程中边滴加边摇动锥形瓶,直到因加入半滴NaOH溶液后______ 表示已经到达滴定终点。
(1)配制480mL
 标准溶液。配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、
标准溶液。配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、(2)观察下图,标准液NaOH溶液应放入

| 滴定次数 | 待测盐酸的体积/mL | 标准NaOH溶液体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体中混有
 固体
固体D.滴定终点读数时俯视读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(5)滴定过程中边滴加边摇动锥形瓶,直到因加入半滴NaOH溶液后
您最近半年使用:0次
解题方法
9 . NaOH溶液可用于中和反应反应热测定和酸碱中和滴定实验中。回答下列问题:
(1)在实验室中进行中和反应反应热测定和中和滴定实验时,一定没有用到的仪器是_____ (填字母,下同)。_____ 。
(3)用标准NaOH溶液滴定未知浓度的盐酸时,下列操作可能会导致所测盐酸的物质的量浓度偏低的是_____。
(4)某实验小组用0.55mol·L-1的NaOH溶液和0.25mol·L-1的H2SO4溶液进行中和反应反应热的测定。取50mLNaOH溶液和50mLH2SO4溶液在_____ (填仪器名称)中进行实验。数据如下:
近似认为50mL0.55mol·L-1NaOH溶液和50mL0.25mol·L-1H2SO4溶液的密度都是1g·mL-1,中和后生成溶液的比热容c=4.18J·g-1·℃-1,则测得中和反应反应热(生成1molH2O) ΔH=_____ kJ・mol-1(精确到小数点后一位)。
(5)常温下,在25.00mL氢氧化钠溶液中逐滴加入0.2000mol·L-1的醋酸溶液,滴定曲线如图所示。_____ mol·L-1。
②若所加入的酸为0.2000mol·L-1的盐酸,则D点时溶液的c(H+)=_____ mol·L-1。
(1)在实验室中进行中和反应反应热测定和中和滴定实验时,一定没有用到的仪器是
(3)用标准NaOH溶液滴定未知浓度的盐酸时,下列操作可能会导致所测盐酸的物质的量浓度偏低的是_____。
| A.碱式滴定管用蒸馏水洗净后,直接注入标准浓度的NaOH溶液 |
| B.碱式滴定管尖端滴定前无气泡,滴定后有气泡 |
| C.记录消耗的碱液,滴定前平视读数,滴定后仰视读数 |
| D.锥形瓶未用待测盐酸润洗 |
(4)某实验小组用0.55mol·L-1的NaOH溶液和0.25mol·L-1的H2SO4溶液进行中和反应反应热的测定。取50mLNaOH溶液和50mLH2SO4溶液在
| 实验次数 | 起始温度T1/C | 终止温度T2/°C | ||
| H2SO4 | NaOH | 平均值 25.1 26.3 25.3 26.3 | ||
| 1 | 25.2 | 25.0 | 28.5 | |
| 2 | 26.2 | 26.4 | 32.5 | |
| 3 | 25.3 | 25.3 | 28.8 | |
| 4 | 26.1 | 26.5 | 29.6 | |
(5)常温下,在25.00mL氢氧化钠溶液中逐滴加入0.2000mol·L-1的醋酸溶液,滴定曲线如图所示。

②若所加入的酸为0.2000mol·L-1的盐酸,则D点时溶液的c(H+)=
您最近半年使用:0次
10 . 室温下,向20.00mL 盐酸中滴加
盐酸中滴加 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。下列说法错误的是
NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。下列说法错误的是
 盐酸中滴加
盐酸中滴加 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。下列说法错误的是
NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。下列说法错误的是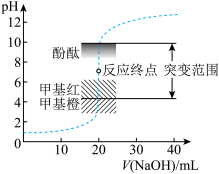
A.NaOH与盐酸恰好完全反应时, |
| B.选择变色范围在pH突变范围内的指示剂,可减小实验误差 |
| C.选择甲基红指示反应终点,误差比甲基橙的大 |
D.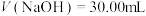 时,水电离受到抑制 时,水电离受到抑制 |
您最近半年使用:0次



