1 . 室温下,某 溶液体系中满足
溶液体系中满足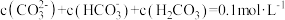 ,现利用平衡移动原理,研究
,现利用平衡移动原理,研究 在不同pH的
在不同pH的 体系中的可能产物。图1中曲线表示
体系中的可能产物。图1中曲线表示 体系中各含碳粒子的物质的量分数与pH的关系;图2为沉淀溶解平衡曲线,曲线Ⅰ的离子浓度关系符合
体系中各含碳粒子的物质的量分数与pH的关系;图2为沉淀溶解平衡曲线,曲线Ⅰ的离子浓度关系符合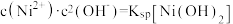 ,曲线Ⅱ的离子浓度关系符合
,曲线Ⅱ的离子浓度关系符合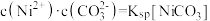 ,不同pH下
,不同pH下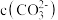 由图1得到。下列说法错误的是
由图1得到。下列说法错误的是
 溶液体系中满足
溶液体系中满足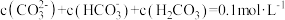 ,现利用平衡移动原理,研究
,现利用平衡移动原理,研究 在不同pH的
在不同pH的 体系中的可能产物。图1中曲线表示
体系中的可能产物。图1中曲线表示 体系中各含碳粒子的物质的量分数与pH的关系;图2为沉淀溶解平衡曲线,曲线Ⅰ的离子浓度关系符合
体系中各含碳粒子的物质的量分数与pH的关系;图2为沉淀溶解平衡曲线,曲线Ⅰ的离子浓度关系符合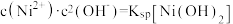 ,曲线Ⅱ的离子浓度关系符合
,曲线Ⅱ的离子浓度关系符合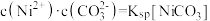 ,不同pH下
,不同pH下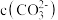 由图1得到。下列说法错误的是
由图1得到。下列说法错误的是
A.由图1, 的水解平衡常数的数量级是 的水解平衡常数的数量级是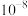 |
B.图2中M点,溶液中存在 |
C.图2中P点,存在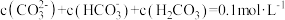 |
D.沉淀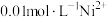 制备 制备 时,选用 时,选用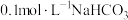 溶液比 溶液比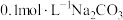 溶液效果好 溶液效果好 |
您最近半年使用:0次
名校
2 . 下列实验方案设计现象和结论都正确的是
| 选项 | 实验方案 | 现象 | 结论 |
| A | 将 溶于水,进行导电性实验 溶于水,进行导电性实验 |  溶液可导电 溶液可导电 | 由此可证明 中含有离子键 中含有离子键 |
| B | 在试管中仅加入 无水乙醇和 无水乙醇和 冰醋酸,混合后,酒精灯缓缓加热,将产生的蒸汽经导管通入到饱和碳酸钠溶液中,反应结束后充分振荡盛有饱和碳酸钠溶液的试管 冰醋酸,混合后,酒精灯缓缓加热,将产生的蒸汽经导管通入到饱和碳酸钠溶液中,反应结束后充分振荡盛有饱和碳酸钠溶液的试管 | 溶液分层 | 制备获得乙酸乙酯 |
| C | 加热铜与浓硫酸的混合物,充分反应后冷却,将试管里的物质慢慢倒入盛水的烧杯中 | 试管底部有灰白色固体,稀释后溶液变蓝 | 浓硫酸具有氧化性,与铜反应生成硫酸铜 |
| D | 用pH试纸分别测定等物质的量浓度的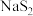 和 和 溶液的pH 溶液的pH | 前者pH大 | 非金属性:S<Cl |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
3 . 回答下列问题
(1)盐碱地(含较多 、NaCl)不利于植物生长,盐碱地呈碱性的原因:
、NaCl)不利于植物生长,盐碱地呈碱性的原因:___________ (用离子方程式表示)。
(2)D元素的正三价离子的3d轨道为半充满,其基态原子的价层电子排布式为___________ 。
(3)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的简化电子排布式为___________ ,在元素周期表中的位置是___________ 。
(4) 是离子化合物,各原子均满足8电子稳定结构,
是离子化合物,各原子均满足8电子稳定结构, 的电子式是
的电子式是___________ 。
(5)Xe是第五周期的稀有气体元素,与F形成的 室温下易升华。下列对
室温下易升华。下列对 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是___________ (填字母)。
(6)为测定某 消毒剂样品中含氯量,用
消毒剂样品中含氯量,用 溶液滴定该样品溶液,操作如下:
溶液滴定该样品溶液,操作如下:
a.取样:取20.00 mL样品溶液置于锥形瓶,加入稀硫酸酸化,发生反应: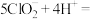
 (
( 极易溶于水);
极易溶于水);
b.氧化:加入足量碘化钾溶液,振荡充分反应;
c.滴定:加入淀粉作指示剂,在锥形瓶下垫一张白纸,用0.1000 mol/L 标准溶液滴定碘单质(已知:
标准溶液滴定碘单质(已知: );
);
d.重复上述操作三次。
滴定终点现象为:加入最后半滴 溶液后,溶液
溶液后,溶液___________ ,即到终点。
测得的实验数据如下表:
由以上数据计算该样品溶液的含氯量(以 计)
计)___________ g/L(保留三位有效数字)。滴定时,有一组数据出现了明显异常,所测含氯量偏大,原因可能有___________ (填字母序号)。
A.取样时用25.00 mL的滴定管液面在5.00 mL处放出所有溶液
B.滴定终点读数时仰视刻度线
C.达终点时滴定管尖嘴有标准液悬挂
D.盛装待测液的锥形瓶未润洗
E.摇动锥形瓶时有液体溅出
(1)盐碱地(含较多
 、NaCl)不利于植物生长,盐碱地呈碱性的原因:
、NaCl)不利于植物生长,盐碱地呈碱性的原因:(2)D元素的正三价离子的3d轨道为半充满,其基态原子的价层电子排布式为
(3)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的简化电子排布式为
(4)
 是离子化合物,各原子均满足8电子稳定结构,
是离子化合物,各原子均满足8电子稳定结构, 的电子式是
的电子式是(5)Xe是第五周期的稀有气体元素,与F形成的
 室温下易升华。下列对
室温下易升华。下列对 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是| A.sp | B. | C. | D. |
 消毒剂样品中含氯量,用
消毒剂样品中含氯量,用 溶液滴定该样品溶液,操作如下:
溶液滴定该样品溶液,操作如下:a.取样:取20.00 mL样品溶液置于锥形瓶,加入稀硫酸酸化,发生反应:
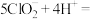
 (
( 极易溶于水);
极易溶于水);b.氧化:加入足量碘化钾溶液,振荡充分反应;
c.滴定:加入淀粉作指示剂,在锥形瓶下垫一张白纸,用0.1000 mol/L
 标准溶液滴定碘单质(已知:
标准溶液滴定碘单质(已知: );
);d.重复上述操作三次。
滴定终点现象为:加入最后半滴
 溶液后,溶液
溶液后,溶液测得的实验数据如下表:
| 实验序号 | 待测液体积(mL) |  标准溶液 标准溶液 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 20.00 | 0.06 | 20.60 |
| 2 | 20.00 | 6.00 | 25.95 |
| 3 | 20.00 | 1.40 | 23.20 |
| 4 | 20.00 | 1.00 | 21.05 |
 计)
计)A.取样时用25.00 mL的滴定管液面在5.00 mL处放出所有溶液
B.滴定终点读数时仰视刻度线
C.达终点时滴定管尖嘴有标准液悬挂
D.盛装待测液的锥形瓶未润洗
E.摇动锥形瓶时有液体溅出
您最近半年使用:0次
名校
解题方法
4 . 已知25℃时,几种弱酸的电离常数如下:
25℃时,下列说法正确的是
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 |  |  | 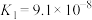 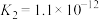 |
| A.某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-d mol/L |
| B.用0.1 mol/L的NaOH溶液滴定pH相等的CH3COOH和HCN溶液,CH3COOH消耗的NaOH溶液体积更大 |
C.NaHS和Na2S的混合溶液中,一定存在 |
| D.常温下,pH=4的CH3COOH和pH=10的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
您最近半年使用:0次
名校
5 . 设NA为阿伏加德罗常数的值。下列说法不正确的是
| A.2molSO2与1molO2完全反应转移的电子数为4NA |
| B.铅蓄电池中,当正极质量增加9.6g时,电路中通过的电子数目为0.3NA |
| C.11.2L CH4和22.4L Cl2 (均为标准状况)在光照下充分反应后的分子数为1.5NA |
| D.1L0.1mol·L−1Na2CO3溶液,阴离子总数大于0.1NA |
您最近半年使用:0次
6 . 已知 H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、9.6、3.7。现有含FeCl2杂质的氯化铜晶体(CuCl2∙2H2O),为制取纯净的CuCl2∙2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
(1)本实验最适合的氧化剂X是___________(填序号)。
(2)物质Y可以选择以下___________。
(3)本实验用加碱沉淀法能不能达到目的?___________ (填“能”或“不能”)。
(4)加氧化剂的目的是___________ 。
(5)最后蒸发结晶要想得到CuCl2∙2H2O晶体,应如何操作?___________ 。
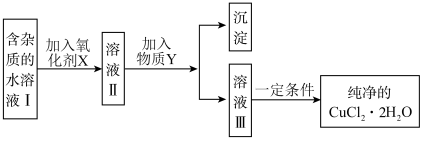
(1)本实验最适合的氧化剂X是___________(填序号)。
| A.K2Cr2O7 | B.NaClO | C. H2O2 | D.KMnO4 |
(2)物质Y可以选择以下___________。
| A.CuO | B.CuSO4 | C.Cu(OH)2 | D.KOH |
(3)本实验用加碱沉淀法能不能达到目的?
(4)加氧化剂的目的是
(5)最后蒸发结晶要想得到CuCl2∙2H2O晶体,应如何操作?
您最近半年使用:0次
解题方法
7 . 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)从①组情况分析,HA是___________ (填“强酸”或“弱酸”)。
(2)②组情况表明,c___________ (填“大于”、“小于”或“等于”)0.2mol/L。混合液中离子浓度c(A-)与c(Na+)的大小关系是:c(A-)___________ c(Na+) (“大于”、“小于”或“等于”)。
(3)从③组实验结果分析,说明HA的电离程度___________ (填“大于”、“小于”或“等于”)NaA的水解程度。
(4)①组实验所得混合溶液中由水电离出的c(OH-)=___________ mol∙L-1。
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的 pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(1)从①组情况分析,HA是
(2)②组情况表明,c
(3)从③组实验结果分析,说明HA的电离程度
(4)①组实验所得混合溶液中由水电离出的c(OH-)=
您最近半年使用:0次
8 . 水中存在电离平衡:H2O H++OH-。若在水中分别加入下列各物质:
H++OH-。若在水中分别加入下列各物质:
①NaOH(s) ②NH4Cl(s) ③Na2CO3(s) ④CH3COOH(l) ⑤K2SO4(s),试回答下列问题:
(1)能使水的电离平衡向左移动的是___________ ,不发生移动的是___________ 。(用序号填空)
(2)溶液呈酸性的是___________ ,溶液呈碱性的是___________ 。(用序号填空)
(3)能促进水的电离,且溶液pH>7的是___________ 。(用序号填空)
(4)将0.1mol CH3COOH溶于水制成1L溶液,此溶液的物质的量浓度为0.1mol/L,经测定溶液中c(CH3COO-)为1.4×10-3mol∙L-1,此温度下醋酸的电离常数Ka=___________ ,温度升高,Ka将___________ (填“变大”、“不变”或“变小”)。
(5)向 溶液中滴入酚酞试液,观察到的现象是
溶液中滴入酚酞试液,观察到的现象是___________ ,若微热溶液,观察到的现象是___________ ,由此证明碳酸钠的水解是___________ (填“吸热”或“放热”)反应。 溶液中
溶液中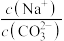
___________ 2(填“大于”或“小于”),能使其比值接近2的措施是___________ (填序号)。
①加入适量盐酸 ②加入适量NaOH固体 ③加入适量KOH固体 ④加热
 H++OH-。若在水中分别加入下列各物质:
H++OH-。若在水中分别加入下列各物质:①NaOH(s) ②NH4Cl(s) ③Na2CO3(s) ④CH3COOH(l) ⑤K2SO4(s),试回答下列问题:
(1)能使水的电离平衡向左移动的是
(2)溶液呈酸性的是
(3)能促进水的电离,且溶液pH>7的是
(4)将0.1mol CH3COOH溶于水制成1L溶液,此溶液的物质的量浓度为0.1mol/L,经测定溶液中c(CH3COO-)为1.4×10-3mol∙L-1,此温度下醋酸的电离常数Ka=
(5)向
 溶液中滴入酚酞试液,观察到的现象是
溶液中滴入酚酞试液,观察到的现象是 溶液中
溶液中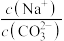
①加入适量盐酸 ②加入适量NaOH固体 ③加入适量KOH固体 ④加热
您最近半年使用:0次
解题方法
9 . 回答下列问题。
(1)在某温度下,向含有AgCl固体的AgCl饱和溶液中通入少量HCl,则AgCl的溶解度___________ (填“增大”“减小”或“不变”,下同),Ksp___________ ,c(Ag+)___________ 。
(2)在25℃时对氨水进行如下操作,若向氨水中加入稀硫酸,使氨水恰好被中和,所得溶液的pH___________ 7(“大于”、“小于”或“等于”);若向氨水中加入稀硫酸至溶液的pH=7,此时溶液中 =amol/L,则
=amol/L,则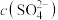 =
=___________ 。
(3)若要在铁制品表面镀镍,电镀液用硫酸镍溶液,则镍应与电源的___________ 极相连,铁制品应与电源的___________ 极相连。电镀过程中硫酸镍溶液中溶质的浓度会___________ (填“增大”“减小”或“不变”)。
(1)在某温度下,向含有AgCl固体的AgCl饱和溶液中通入少量HCl,则AgCl的溶解度
(2)在25℃时对氨水进行如下操作,若向氨水中加入稀硫酸,使氨水恰好被中和,所得溶液的pH
 =amol/L,则
=amol/L,则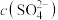 =
=(3)若要在铁制品表面镀镍,电镀液用硫酸镍溶液,则镍应与电源的
您最近半年使用:0次
名校
解题方法
10 . 制备锂离子电池的正极材料的前体 的一种流程如下:
的一种流程如下:
ii. 可溶于水,
可溶于水, 微溶于水
微溶于水
iii.
iv.
I.制备
1.用 溶液、
溶液、 溶液分步浸取磷灰石生成HF、
溶液分步浸取磷灰石生成HF、 和
和 ,主要反应的化学方程式为
,主要反应的化学方程式为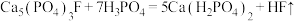 和
和
___________ 。
2.增大酸浸反应速率的措施有___________ (写1条)。
3.其他条件不变时,若仅用 溶液酸浸,浸取的速率低于用
溶液酸浸,浸取的速率低于用 、
、 分步浸取法,原因是
分步浸取法,原因是___________ 。
II.制备
将 、
、 、
、 混合并调节溶液的pH制备
混合并调节溶液的pH制备 。
。
4.酸性条件下,生成 的离子方程式是
的离子方程式是___________ 。
常温下,利用NaOH调节 溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。
溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。
6. 时,溶液中的
时,溶液中的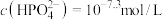 ,则
,则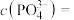
___________  ,再加入
,再加入 晶体、
晶体、 溶液使溶液中的
溶液使溶液中的 ,不考虑溶液体积的变化,通过计算说明此时能否产生
,不考虑溶液体积的变化,通过计算说明此时能否产生 沉淀
沉淀___________ 。
 的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
7.研究表明,沉淀时可加入含 的溶液,
的溶液, 的作用是
的作用是___________ 。
8.配离子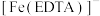 的结构如图所示,图中M代表
的结构如图所示,图中M代表 。EDTA中碳原子的杂化方式为
。EDTA中碳原子的杂化方式为___________ , 的配位数为
的配位数为___________ 。 而不是更高的pH制备
而不是更高的pH制备 ,可能的原因是
,可能的原因是___________ 、___________ (答出2点)。
 的一种流程如下:
的一种流程如下:

ii.
 可溶于水,
可溶于水, 微溶于水
微溶于水iii.

iv.

I.制备

1.用
 溶液、
溶液、 溶液分步浸取磷灰石生成HF、
溶液分步浸取磷灰石生成HF、 和
和 ,主要反应的化学方程式为
,主要反应的化学方程式为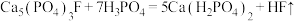 和
和
2.增大酸浸反应速率的措施有
3.其他条件不变时,若仅用
 溶液酸浸,浸取的速率低于用
溶液酸浸,浸取的速率低于用 、
、 分步浸取法,原因是
分步浸取法,原因是II.制备

将
 、
、 、
、 混合并调节溶液的pH制备
混合并调节溶液的pH制备 。
。4.酸性条件下,生成
 的离子方程式是
的离子方程式是常温下,利用NaOH调节
 溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。
溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。 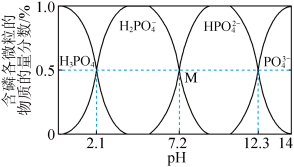
A. 的电离方程式为: 的电离方程式为: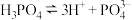 |
B.M点时,溶液中 |
C. 时,溶液 时,溶液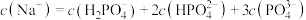 |
D. 时,溶液中水的电离程度比纯水大 时,溶液中水的电离程度比纯水大 |
 时,溶液中的
时,溶液中的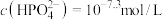 ,则
,则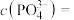
 ,再加入
,再加入 晶体、
晶体、 溶液使溶液中的
溶液使溶液中的 ,不考虑溶液体积的变化,通过计算说明此时能否产生
,不考虑溶液体积的变化,通过计算说明此时能否产生 沉淀
沉淀 的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。7.研究表明,沉淀时可加入含
 的溶液,
的溶液, 的作用是
的作用是8.配离子
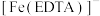 的结构如图所示,图中M代表
的结构如图所示,图中M代表 。EDTA中碳原子的杂化方式为
。EDTA中碳原子的杂化方式为 的配位数为
的配位数为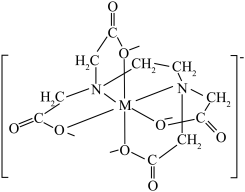
 而不是更高的pH制备
而不是更高的pH制备 ,可能的原因是
,可能的原因是
您最近半年使用:0次



