解题方法
1 . 利用氟磷灰石[主要成分为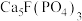 杂质为
杂质为 等]为原料生产可应用于巨型激光器“神光二号”的磷酸二氢钾(
等]为原料生产可应用于巨型激光器“神光二号”的磷酸二氢钾( ),工艺流程如下。
),工艺流程如下。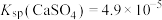 ,
,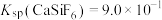 ,
,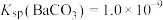 ,
,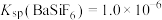 ,
,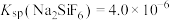 。
。
(1)“酸浸Ⅰ”中生成 ,其化学方程式为
,其化学方程式为______ 。
(2)“酸浸Ⅱ”中,滤渣的主要成分为______ 。
(3)“脱氟”中试剂X为______ (填“ ”或“
”或“ ”);当
”);当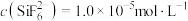 时,溶液中试剂X电离出的剩余金属阳离子的浓度为
时,溶液中试剂X电离出的剩余金属阳离子的浓度为______  。
。
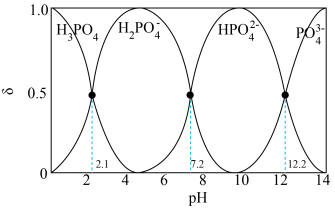
(4)“中和法”为获得较高纯度的 ,控制pH范围为
,控制pH范围为______ ;在此pH范围内纯度的 溶液中各微粒浓度大小关系为
溶液中各微粒浓度大小关系为______ 。
已知:溶液中 、
、 、
、 、
、 的分布分数
的分布分数 随pH变化曲线如图。[如
随pH变化曲线如图。[如 分布分数:
分布分数: ]
]______ 。
②分析产品室可得到 的原因
的原因______ 。
③相较于“中和法”,“电解法”的优点有______ (写出2条即可)。
 杂质为
杂质为 等]为原料生产可应用于巨型激光器“神光二号”的磷酸二氢钾(
等]为原料生产可应用于巨型激光器“神光二号”的磷酸二氢钾( ),工艺流程如下。
),工艺流程如下。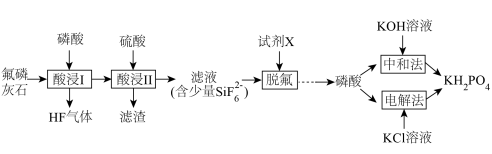
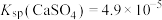 ,
,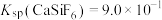 ,
,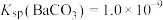 ,
,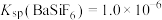 ,
,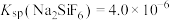 。
。(1)“酸浸Ⅰ”中生成
 ,其化学方程式为
,其化学方程式为(2)“酸浸Ⅱ”中,滤渣的主要成分为
(3)“脱氟”中试剂X为
 ”或“
”或“ ”);当
”);当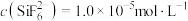 时,溶液中试剂X电离出的剩余金属阳离子的浓度为
时,溶液中试剂X电离出的剩余金属阳离子的浓度为 。
。(4)“中和法”为获得较高纯度的
 ,控制pH范围为
,控制pH范围为 溶液中各微粒浓度大小关系为
溶液中各微粒浓度大小关系为已知:溶液中
 、
、 、
、 、
、 的分布分数
的分布分数 随pH变化曲线如图。[如
随pH变化曲线如图。[如 分布分数:
分布分数: ]
]
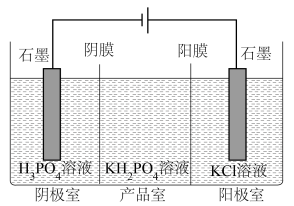
②分析产品室可得到
 的原因
的原因③相较于“中和法”,“电解法”的优点有
您最近半年使用:0次
2 . 以银锰精矿(主要含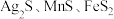 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银、锰及
)为原料联合提取银、锰及 的一种流程示意图如下:
的一种流程示意图如下: 的氧化性强于
的氧化性强于 。
。
(1)“浸锰渣”含有S和 ,写出“浸锰”过程中,二氧化锰和硫化锰反应的化学方程式:
,写出“浸锰”过程中,二氧化锰和硫化锰反应的化学方程式:_______ 。
(2)“除杂”时,若溶液中 ,欲使溶液中
,欲使溶液中 浓度小于
浓度小于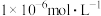 ,需控制的
,需控制的 范围为
范围为_______ (已知:室温下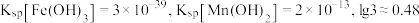 )。
)。
(3)沉锰过程在 为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。沉锰反应中,锰沉淀率在
为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。沉锰反应中,锰沉淀率在 左右达最大的原因是
左右达最大的原因是_______ 。 晶体的晶胞示意图如图1,晶胞的俯视图和正视图如图2。
晶体的晶胞示意图如图1,晶胞的俯视图和正视图如图2。_______  (用含有a、b及
(用含有a、b及 的代数式表示)。
的代数式表示)。
(5)“浸银”时,使用过量 和
和 混合液作为浸出剂,将
混合液作为浸出剂,将 中的银以
中的银以 形式浸出并生成S。写出“浸银”反应的离子方程式:
形式浸出并生成S。写出“浸银”反应的离子方程式:_______ 。“沉银”过程中需要过量的铁粉作为还原剂,“沉银”后的滤液中,主要含有的阳离子有_______ 。
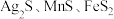 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银、锰及
)为原料联合提取银、锰及 的一种流程示意图如下:
的一种流程示意图如下: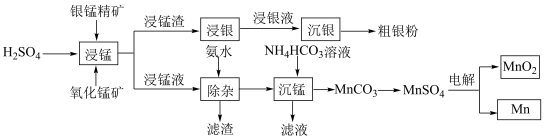
 的氧化性强于
的氧化性强于 。
。(1)“浸锰渣”含有S和
 ,写出“浸锰”过程中,二氧化锰和硫化锰反应的化学方程式:
,写出“浸锰”过程中,二氧化锰和硫化锰反应的化学方程式:(2)“除杂”时,若溶液中
 ,欲使溶液中
,欲使溶液中 浓度小于
浓度小于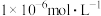 ,需控制的
,需控制的 范围为
范围为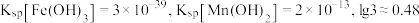 )。
)。(3)沉锰过程在
 为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。沉锰反应中,锰沉淀率在
为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。沉锰反应中,锰沉淀率在 左右达最大的原因是
左右达最大的原因是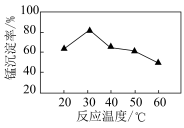
 晶体的晶胞示意图如图1,晶胞的俯视图和正视图如图2。
晶体的晶胞示意图如图1,晶胞的俯视图和正视图如图2。
①图1中“ ”代表的是
”代表的是 ”或“O”),对应图2中的
”或“O”),对应图2中的
 (用含有a、b及
(用含有a、b及 的代数式表示)。
的代数式表示)。(5)“浸银”时,使用过量
 和
和 混合液作为浸出剂,将
混合液作为浸出剂,将 中的银以
中的银以 形式浸出并生成S。写出“浸银”反应的离子方程式:
形式浸出并生成S。写出“浸银”反应的离子方程式:
您最近半年使用:0次
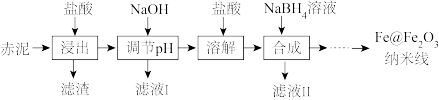
3 . Fe@Fe2O3纳米线是一种新型铁基材料,在催化、生物医药、环境科学等领域具有广阔应用前景。某研究小组以赤泥(铝土矿提取氧化铝过程中产生的固体废弃物,含SiO2、Fe2O3、Al2O3)为原料,设计下列流程制备Fe@Fe2O3纳米线并探究其在水处理中的应用。
(1)“浸出”实验中,盐酸起始浓度对铁、铝浸出率的影响如图所示:___________ 。
②盐酸起始浓度为2 mol·L-1时,铁的浸出率很低,原因是___________ 。
(2)铁的晶胞如图所示,若该晶体的密度是a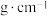 ,则两个最近的Fe原子间的距离为
,则两个最近的Fe原子间的距离为___________ cm(设NA为阿伏加德罗常数的值)。 AlO
AlO + H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为
+ H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为___________ (设调节pH过程中溶液体积不变)。
(4)Fe@Fe2O3纳米线为壳层结构(核是Fe、壳是Fe2O3),壳是由中心铁核在合成过程中被氧化而形成。
①“合成”时滴加NaBH4溶液过程中伴有气泡产生,滤液II中含B(OH)3,合成铁核的离子方程式为___________ 。
②“合成”后,经过滤、___________ 、___________ 获得Fe@Fe2O3纳米线。
(1)“浸出”实验中,盐酸起始浓度对铁、铝浸出率的影响如图所示:
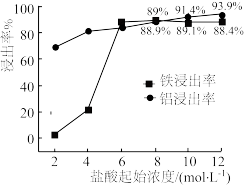
②盐酸起始浓度为2 mol·L-1时,铁的浸出率很低,原因是
(2)铁的晶胞如图所示,若该晶体的密度是a
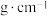 ,则两个最近的Fe原子间的距离为
,则两个最近的Fe原子间的距离为
 AlO
AlO + H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为
+ H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为(4)Fe@Fe2O3纳米线为壳层结构(核是Fe、壳是Fe2O3),壳是由中心铁核在合成过程中被氧化而形成。
①“合成”时滴加NaBH4溶液过程中伴有气泡产生,滤液II中含B(OH)3,合成铁核的离子方程式为
②“合成”后,经过滤、
您最近半年使用:0次
2024高三下·全国·专题练习
4 . 已知Ka(Kb)、Kw、Kh、Ksp分别表示弱酸的电离平衡常数(弱碱的电离平衡常数)、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。通过查阅资料获得温度为25℃时以下数据:Kw=1.0×10-14,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,Ka(HF)=4.0×10-4,Ksp[Mg(OH)2]=1.8×10-11。
(1)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq) Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=___________ ,并据此推断Mg(OH)2___________ (填“能”或“不能”)溶解于醋酸(已知1.83≈5.8)。
(1)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq)
 Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
您最近半年使用:0次
5 . 回答下列问题。
(1)锅炉水垢的主要成分是碳酸钙和硫酸钙,清洗时,经常先加入饱和的碳酸钠溶液浸泡,最后用酸溶解。结合沉淀溶解平衡原理解释清洗硫酸钙的过程___________ 。
(2)当器壁上附有 很难除去时,也常采用沉淀转化的方法。已知某温度下
很难除去时,也常采用沉淀转化的方法。已知某温度下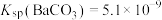 ,
,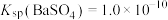 。在该温度下要使
。在该温度下要使 转化成
转化成 ,
, 溶液的浓度应大于
溶液的浓度应大于___________  。
。
(1)锅炉水垢的主要成分是碳酸钙和硫酸钙,清洗时,经常先加入饱和的碳酸钠溶液浸泡,最后用酸溶解。结合沉淀溶解平衡原理解释清洗硫酸钙的过程
(2)当器壁上附有
 很难除去时,也常采用沉淀转化的方法。已知某温度下
很难除去时,也常采用沉淀转化的方法。已知某温度下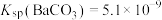 ,
,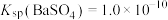 。在该温度下要使
。在该温度下要使 转化成
转化成 ,
, 溶液的浓度应大于
溶液的浓度应大于 。
。
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
6 . 天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:① 的吸收氧化;②
的吸收氧化;② 的再生。反应原理如下:
的再生。反应原理如下:
①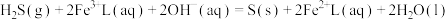

②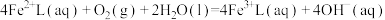
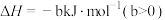
回答下列问题:
(1) 的电离方程式为
的电离方程式为___________ 。25℃时, 溶液中
溶液中 、
、 、
、 在含硫粒子总浓度中所占分数
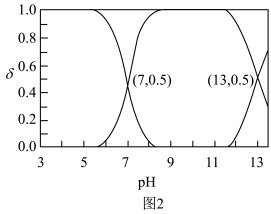
在含硫粒子总浓度中所占分数 随溶液pH的变化关系如图2,由图2计算,
随溶液pH的变化关系如图2,由图2计算, 的
的
___________ ,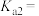
___________ 。再生反应在常温下进行,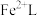 解离出的
解离出的 易与溶液中的
易与溶液中的 形成沉淀。若溶液中的
形成沉淀。若溶液中的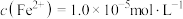 ,
,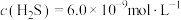 ,为避免有FeS沉淀生成,应控制溶液pH不大于
,为避免有FeS沉淀生成,应控制溶液pH不大于___________ (已知25℃时,FeS的 为
为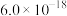 )。
)。
 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:① 的吸收氧化;②
的吸收氧化;② 的再生。反应原理如下:
的再生。反应原理如下:①
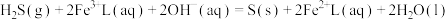

②
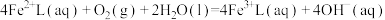
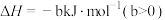
回答下列问题:
(1)
 的电离方程式为
的电离方程式为 溶液中
溶液中 、
、 、
、 在含硫粒子总浓度中所占分数
在含硫粒子总浓度中所占分数 随溶液pH的变化关系如图2,由图2计算,
随溶液pH的变化关系如图2,由图2计算, 的
的
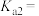
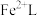 解离出的
解离出的 易与溶液中的
易与溶液中的 形成沉淀。若溶液中的
形成沉淀。若溶液中的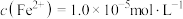 ,
,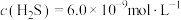 ,为避免有FeS沉淀生成,应控制溶液pH不大于
,为避免有FeS沉淀生成,应控制溶液pH不大于 为
为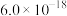 )。
)。
您最近半年使用:0次
名校
解题方法
7 . 废旧电池镍钴锰酸锂三元正极材料的主要成分为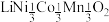 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
②M2+(Co2+或Ni2+)的萃取原理:2HR(有机相)+M2+(水相)⇌MR2(有机相)+2H+(水相)。
回答下列问题:
(1)“高温氢化”时固体产物为Co、Ni、MnO和LiOH,该反应的化学方程式为___________ 。
(2)若“洗液”中c(Li+)=2.0mol•L-1,加入Na2CO3固体后,为使沉淀Li2CO3中Li元素含量不小于Li元素总量的95%,则1.0L“洗液”中至少需要加入Na2CO3的物质的量为___________ [忽略溶液体积变化,Ksp(Li2CO3)=2.2×10-3]。
(3)“沉锰"过程中 对金属沉淀率的影响如图所示。
对金属沉淀率的影响如图所示。 的离子方程式为
的离子方程式为___________ 。
② 时,有少量钴、镍析出,可能的原因是
时,有少量钴、镍析出,可能的原因是___________ 。
(4)“反萃取”的目的是将有机层中 转移到水层。
转移到水层。
①试剂 为
为___________ 。(填试剂名称)
②为使 尽可能多地转移到水层,应采取的实验操作有
尽可能多地转移到水层,应采取的实验操作有___________ 。
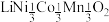 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
②M2+(Co2+或Ni2+)的萃取原理:2HR(有机相)+M2+(水相)⇌MR2(有机相)+2H+(水相)。
回答下列问题:
(1)“高温氢化”时固体产物为Co、Ni、MnO和LiOH,该反应的化学方程式为
(2)若“洗液”中c(Li+)=2.0mol•L-1,加入Na2CO3固体后,为使沉淀Li2CO3中Li元素含量不小于Li元素总量的95%,则1.0L“洗液”中至少需要加入Na2CO3的物质的量为
(3)“沉锰"过程中
 对金属沉淀率的影响如图所示。
对金属沉淀率的影响如图所示。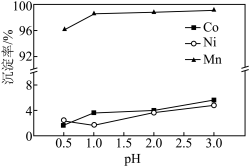
 的离子方程式为
的离子方程式为②
 时,有少量钴、镍析出,可能的原因是
时,有少量钴、镍析出,可能的原因是(4)“反萃取”的目的是将有机层中
 转移到水层。
转移到水层。①试剂
 为
为②为使
 尽可能多地转移到水层,应采取的实验操作有
尽可能多地转移到水层,应采取的实验操作有
您最近半年使用:0次
解题方法
8 .  (三氯化六氨合钴)是一种橙黄色的晶体,溶于热水和稀盐酸中,在冷水、乙醇、浓盐酸中溶解度较小,可用于制备其他三价钴配合物。实验室制备
(三氯化六氨合钴)是一种橙黄色的晶体,溶于热水和稀盐酸中,在冷水、乙醇、浓盐酸中溶解度较小,可用于制备其他三价钴配合物。实验室制备 的装置和步骤如下:
的装置和步骤如下: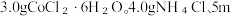 L高纯水,加热溶解后加入1.5g催化剂活性炭,7mL浓氨水,搅拌,得到
L高纯水,加热溶解后加入1.5g催化剂活性炭,7mL浓氨水,搅拌,得到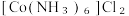 溶液。
溶液。
Ⅱ.将得到的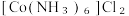 溶液冷却至10℃,加入7mL4%的
溶液冷却至10℃,加入7mL4%的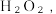 恒温
恒温 ,搅拌15min后冷却至2℃,抽滤,收集沉淀。
,搅拌15min后冷却至2℃,抽滤,收集沉淀。
Ⅲ.将沉淀转移入100mL烧杯中,用20mL、80℃的高纯水进行冲洗,再加入1mL的浓盐酸,搅拌均匀,_______,将活性炭滤出弃去。
Ⅳ.在滤液中加入3.5mL试剂b,搅拌后用冰水浴冷却至2℃析出沉淀,之后快速抽滤,弃去滤液,用无水乙醇洗涤沉淀3次,低温烘干,得到产品1.92g。
回答下列问题:
(1)仪器a的名称为_______ ,盛放的试剂是_______ 。
(2)常温下,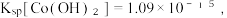 从平衡角度解释,步骤I中先加NH4Cl,后加浓氨水的原因是
从平衡角度解释,步骤I中先加NH4Cl,后加浓氨水的原因是_______ 。
(3)步骤Ⅲ中缺少的操作名称为_______ 。
(4)步骤Ⅳ中试剂b最好选择的是_______ (填标号)。
A.浓盐酸 B.稀盐酸 C.水
(5)由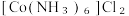 制备
制备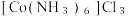 的化学方程式为
的化学方程式为_______ 。
(6)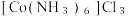 晶体中存在的化学键类型有_______(填标号)。
晶体中存在的化学键类型有_______(填标号)。
 (三氯化六氨合钴)是一种橙黄色的晶体,溶于热水和稀盐酸中,在冷水、乙醇、浓盐酸中溶解度较小,可用于制备其他三价钴配合物。实验室制备
(三氯化六氨合钴)是一种橙黄色的晶体,溶于热水和稀盐酸中,在冷水、乙醇、浓盐酸中溶解度较小,可用于制备其他三价钴配合物。实验室制备 的装置和步骤如下:
的装置和步骤如下: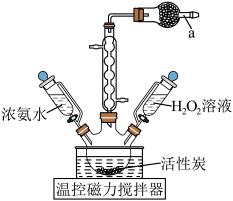
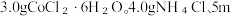 L高纯水,加热溶解后加入1.5g催化剂活性炭,7mL浓氨水,搅拌,得到
L高纯水,加热溶解后加入1.5g催化剂活性炭,7mL浓氨水,搅拌,得到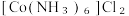 溶液。
溶液。Ⅱ.将得到的
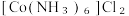 溶液冷却至10℃,加入7mL4%的
溶液冷却至10℃,加入7mL4%的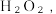 恒温
恒温 ,搅拌15min后冷却至2℃,抽滤,收集沉淀。
,搅拌15min后冷却至2℃,抽滤,收集沉淀。Ⅲ.将沉淀转移入100mL烧杯中,用20mL、80℃的高纯水进行冲洗,再加入1mL的浓盐酸,搅拌均匀,_______,将活性炭滤出弃去。
Ⅳ.在滤液中加入3.5mL试剂b,搅拌后用冰水浴冷却至2℃析出沉淀,之后快速抽滤,弃去滤液,用无水乙醇洗涤沉淀3次,低温烘干,得到产品1.92g。
回答下列问题:
(1)仪器a的名称为
(2)常温下,
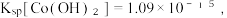 从平衡角度解释,步骤I中先加NH4Cl,后加浓氨水的原因是
从平衡角度解释,步骤I中先加NH4Cl,后加浓氨水的原因是(3)步骤Ⅲ中缺少的操作名称为
(4)步骤Ⅳ中试剂b最好选择的是
A.浓盐酸 B.稀盐酸 C.水
(5)由
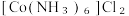 制备
制备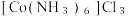 的化学方程式为
的化学方程式为(6)
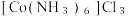 晶体中存在的化学键类型有_______(填标号)。
晶体中存在的化学键类型有_______(填标号)。| A.σ键 | B.π键 | C.离子键 | D.配位键 |
您最近半年使用:0次
9 . 某废旧三元锂离子电池正极材料的主要成分是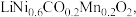 还有少量有机粘结剂和铝箔基底等,下图是处理电池正极材料回收锂、钴、镍、锰的一种流程。回答下列问题:
还有少量有机粘结剂和铝箔基底等,下图是处理电池正极材料回收锂、钴、镍、锰的一种流程。回答下列问题:
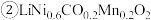 中Ni和Co元素的化合价均为+2价。
中Ni和Co元素的化合价均为+2价。
③焙烧时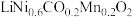 没有发生变化,焙烧还原时Li元素转化为
没有发生变化,焙烧还原时Li元素转化为
④常温时,氢氧化铝。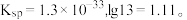
(1)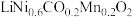 中Mn元素的化合价为
中Mn元素的化合价为_______ 。
(2)为提高焙烧效率,可采取的措施有_______ (填写一种方法),焙烧的目的是_______ 。
(3)除杂时发生反应的离子方程式为_______ (任写一个)。
(4)焙烧还原时发生反应的化学方程式为_______ 。
(5)水浸时,通入CO2的目的是_______ 。
(6)若废旧的锂离子电池拆解后先使用酸溶解,最终也可以得到,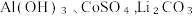 等物质,在酸浸中若Al3+浓度为0.1mol/L,则常温时pH>
等物质,在酸浸中若Al3+浓度为0.1mol/L,则常温时pH>_______ (结果保留两位小数)才能够形成氢氧化铝沉淀。
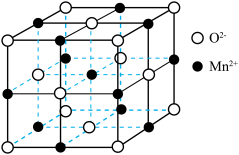
(7)已知MnO晶胞结构如图所示,晶胞参数为apm,NA为阿伏加德罗常数的值,该晶体密度为_______ g/cm³(写出表达式)。
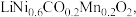 还有少量有机粘结剂和铝箔基底等,下图是处理电池正极材料回收锂、钴、镍、锰的一种流程。回答下列问题:
还有少量有机粘结剂和铝箔基底等,下图是处理电池正极材料回收锂、钴、镍、锰的一种流程。回答下列问题: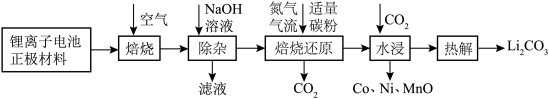
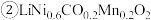 中Ni和Co元素的化合价均为+2价。
中Ni和Co元素的化合价均为+2价。③焙烧时
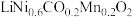 没有发生变化,焙烧还原时Li元素转化为
没有发生变化,焙烧还原时Li元素转化为
④常温时,氢氧化铝。
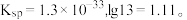
(1)
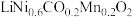 中Mn元素的化合价为
中Mn元素的化合价为(2)为提高焙烧效率,可采取的措施有
(3)除杂时发生反应的离子方程式为
(4)焙烧还原时发生反应的化学方程式为
(5)水浸时,通入CO2的目的是
(6)若废旧的锂离子电池拆解后先使用酸溶解,最终也可以得到,
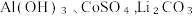 等物质,在酸浸中若Al3+浓度为0.1mol/L,则常温时pH>
等物质,在酸浸中若Al3+浓度为0.1mol/L,则常温时pH>(7)已知MnO晶胞结构如图所示,晶胞参数为apm,NA为阿伏加德罗常数的值,该晶体密度为
您最近半年使用:0次
解题方法
10 . 下列实验方案不能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 证明 | 向盛有浓度均为 的 的 和 和 混合溶液的试管中滴加几滴 混合溶液的试管中滴加几滴 溶液,振荡,观察沉淀颜色 溶液,振荡,观察沉淀颜色 |
| B | 制备 晶体 晶体 | 向 溶液中加入95%的乙醇 溶液中加入95%的乙醇 |
| C | 比较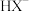 的电离程度与水解程度的大小 的电离程度与水解程度的大小 | 室温下,用 计测量一定浓度某弱酸盐 计测量一定浓度某弱酸盐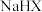 溶液的 溶液的 |
| D | 氧化性: | 向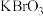 溶液中通入少量氯气,然后再加入少量苯萃取上层为橙红色 溶液中通入少量氯气,然后再加入少量苯萃取上层为橙红色 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次



