解题方法
1 . 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
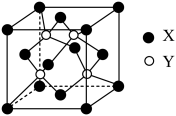
(1)X与Y所形成化合物晶体的晶胞如图所示。在该晶胞中,X离子的数目为___________ ;与X最近且等距的X有___________ 个,该化合物的化学式为___________ 。(写化学式)___________ 。
(3)Z的氧化物(H2Z)在乙醇中的溶解度大于H2Y的,其原因是___________ 。
(4)Y与Z可形成的YZ 的空间结构为
的空间结构为___________ (用文字描述)。
(5)已知该晶胞密度是ag/cm3,则两个X之间的最短距离为___________ pm(用含a、NA的代数式表示)。
(1)X与Y所形成化合物晶体的晶胞如图所示。在该晶胞中,X离子的数目为
(3)Z的氧化物(H2Z)在乙醇中的溶解度大于H2Y的,其原因是
(4)Y与Z可形成的YZ
 的空间结构为
的空间结构为(5)已知该晶胞密度是ag/cm3,则两个X之间的最短距离为
您最近一年使用:0次
解题方法
2 . 对于ABn型分子下列说法正确的是
| A.中心原子若通过sp3杂化轨道成键,则该分子一定为正面四体形结构 |
| B.NH3为三角锥形,N发生sp2杂化 |
| C.只要分子的空间结构为平面三角形,中心原子均为sp2杂化 |
| D.中心原子是sp杂化的,其分子的空间结构不一定为直线形 |
您最近一年使用:0次
解题方法
3 . 前四周期元素A、B、C、D、E、F原子序数依次增大,其相关性质如表所示:
请根据以上情况,回答下列问题:
(1)元素A的简单气态氢化物分子的空间结构为___________ ,分子中A原子的杂化类型为___________ 。
(2)A、B、D三种元素第一电离能由大到小的顺序为___________ (用元素符号表示);
(3)元素B的简单氢化物和元素D的简单氢化物中,键角更大的是___________ (填化学式);
(4)B、C、D三种元素的简单离子的半径由大到小顺序为___________ (用离子符号表示);
(5)E元素基态价电子排布式为___________ 。
(6)F元素的某种氯化物晶胞如下图所示,该物质的化学式为___________ ;原子坐标参数可表示晶胞内部各原子的相对位置,各原子标参数分别为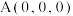 ;
;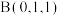 ;
;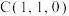 ;则D原子的坐标参数为
;则D原子的坐标参数为___________ 。
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6种空间运动状态,且只有1个未成对电子 |
| D | 基态原子价电子排布式为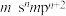 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
| F | 基态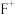 各能级电子全充满 各能级电子全充满 |
(1)元素A的简单气态氢化物分子的空间结构为
(2)A、B、D三种元素第一电离能由大到小的顺序为
(3)元素B的简单氢化物和元素D的简单氢化物中,键角更大的是
(4)B、C、D三种元素的简单离子的半径由大到小顺序为
(5)E元素基态价电子排布式为
(6)F元素的某种氯化物晶胞如下图所示,该物质的化学式为
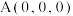 ;
;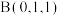 ;
;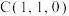 ;则D原子的坐标参数为
;则D原子的坐标参数为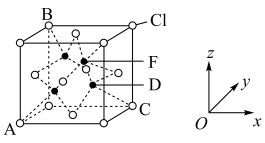
您最近一年使用:0次
4 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:______ 。
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:______ 。
(3)o、p两元素的部分电离能数据如下表:
比较两元素的I2、I3可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是______ 。
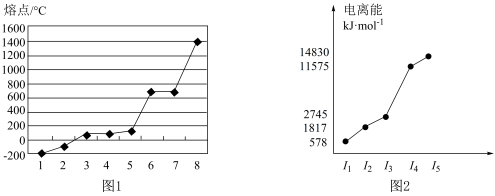
(4)第三周期8种元素单质熔点高低的顺序如图1所示,其中电负性最大的是______ (填图1中的序号)。表1中所列的某主族元素的电离能情况如图2所示,则该元素是______ (填元素符号)。 和
和 两种化合物,请完成下列空白:
两种化合物,请完成下列空白:
键角比较:
______  (填“>”、“<”或“=”,下同),极性比较:
(填“>”、“<”或“=”,下同),极性比较:
______ 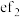 ;
; 其能与水混溶,却不溶于CCl4,请予以解释:
其能与水混溶,却不溶于CCl4,请予以解释:______ 。
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
(3)o、p两元素的部分电离能数据如下表:
元素 电离能/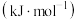 | o | p |
I1 | 717 | 759 |
I2 | 1509 | 1561 |
I3 | 3248 | 2957 |
 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是(4)第三周期8种元素单质熔点高低的顺序如图1所示,其中电负性最大的是
 和
和 两种化合物,请完成下列空白:
两种化合物,请完成下列空白:键角比较:

 (填“>”、“<”或“=”,下同),极性比较:
(填“>”、“<”或“=”,下同),极性比较:
 ;
; 其能与水混溶,却不溶于CCl4,请予以解释:
其能与水混溶,却不溶于CCl4,请予以解释:
您最近一年使用:0次
解题方法
5 . 下列对有关事实的解释错误的是
| 选项 | 事实 | 解释 |
| A | 金刚石的熔点高于单晶硅 | 金刚石的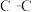 比单晶硅的 比单晶硅的 键能大 键能大 |
| B |  热稳定性大于 热稳定性大于 | 非金属性:C大于S |
| C | 某些金属盐灼烧时呈现不同焰色 | 电子从低能级轨道跃迁至高能级轨道后,又从高能级轨道跃迁至低能级轨道,释放出不同波长的光 |
| D | 乙烯活泼性大于乙烷 | 碳碳键强度σ键大于π键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 下列有关物质结构或性质分类相同的是
A.VSEPR模型: 和 和 | B.晶体类型: 和 和 |
C.空间结构: 和 和 | D.分子极性: 和 和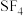 |
您最近一年使用:0次
7 . 下列说法错误的是
A. 与 与 互为等电子体, 互为等电子体, 中含有的 中含有的 键数目为 键数目为 |
B.已知反应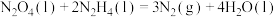 ,若该反应中有 ,若该反应中有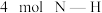 键断裂,则形成的 键断裂,则形成的 键数目为 键数目为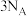 |
C.在 和 和 中都存在配位键 中都存在配位键 |
D.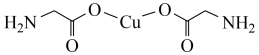  键和 键和 键比例为 键比例为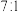 |
您最近一年使用:0次
8 . 原子序数小于 的
的 、
、 、
、 、
、 四种元素,其中
四种元素,其中 是周期表中半径最小的元素,
是周期表中半径最小的元素, 原子基态时最外层电子数是其内层电子数的
原子基态时最外层电子数是其内层电子数的 倍,
倍, 原子基态时
原子基态时 原子轨道上有
原子轨道上有 个未成对的电子,
个未成对的电子, 的原子序数为
的原子序数为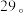
回答下列问题:
(1) 分子中
分子中 原子轨道的杂化类型为
原子轨道的杂化类型为___________ ,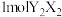 含有
含有 键的数目为
键的数目为___________ 。
(2)化合物 的沸点比化合物
的沸点比化合物 的高,其主要原因是
的高,其主要原因是___________ 。
(3)元素 的一种氧化物与元素
的一种氧化物与元素 的一种氧化物互为等电子体,元素
的一种氧化物互为等电子体,元素 的这种氧化物的分子式是
的这种氧化物的分子式是___________ ,又已知 的这种氧化物的分子中氧原子只与一个
的这种氧化物的分子中氧原子只与一个 原子相连,且每个原子均达到
原子相连,且每个原子均达到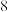 电子稳定结构,则该分子电子式可表示为
电子稳定结构,则该分子电子式可表示为___________ 。
(4)元素 的硫酸盐溶于水显蓝色,原因是
的硫酸盐溶于水显蓝色,原因是___________ ;向该溶液中逐滴加入足量的氨水,发生反应的现象为___________ ,继续加入无水乙醇生成蓝色沉淀,该沉淀的化学式为___________ ,加入乙醇的作用为___________ 。
 的
的 、
、 、
、 、
、 四种元素,其中
四种元素,其中 是周期表中半径最小的元素,
是周期表中半径最小的元素, 原子基态时最外层电子数是其内层电子数的
原子基态时最外层电子数是其内层电子数的 倍,
倍, 原子基态时
原子基态时 原子轨道上有
原子轨道上有 个未成对的电子,
个未成对的电子, 的原子序数为
的原子序数为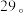
回答下列问题:
(1)
 分子中
分子中 原子轨道的杂化类型为
原子轨道的杂化类型为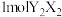 含有
含有 键的数目为
键的数目为(2)化合物
 的沸点比化合物
的沸点比化合物 的高,其主要原因是
的高,其主要原因是(3)元素
 的一种氧化物与元素
的一种氧化物与元素 的一种氧化物互为等电子体,元素
的一种氧化物互为等电子体,元素 的这种氧化物的分子式是
的这种氧化物的分子式是 的这种氧化物的分子中氧原子只与一个
的这种氧化物的分子中氧原子只与一个 原子相连,且每个原子均达到
原子相连,且每个原子均达到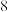 电子稳定结构,则该分子电子式可表示为
电子稳定结构,则该分子电子式可表示为(4)元素
 的硫酸盐溶于水显蓝色,原因是
的硫酸盐溶于水显蓝色,原因是
您最近一年使用:0次
解题方法
9 . 一定条件下,CO2与NH3反应可制得重要的化工产品三聚氰胺:______ ,三聚氰胺的几种组成元素中电负性由大到小的顺序为______ (用元素符号表示)。
(2)三聚氰胺中氮原子的杂化轨道类型为______ 。
(3)上述合成三聚氰胺的反应过程中存在多种类型化学键的断裂与形成,这些化学键中不包括______ (填选项字母)。
a.σ键 b.π键 c.非极性共价键 d.极性共价键
(4)三聚氰胺的熔点为250℃,则其晶体类型是______ ,又知硝基苯的熔点为:5.7℃,导致这两种物质熔点差异的原因是______ 。
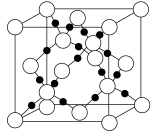
(5)随着科学技术的发展,科学家们已合成了由碳、氧两种元素形成的共价晶体。其晶胞结构如图所示,若晶胞参数为apm,设 表示阿伏伽德罗常数的值,则该晶胞的密度是
表示阿伏伽德罗常数的值,则该晶胞的密度是______  。
。
3NH3 + 3CO2→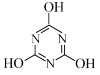 +3H2O。
+3H2O。
(2)三聚氰胺中氮原子的杂化轨道类型为
(3)上述合成三聚氰胺的反应过程中存在多种类型化学键的断裂与形成,这些化学键中不包括
a.σ键 b.π键 c.非极性共价键 d.极性共价键
(4)三聚氰胺的熔点为250℃,则其晶体类型是
(5)随着科学技术的发展,科学家们已合成了由碳、氧两种元素形成的共价晶体。其晶胞结构如图所示,若晶胞参数为apm,设
 表示阿伏伽德罗常数的值,则该晶胞的密度是
表示阿伏伽德罗常数的值,则该晶胞的密度是 。
。
您最近一年使用:0次
解题方法
10 . 运用物质结构与性质的相关知识,回答下列问题:
(1)下列状态的铝中,电离最外层一个电子所需能量最大的是______。
(2)第四周期中,未成对电子数最多的元素在周期表中的位置为______ ,属于______ 区,价层电子轨道表示式为______ 。
(3)根据价层电子对互斥理论, 分子的立体构型为
分子的立体构型为______ 。
(4)胆矾溶液与氨水在一定条件下可以生成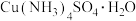 晶体。在
晶体。在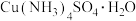 晶体中,
晶体中, 为
为______ 结构, 中心原子的杂化轨道类型是
中心原子的杂化轨道类型是______ 。
(5)键角比较:NCl3______ PCl3(填“>”、“<”或“=”)并解释其原因______ 。
(1)下列状态的铝中,电离最外层一个电子所需能量最大的是______。
A. | B.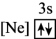 | C.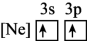 | D.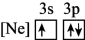 |
(3)根据价层电子对互斥理论,
 分子的立体构型为
分子的立体构型为(4)胆矾溶液与氨水在一定条件下可以生成
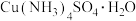 晶体。在
晶体。在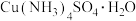 晶体中,
晶体中, 为
为 中心原子的杂化轨道类型是
中心原子的杂化轨道类型是(5)键角比较:NCl3
您最近一年使用:0次



