名校
解题方法
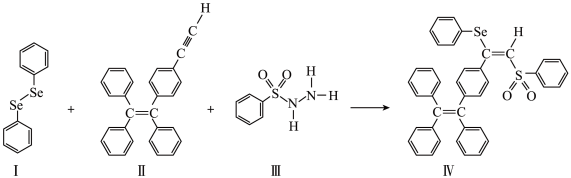
1 . 硒(Se是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子的合成路线如下:
(1)基态硒原子的价电子排布式为_______ 。
(2)比较沸点
_______  (填“>”或“<”),并解释原因
(填“>”或“<”),并解释原因_______ 。
(3)关于Ⅰ~Ⅳ物质,下列说法正确的有
(4) 分子Ⅲ的价电子中,有
分子Ⅲ的价电子中,有_______ mol孤电子对。
(5)适量的硒酸钠 可减轻重金属铊引起的中毒,
可减轻重金属铊引起的中毒, 的立体构型为
的立体构型为____ 。结合无机含氧酸的酸性变化规律,比较酸性:
_____  (填“>”或“<”)。
(填“>”或“<”)。
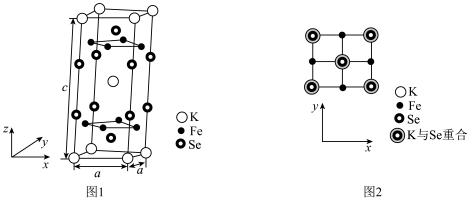
(6)由铁、钾、硒形成的一种超导材料,其晶胞结构如图1所示。_______ 个。
②该晶胞参数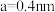 、
、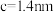 ,该晶体密度
,该晶体密度
_______  。(用
。(用 表示阿伏加德罗常数,写出计算表达式即可)
表示阿伏加德罗常数,写出计算表达式即可)
(1)基态硒原子的价电子排布式为
(2)比较沸点

 (填“>”或“<”),并解释原因
(填“>”或“<”),并解释原因(3)关于Ⅰ~Ⅳ物质,下列说法正确的有
A.Ⅰ中Se原子为 杂化,碳原子不都是 杂化,碳原子不都是 杂化 杂化 |
| B.Ⅱ是由极性键和非极性键组成的弱极性分子 |
| C.Ⅲ含有的所有元素中,O的电负性最大 |
| D.Ⅳ中含有2个手性碳原子 |
(4)
 分子Ⅲ的价电子中,有
分子Ⅲ的价电子中,有(5)适量的硒酸钠
 可减轻重金属铊引起的中毒,
可减轻重金属铊引起的中毒, 的立体构型为
的立体构型为
 (填“>”或“<”)。
(填“>”或“<”)。(6)由铁、钾、硒形成的一种超导材料,其晶胞结构如图1所示。
②该晶胞参数
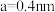 、
、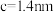 ,该晶体密度
,该晶体密度
 。(用
。(用 表示阿伏加德罗常数,写出计算表达式即可)
表示阿伏加德罗常数,写出计算表达式即可)
您最近半年使用:0次
名校
解题方法
2 . 过渡金属元素及其化合物的应用广泛,是科学家们进行前沿研究的方向之一、
(1)基态N原子核外能量最高的能级的电子云有___________ 种不同的伸展方向。
(2)锌化铜是一种金属互化物,元素铜的第二电离能大于锌的第二电离能的理由是___________ 。
(3)已知苯酚(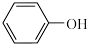 )具有弱酸性,其
)具有弱酸性,其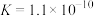 水杨酸第一步电离形成的离子
水杨酸第一步电离形成的离子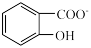 能形成分子内氢键,据此判断,相同温度下电离平衡常数
能形成分子内氢键,据此判断,相同温度下电离平衡常数 (水杨酸)
(水杨酸)___________ K(苯酚)(填“>”或“<”),其原因是___________ 。
(4)下列几种有机羧酸中,按酸性由强到弱的顺序排顺序为___________ (填序号)。
①乙酸( )②氯乙酸(
)②氯乙酸(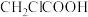 )③三氯乙酸(
)③三氯乙酸( )④三氟乙酸(
)④三氟乙酸( )
)
(5)键角大小比较(填“>”“<”或“=”):①
___________  ②
②
___________  ③
③
___________ 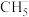 ④
④
___________ 
(6)利用 和NaOH制备的
和NaOH制备的 悬浊液检验醛基时,生成砖红色的
悬浊液检验醛基时,生成砖红色的 ,其晶胞结构如图所示。
,其晶胞结构如图所示。 ,C为
,C为 ,则D原子分数坐标为
,则D原子分数坐标为___________ 。
②若 晶体密度为d g⋅cm
晶体密度为d g⋅cm ,晶胞参数为a pm,则阿伏加德罗常数的值
,晶胞参数为a pm,则阿伏加德罗常数的值 为
为___________ (用含d和a的式子表示)。
(1)基态N原子核外能量最高的能级的电子云有
(2)锌化铜是一种金属互化物,元素铜的第二电离能大于锌的第二电离能的理由是
(3)已知苯酚(
 )具有弱酸性,其
)具有弱酸性,其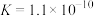 水杨酸第一步电离形成的离子
水杨酸第一步电离形成的离子 能形成分子内氢键,据此判断,相同温度下电离平衡常数
能形成分子内氢键,据此判断,相同温度下电离平衡常数 (水杨酸)
(水杨酸)(4)下列几种有机羧酸中,按酸性由强到弱的顺序排顺序为
①乙酸(
 )②氯乙酸(
)②氯乙酸(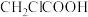 )③三氯乙酸(
)③三氯乙酸( )④三氟乙酸(
)④三氟乙酸( )
)(5)键角大小比较(填“>”“<”或“=”):①

 ②
②
 ③
③
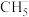 ④
④

(6)利用
 和NaOH制备的
和NaOH制备的 悬浊液检验醛基时,生成砖红色的
悬浊液检验醛基时,生成砖红色的 ,其晶胞结构如图所示。
,其晶胞结构如图所示。
 ,C为
,C为 ,则D原子分数坐标为
,则D原子分数坐标为②若
 晶体密度为d g⋅cm
晶体密度为d g⋅cm ,晶胞参数为a pm,则阿伏加德罗常数的值
,晶胞参数为a pm,则阿伏加德罗常数的值 为
为
您最近半年使用:0次
名校
解题方法
3 . 钛硅分子筛是一种新型固体催化剂,可催化合成重要有机合成活性试剂甲乙酮肟(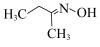 )。回答下列问题:
)。回答下列问题:
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为
(3)TiO2和TiCl4均是制备钛硅分子筛的重要中间体。
①TiO2与光气COCl2反应可用于制取四氯化钛。COCl2中σ键和π键的数目比为
②TiCl4与金属Ti在高温条件下可反应生成TiCl3,TiCl3中Ti3+极易被氧化,还原性很强。试解释Ti3+还原性强的原因
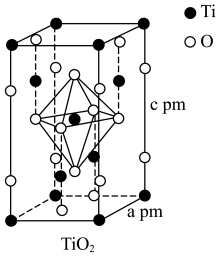
(4)TiO2晶胞如图所示,若其晶体密度为ρg·cm-3,则阿伏加德罗常数的值NA=
您最近半年使用:0次
解题方法
4 . 铜及其化合物在生活、生产中用途广泛。以黄铜矿为原料冶炼铜涉及多个反应,其中一个反应为
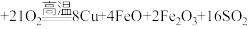 。回答下列问题:
。回答下列问题:
(1)基态铜原子的价层电子的轨道表示式(电子排布图)为______________ ,基态铜原子核外电子的空间运动状态(原子轨道)有__________ 种。
(2)高温下CuO能转化为 的原因是
的原因是_____________ (从原子结构角度分析)。
(3) 、
、 、
、 、
、 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是___________ ,属于极性分子的是___________ , 、
、 、
、 、
、 四种含硫微粒的空间结构分别为
四种含硫微粒的空间结构分别为____________ 、____________ 、____________ 、____________ 。
(4) 、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。
、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。 、FeO两种氧化物的晶体类型都是
、FeO两种氧化物的晶体类型都是_______________ ,1360℃是__________ 的熔点。
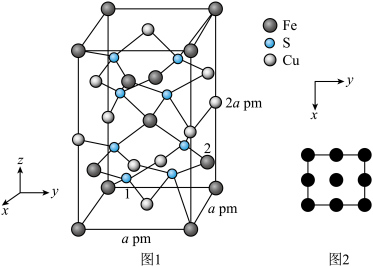
(5) 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为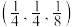 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为____________ 。晶胞参数分别为a pm,a pm、2a pm, 晶体的密度为
晶体的密度为___________  (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。

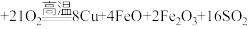 。回答下列问题:
。回答下列问题:(1)基态铜原子的价层电子的轨道表示式(电子排布图)为
(2)高温下CuO能转化为
 的原因是
的原因是(3)
 、
、 、
、 、
、 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是 、
、 、
、 、
、 四种含硫微粒的空间结构分别为
四种含硫微粒的空间结构分别为(4)
 、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。
、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。 、FeO两种氧化物的晶体类型都是
、FeO两种氧化物的晶体类型都是(5)
 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为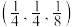 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为 晶体的密度为
晶体的密度为 (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。
您最近半年使用:0次
解题方法
5 . 科技强国,我国科学家在诸多领域取得新突破。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。
其中“刻蚀”过程可能用到刻蚀剂 、
、 及清洗剂
及清洗剂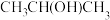 。
。
①基态F原子核外电子有_____ 种空间运动状态,下列为氟原子激发态的电子排布式的是_____ (填标号)。
A. B.
B. C.
C. D.
D.
②C、N、O、F四种元素的第一电离能由大到小的顺序为__________ 。
③氟硼酸铵( )中B的杂化方式为
)中B的杂化方式为__________ , 的空间构型为
的空间构型为__________ 。
(2)复兴号高铁车体材质用到了Mn、Co等元素。Mn的一种配合物的化学式为[Mn(CO)5(CH3CN)],CH3CN与Mn原子配位时,提供孤电子对的是__________ (填元素符号),Mn原子的配位数为__________ ,CH3CN中 键与
键与 键数目之比为
键数目之比为__________ 。
(3)超导材料 具有
具有 型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为
型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为__________ (列出计算式即可) 。
。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。
其中“刻蚀”过程可能用到刻蚀剂
 、
、 及清洗剂
及清洗剂 。
。①基态F原子核外电子有
A.
 B.
B. C.
C. D.
D.
②C、N、O、F四种元素的第一电离能由大到小的顺序为
③氟硼酸铵(
 )中B的杂化方式为
)中B的杂化方式为 的空间构型为
的空间构型为(2)复兴号高铁车体材质用到了Mn、Co等元素。Mn的一种配合物的化学式为[Mn(CO)5(CH3CN)],CH3CN与Mn原子配位时,提供孤电子对的是
 键与
键与 键数目之比为
键数目之比为(3)超导材料
 具有
具有 型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为
型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为 。
。
您最近半年使用:0次
名校
6 . 锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等三十多种对人体有益的微量元素。
(1)基态Ge原子的电子排布式为___________ 。
(2) 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是___________ 分子(填“极性”或“非性极”)。
(3)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:___________ 。
(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为( ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为___________ ;已知晶胞边长为a pm,阿伏加德罗常数的值为 ,该晶胞密度
,该晶胞密度 为
为___________  (只列出计算式)。
(只列出计算式)。
(1)基态Ge原子的电子排布式为
(2)
 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是(3)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:
(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为(
 ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为 ,该晶胞密度
,该晶胞密度 为
为 (只列出计算式)。
(只列出计算式)。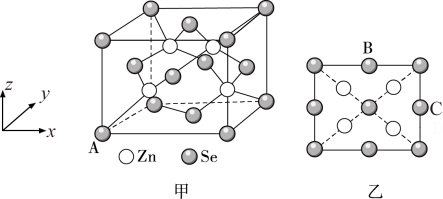
您最近半年使用:0次
名校
解题方法
7 . 新冠肺炎疫情防控,消毒用品必不可少。试回答下列问题:
(1)过氧乙酸(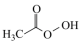 )也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有
)也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有___________ ,分子中 键和
键和 键的个数比为
键的个数比为___________ 。
(2)生活中常用的手消毒凝胶,其主要有效成分是三氮羟基二苯醚和乙醇,其中三氯羟基二苯醚是一种广谱抗菌剂,高效、安全。三氯羟基二苯醚的结构简式如图所示。___________ ;基态氯原子的核外电子排布式为___________ ,最高能级的原子轨道电子云轮廓图形状为___________ 。
②三氯羟基二苯醚的熔点:55~57℃,沸点:120℃,常态为白色或灰白色晶状粉末,稍有酚臭味,不溶于水,易溶于碱液和有机溶剂,三氯羟基二苯醚属于___________ 晶体。
③乙醇与甲醚(CH3OCH3)的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是___________ 。
(3)Na、K等活泼金属在O2中燃烧得到的Na2O2、KO2具有强氧化性,也常做消毒剂。已知KO2的晶胞如图所示:___________ g·cm-3 (用含a、NA的代数式表示)。
(1)过氧乙酸(
 )也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有
)也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有 键和
键和 键的个数比为
键的个数比为(2)生活中常用的手消毒凝胶,其主要有效成分是三氮羟基二苯醚和乙醇,其中三氯羟基二苯醚是一种广谱抗菌剂,高效、安全。三氯羟基二苯醚的结构简式如图所示。
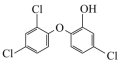
②三氯羟基二苯醚的熔点:55~57℃,沸点:120℃,常态为白色或灰白色晶状粉末,稍有酚臭味,不溶于水,易溶于碱液和有机溶剂,三氯羟基二苯醚属于
③乙醇与甲醚(CH3OCH3)的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是
(3)Na、K等活泼金属在O2中燃烧得到的Na2O2、KO2具有强氧化性,也常做消毒剂。已知KO2的晶胞如图所示:
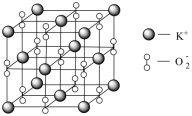
您最近半年使用:0次
8 . 氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
2.铁镁合金的化学式为___________ 。
3.若该晶胞的晶胞边长为d nm,阿伏加德罗常数为 ,则该合金的密度为
,则该合金的密度为___________  (用含
(用含 的式子表达)。
的式子表达)。
4.若该晶体储氢时, 分子在晶胞的体心和棱心位置,则含Mg48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg48g的该储氢合金可储存标准状况下 的体积约为___________L。
的体积约为___________L。

| A.4 | B.6 | C.8 | D.12 |
3.若该晶胞的晶胞边长为d nm,阿伏加德罗常数为
 ,则该合金的密度为
,则该合金的密度为 (用含
(用含 的式子表达)。
的式子表达)。4.若该晶体储氢时,
 分子在晶胞的体心和棱心位置,则含Mg48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg48g的该储氢合金可储存标准状况下 的体积约为___________L。
的体积约为___________L。| A.5.6 | B.11.2 | C.22.4 | D.44.8 |
您最近半年使用:0次
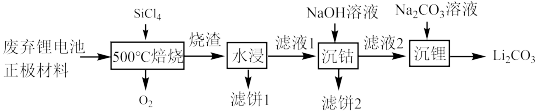
9 . 近几年新能源汽车呈现爆发式增长,对于锂电池的需求量越来越大,而碳酸锂是锂电池的重要原料之一,对废旧锂离子电池进行资源化和无害化处理具有重要的经济和环境效益,利用SiCl4对废弃的锂电池正极材料LiCoO2)进行氧化处理以回收Li等金属的工艺流程如下:
(1)Co在元素周期表的位置是___________ ,Co2+与Co3+的未成对电子数之比为___________ 。
(2)“烧渣”是LiCl、CoCl2和SiO2的混合物。“ 焙烧”反应生成的氧化产物与还原产物的物质的量之比为
焙烧”反应生成的氧化产物与还原产物的物质的量之比为___________ 。
(3)“滤饼2”的主要成分为___________ (填化学式)。利用Li2CO3与CoCO3按n(Li):n(Co)=1:1的比例配合,然后在空气中于 烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为
烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为___________ 。
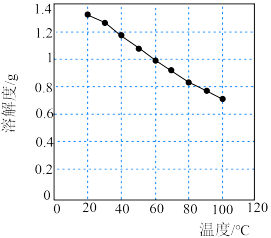
(4)碳酸锂的溶解度随温度变化如图所示。向滤液2中加入Na2CO3溶液,将温度升至90℃是为了提高沉淀反应速率和___________ 。得到碳酸锂沉淀的操作为___________ (填标号)。
(5)常温下,取 “滤液2”,其中
“滤液2”,其中 ,为使锂元素的回收率不低于
,为使锂元素的回收率不低于 ,则至少应加入
,则至少应加入 固体的质量为
固体的质量为___________ g[已知常温下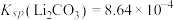 。计算结果保留3位小数。
。计算结果保留3位小数。
(6)由 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。 在晶胞中的位置为
在晶胞中的位置为___________ 。
② 晶体的密度为
晶体的密度为 ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为___________ nm(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Co在元素周期表的位置是
(2)“烧渣”是LiCl、CoCl2和SiO2的混合物。“
 焙烧”反应生成的氧化产物与还原产物的物质的量之比为
焙烧”反应生成的氧化产物与还原产物的物质的量之比为(3)“滤饼2”的主要成分为
 烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为
烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为(4)碳酸锂的溶解度随温度变化如图所示。向滤液2中加入Na2CO3溶液,将温度升至90℃是为了提高沉淀反应速率和
(5)常温下,取
 “滤液2”,其中
“滤液2”,其中 ,为使锂元素的回收率不低于
,为使锂元素的回收率不低于 ,则至少应加入
,则至少应加入 固体的质量为
固体的质量为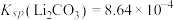 。计算结果保留3位小数。
。计算结果保留3位小数。(6)由
 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。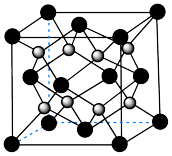
 在晶胞中的位置为
在晶胞中的位置为②
 晶体的密度为
晶体的密度为 ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为 )。
)。
您最近半年使用:0次
名校
解题方法
10 . 某化工厂利用废旧锂离子电池正极材料(含有LiCoO2以及少量Ca、Mg、Fe、Al等)制备Co2O3和Li2CO3.工艺流程如下: 如下表:
如下表:
②常温时, 的溶度积
的溶度积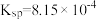 ,该数值随温度升高而减小。
,该数值随温度升高而减小。
(1)LiCoO2中Co元素的化合价为___________ ;基态Co原子的价层电子表示式为___________ 。
(2)“酸浸”时发生反应: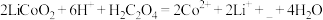 ,补充完整上述离子方程式
,补充完整上述离子方程式___________ 。
(3)已知滤渣2中含有 ,则常温下滤液2中
,则常温下滤液2中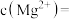
___________ mol/L。
(4)滤液3中含金属元素的离子主要是 ,通入空气发生催化氧化反应的离子方程式为
,通入空气发生催化氧化反应的离子方程式为___________ 。
(5)沉锂操作过程中的存在反应: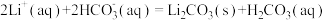 ,该操作中需将温度升高到90℃,原因是
,该操作中需将温度升高到90℃,原因是___________ 。
(6)由 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。 在晶胞中的位置为
在晶胞中的位置为___________ ;
②设阿伏加德罗常数的值为 。晶胞
。晶胞 的密度为b
的密度为b ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为___________ pm。
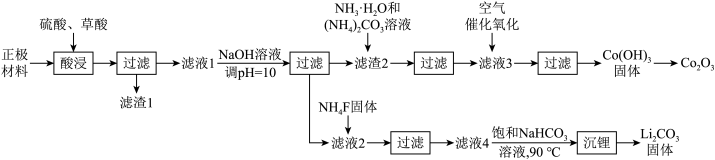
 如下表:
如下表:| 物质 |  |  |  |  |
 | 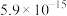 |  | 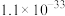 |  |
 的溶度积
的溶度积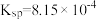 ,该数值随温度升高而减小。
,该数值随温度升高而减小。(1)LiCoO2中Co元素的化合价为
(2)“酸浸”时发生反应:
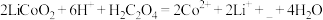 ,补充完整上述离子方程式
,补充完整上述离子方程式(3)已知滤渣2中含有
 ,则常温下滤液2中
,则常温下滤液2中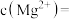
(4)滤液3中含金属元素的离子主要是
 ,通入空气发生催化氧化反应的离子方程式为
,通入空气发生催化氧化反应的离子方程式为(5)沉锂操作过程中的存在反应:
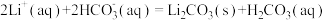 ,该操作中需将温度升高到90℃,原因是
,该操作中需将温度升高到90℃,原因是(6)由
 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。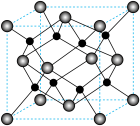
 在晶胞中的位置为
在晶胞中的位置为②设阿伏加德罗常数的值为
 。晶胞
。晶胞 的密度为b
的密度为b ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为
您最近半年使用:0次



