江西省横峰中学等五校2019-2020学年新高一竞赛班联考化学试题
江西
高一
竞赛
2019-07-25
558次
整体难度:
适中
考查范围:
化学实验基础、认识化学科学、初中衔接知识点
江西省横峰中学等五校2019-2020学年新高一竞赛班联考化学试题
江西
高一
竞赛
2019-07-25
558次
整体难度:
适中
考查范围:
化学实验基础、认识化学科学、初中衔接知识点
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 《天工开物》中对制造染料“蓝靛”的叙述如下:“凡造淀,叶与茎多者入窖,少者入桶与缸。水浸七日,其汁自来。每水浆一石,下石灰五升,搅冲数十下,淀信即结。水性定时,淀沉于底…其掠出浮沫晒干者曰靛花。”文中没有涉及的实验操作是
| A.溶解 | B.搅拌 | C.升华 | D.蒸发 |
【知识点】 物质分离、提纯的常见物理方法 蒸发与结晶解读 过滤解读
您最近一年使用:0次
2019-06-06更新
|
1088次组卷
|
18卷引用:【市级联考】山东省淄博市2019届高三三模考试理科综合化学试题
【市级联考】山东省淄博市2019届高三三模考试理科综合化学试题江西省横峰中学等五校2019-2020学年新高一竞赛班联考化学试题(已下线)2019年8月25日《每日一题》 必修1 ——每周一测湖南省长沙市第一中学2019-2020学年高一上学期第一次月考化学试题江西省宜春市上高二中2019-2020学年高一上学期第一次月考化学试题安徽省合肥市金汤白泥乐槐六校2019-2020学年高一上学期第一次联考化学试题内蒙古锡林浩特市第六中学2019-2020学年高一上学期第一次月考化学试题山西省忻州市第一中学2019-2020学年高一上学期第三次月考化学试题安徽省潜山第二中学2019-2020学年高一下学期第一次月考化学试题(已下线)1.1.1化学实验安全 过滤和蒸发(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)高一必修第一册(苏教2019版)专题2 B 素养拓展区(已下线)【南昌新东方】3. 南昌一中 余贞梅河南省淮阳县陈州高级中学2019-2020学年高一上学期期中考试化学试题(已下线)【南昌新东方】16.2020年11月江西南昌外国语高一期中化学上海交通大学附属中学2020-2021学年高三上学期第一次月考化学试题上海市宝山区行知中学-2021-2022学年高三下学期3月月考化学试题四川省凉山宁南中学2021-2022学年高一上学期第一次月考化学试题(已下线)专题25 化学实验综合性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
单选题
|
较易(0.85)
名校
2. 下列叙述正确的是( )
| A.1 mol H2O的质量为18 g·mol-1 |
| B.CH4的摩尔质量为16 g |
| C.3.01×1023个SO2分子的质量为32 g |
| D.1 mol任何物质均含有6.02×1023个分子 |
【知识点】 摩尔质量 阿伏加德罗常数的含义解读
您最近一年使用:0次
2019-06-19更新
|
764次组卷
|
18卷引用:2016-2017学年宁夏育才中学高一上第一次月考化学试卷
2016-2017学年宁夏育才中学高一上第一次月考化学试卷河北省冀州市中学2017-2018学年高一上学期第一次月考化学试题吉林省长春外国语学校2018-2019学年高二下学期第二次月考化学试题江西省横峰中学等五校2019-2020学年新高一竞赛班联考化学试题(已下线)2019年8月27日 《每日一题》 必修1 物质的量概念与阿伏加德罗常数河南省周口中英文学校2019-2020学年高一上学期第一次月考化学试题陕西省咸阳市兴平西郊高级中学2019-2020高一上学期第一次月考化学试题江西省上饶市“山江湖”协作体2019-2020学年高一上学期期中联考化学(统招班)试题江西省抚州市六校2019-2020学年高一上学期12月联考化学试题云南省昆明市禄劝县第一中学2019-2020学年高一上学期期中考试化学试题陕西省宝鸡市金台区2019-2020学年高一上学期期中检测化学试题江苏省扬州市江都区大桥高级中学2020-2021学年高一上学期学情调研(一)化学试题贵州省安顺市平坝第一高级中学2020-2021学年高一9月月考化学试题陕西省延安大学玉章实验中学2019-2020学年高二下学期期末考试化学试题河北省石家庄市第十七中学2020-2021学年高一上学期期中考试化学试题江西省进贤县第一中学2020-2021学年高一上学期期末考试化学试题新疆兵团第三师图木舒克市2021-2022学年高一上学期期末考试化学试题江苏省盐城市东台创新高级中学2021-2022学年高一11月份月检测化学试题
单选题
|
适中(0.65)
名校
3. 将下列溶液分别稀释到100 mL,稀释后的溶液中氯离子浓度最大的是
| A.15 mL 1 mol•L﹣1的AlCl3 | B.50 mL 1 mol•L﹣1的KCl |
| C.20 mL 2 mol•L﹣1的NH4Cl | D.10 mL 2 mol•L﹣1的CaCl2 |
您最近一年使用:0次
2019-06-16更新
|
1464次组卷
|
18卷引用:【全国百强校】江苏省海安高级中学2018-2019学年高一(创新实验班)下学期期中考试化学试题
【全国百强校】江苏省海安高级中学2018-2019学年高一(创新实验班)下学期期中考试化学试题江西省横峰中学等五校2019-2020学年新高一竞赛班联考化学试题(已下线)2019年9月6日《每日一题》 必修1 溶液稀释或混合的计算江西省上饶市“山江湖”协作体2019-2020学年高一上学期期中联考化学(统招班)试题四川省广元川师大万达中学2019-2020学年高一上学期期中考试化学试题江西省抚州市六校2019-2020学年高一上学期12月联考化学试题湖南师范大学附属中学2019-2020学年高一上学期期中考试化学试题甘肃省古浪县第二中学2019-2020学年高一上学期期中考试化学试题河南省豫西名校2020-2021学年高一上学期第一次联考化学试题甘肃省会宁县第一中学2020-2021学年高一上学期第一次月考化学试题福建省福州第一中学2021届高三上学期期中考试化学试题陕西省汉中市汉中市城固县第一中学2020-2021学年高一上学期第一次月考化学试题四川省绵阳市南山中学2020-2021学年高一上学期12月月考化学试题内蒙古自治区包头市第一中学2020-2021学年高一上学期期中考试化学试题四川省射洪中学校2020—2021学年高一上学期第三次月考化学试题江西省赣州市信丰中学2020-2021学年高一上学期第一次月考化学(A卷) 试题(已下线)衔接点20 物质的量浓度-2022年初升高化学无忧衔接?山东省济宁市泗水县2021-2022学年高一上学期期中考试化学试题
单选题
|
适中(0.65)
4. 下列说法正确的是( )
| A.同温同压下,相同体积的两物质,它们的物质的量必相等 |
| B.1LCO气体的质量一定比1L O2的质量要小 |
| C.等体积、等物质的量浓度的强酸中所含的H+数一定相等 |
| D.任何条件下,等物质的量的N2和CO所含的分子数必相等 |
您最近一年使用:0次
2019-06-14更新
|
523次组卷
|
3卷引用:广东省湛江市2018-2019学年高一化学(人教版)第一学期期末调研化学试题
单选题
|
适中(0.65)
名校
5. 配制一定物质的量浓度的溶液是一个重要的定量实验,下列有关说法正确的是
| A.容量瓶用蒸馏水洗净后,必须干燥才能用于配制溶液 |
| B.配制1 L 0.1 mol·L-1的NaCl溶液时,用托盘天平称量5.85 g NaCl固体 |
| C.配制一定物质的量浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏高 |
| D.用浓盐酸配制稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高 |
您最近一年使用:0次
2019-06-09更新
|
1558次组卷
|
19卷引用:广东省深圳市高级中学2018-2019学年高一下学期期中考试化学试题
广东省深圳市高级中学2018-2019学年高一下学期期中考试化学试题(已下线)第20天 配制一定物质的量浓度溶液的误差分析——《2019年暑假作业总动员》高一化学江西省横峰中学等五校2019-2020学年新高一竞赛班联考化学试题江西省宜春市上高二中2019-2020学年高一上学期第一次月考化学试题内蒙古锡林浩特市第六中学2019-2020学年高一上学期第一次月考化学试题河北省石家庄市元氏县第四中学2019-2020学年高一上学期期中考试化学试题(已下线)1.2.3物质的量在化学实验中的应用(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)(已下线)第一章 从实验学化学(基础过关)-2020-2021学年高一化学单元测试定心卷(人教版必修1)(已下线)2.3.3物质的量浓度(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)练习2 化学计量在实验中的应用-2020-2021学年【补习教材·寒假作业】高一化学(人教版)浙江省淳安县汾口中学2020-2021学年高一12月阶段考试化学试题福建省莆田第二中学2020-2021学年高一上学期期末考试化学试题(已下线)2.3.3 物质的量浓度-2021-2022学年高一化学课后培优练(人教版2019必修第一册)江西省高安中学2020-2021学年高一上学期第一次月考(B)化学试题云南省丽江市2021-2022学年高一上学期期末质量监测化学试题广东实验中学2022-2023学年高一上学期期末考试化学试题广东省广州市第六中学2022-2023学年高一下学期开学考试化学试题山东省普通高中大联考2023-2024学年高一10月月考化学试题山东省滨州市邹平市第一中学2023-2024学年高一上学期10月月考化学试题
单选题
|
适中(0.65)
名校
6. 分类法在化学学科发展中起到了非常重要的作用,下列分类依据合理的是( )
①根据氧化物的组成将氧化物分成金属氧化物、非金属氧化物
②根据物质在水中的溶解度,将物质分为可溶性物质、微溶性物质和难溶性物质
③根据分散系的本质为是否有丁达尔现象,将分散系分为溶液、胶体和浊液
④根据组成元素的种类将纯净物分为单质和化合物
⑤根据物质溶于水或熔融状态下能否导电,将物质分为电解质和非电解质
①根据氧化物的组成将氧化物分成金属氧化物、非金属氧化物
②根据物质在水中的溶解度,将物质分为可溶性物质、微溶性物质和难溶性物质
③根据分散系的本质为是否有丁达尔现象,将分散系分为溶液、胶体和浊液
④根据组成元素的种类将纯净物分为单质和化合物
⑤根据物质溶于水或熔融状态下能否导电,将物质分为电解质和非电解质
| A.①②④ | B.②④⑤ | C.①②③④ | D.①②④⑤ |
【知识点】 无机物质的分类 分散系概念及其分类解读 电解质、非电解质概念解读
您最近一年使用:0次
2019-04-16更新
|
619次组卷
|
6卷引用:【全国百强校】江苏省海安高级中学2018-2019学年高一下学期3月月考化学试题1
单选题
|
适中(0.65)
名校
7. 某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
| A.一定得到电子 | B.一定失去电子 |
| C.可能被氧化也可能被还原 | D.以上都不是 |
【知识点】 氧化还原反应基本概念 氧化还原反应定义、本质及特征解读
您最近一年使用:0次
2019-06-20更新
|
266次组卷
|
5卷引用:云南省新平一中2018-2019学年高一6月月考化学试题
云南省新平一中2018-2019学年高一6月月考化学试题江西省横峰中学等五校2019-2020学年新高一竞赛班联考化学试题(已下线)2019年9月30日 《每日一题》必修1——氧化还原反应的理解与判断(已下线)2.2.1 氧化还原反应及其本质-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)天津市五十七中学2023-2024高一上学期第一次月考化学试题
二、未知 添加题型下试题
三、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
9. 下列反应的离子方程式书写正确的是
| A.向硫酸铁溶液中加入铜粉:Fe3++Cu=Fe2+ +Cu2+ |
| B.向氢氧化钡溶液中加入硫酸铜溶液:Ba2+ +SO42-=BaSO4↓ |
| C.向碳酸氢钠溶液中通入氯化氢:CO32-+2H+=CO2↑+H2O |
| D.向氨水中通入少量二氧化硫:2NH3·H2O +SO2=2NH4++SO32- +H2O |
【知识点】 离子方程式的正误判断解读
您最近一年使用:0次
2019-06-17更新
|
231次组卷
|
2卷引用:【全国百强校】山东省济南市外国语学校三箭分校2018-2019学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
名校
10. 在下列状态下,属于能够导电的电解质是( )
| A.氯化钠晶体 | B.液态氯化氢 | C.硝酸钾溶液 | D.熔融氢氧化钠 |
您最近一年使用:0次
2019-06-19更新
|
531次组卷
|
8卷引用:广东省揭西县河婆中学2018-2019学年上学期高一期中考试化学试题
单选题
|
适中(0.65)
名校
11. 能在无色溶液中大量共存的一组离子是 ( )
| A.Mg2+、SO42-、OH-、K+ | B.Fe3+、NO3-、Cl-、H+ |
| C.K+、HCO3-、Cl-、H+ | D.H+、Na+、Cl-、SO42- |
您最近一年使用:0次
2019-06-19更新
|
375次组卷
|
3卷引用:广东省揭西县河婆中学2018-2019学年上学期高一期中考试化学试题
单选题
|
适中(0.65)
名校
12. 聚合硫酸铁可用于水的净化,化学式可表示为[Fea(OH)b(SO4)c]m,取其与足量盐酸反应,所得溶液平均分为两份,一份溶液加入足量的BaCl2溶液,得到沉淀4.66 g。另一份溶液,加入足量的NaOH溶液后过滤,对滤出固体洗涤,后灼烧得到红棕色固体质量为1.6 g,该聚合硫酸铁样品中a∶b的比值是
| A.1∶1 | B.2∶1 | C.3∶1 | D.2∶5 |
您最近一年使用:0次
2019-06-19更新
|
237次组卷
|
2卷引用:黑龙江齐齐哈尔市第八中学2018-2019学年高二6月月考化学试题
单选题
|
较难(0.4)
名校
13. 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种粒子。其中N2、ClO-的物质的量随时间变化的曲线如图所示。下列判断不正确的是
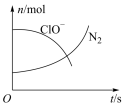

| A.该反应的氧化剂是ClO- |
| B.消耗1mol还原剂,转移3mol电子 |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.该离子方程式为3ClO-+2NH4+=2H++N2↑+3Cl-+3H2O |
【知识点】 氧化还原反应方程式的配平解读 氧化还原反应的规律解读
您最近一年使用:0次
2019-03-12更新
|
999次组卷
|
6卷引用:【全国百强校】安徽省合肥市第六中学2018-2019学年高一下学期开学考试化学试题
单选题
|
较难(0.4)
名校
14. 若以w1和w2分别表示物质的量浓度为amol/L和bmol/L酒精溶液的质量分数,已知2a=b,则下列推断正确的是( )
| A.2w1=w2 | B.w2>2w1 | C.w2<2w1 | D.不能判断 |
【知识点】 物质的量浓度的计算
您最近一年使用:0次
2018-10-26更新
|
540次组卷
|
5卷引用:【全国百强校】四川省成都市树德中学2018-2019学年高一上学期10月份月考化学试题
单选题
|
较难(0.4)
名校
15. 某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是


| A.始滤液的pH=7 |
| B.试剂Ⅰ为Ba(NO3)2溶液 |
| C.步骤②中加入试剂Ⅱ的目的是除去Ba2+ |
| D.图示步骤中的2次过滤操作不可以合并 |
您最近一年使用:0次
2019-03-18更新
|
584次组卷
|
4卷引用:2019年3月14日《每日一题》二轮复习 物质的分离、提纯
(已下线)2019年3月14日《每日一题》二轮复习 物质的分离、提纯【全国百强校】江西省南昌市第二中学2018-2019学年高二下学期期末考试化学试题江西省横峰中学等五校2019-2020学年新高一竞赛班联考化学试题江西省赣州市全南中学2023-2024学年高三上学期11月期中考试化学试题
单选题
|
较易(0.85)
名校
16. 100mL0.10mol·L-1Na2SO3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则SO32-将转化为
| A.SO42- | B.S | C.SO2 | D.S2- |
您最近一年使用:0次
2019-11-10更新
|
637次组卷
|
48卷引用:2010年云南省玉溪一中高二下学期期末考试化学试题
(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题(已下线)2011-2012学年辽宁省沈阳二中高一上学期期中考试化学试卷(已下线)2013-2014学年河南省驻马店市高一上学期四校联考化学试卷(已下线)2014年高考化学一轮复习课后规范训练2-3练习卷(已下线)2013-2014河北省石家庄一中上学期开学考试高二化学试卷(已下线)2015届吉林省东北师大附中高三第二次摸底考试化学试卷2014-2015广东省汕头市金山中学高一上学期10月月考化学试卷吉林省长春市东北师范大学附属中学2015届高三上学期二模化学试卷2016届黑龙江省大庆实验中学高三上学期开学考试化学试卷2015-2016学年河北省枣强中学高一上学期期中测试化学试卷2015-2016学年江西八一、洪都、麻丘中学等高一上期中联考化学试卷2015-2016学年内蒙古赤峰二中高一上第二次月考化学试卷2015-2016学年宁夏中卫一中高一上第三次月考化学试卷2015-2016学年四川省乐山沫若中学高一上学期12月月考化学试卷2015-2016学年四川省成都市六校高一上学期期中联考化学试卷2015-2016学年西藏日喀则高级中学高一下4月月考化学卷2015-2016学年辽宁葫芦岛一中等五校高二6月联考化学卷2015-2016学年河北沧州一中高一上第二次月考化学试卷河南省郑州市第一中学2017-2018学年高一上学期期中考试化学试题云南省玉溪市第一中学2017-2018学年高一上学期期中考试化学试题浙江省嘉兴市第一中学2017-2018学年高一上学期期中考试化学试题广西桂林市第十八中学2017-2018学年高一上学期期中考试化学试题江西省信丰中学2017-2018学年高一上学期第二次月考化学试题福建省三明市A片区高中联盟校2017-2018学年高一上学期阶段性考试化学试题四川省德阳五中2017-2018学年高一下学期期中考试化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第4讲 守恒思想在化学中的应用——守恒法解题技巧【教学案】吉林省舒兰市第一高级中学校2018-2019学年高一上学期期中考试化学试题吉林省舒兰市一中2018-2019学年高一上学期期中考试化学试题吉林省长春市第一五O中学2018-2019学年高一上学期期中考试化学试题【校级联考】辽宁省六校协作体2018-2019学年高一上学期期中考试化学试题(已下线)【走进新高考】(人教版必修一)高一上学期期中复习模拟(B卷)(提高篇)01【全国百强校】陕西省西安市长安区第一中学2018-2019学年高一上学期期中考试化学试题【全国百强校】江西省南昌市第二中学2018-2019学年高一上学期期中考试化学试题【全国百强校】福建省莆田市第一中学2018-2019学年高一上学期期中考试化学试题【全国百强校】广西壮族自治区桂林市第十八中学2018-2019学年高一上学期期中考试化学试题【全国百强校】广西壮族自治区桂林市第十八中学2018-2019学年高一上学期段考化学试题山东省微山县第二中学2019届高三上学期第三学段教学质量监测化学试题河南省封丘县一中2018-2019学年高一上学期12月月考化学试题浙江省温州市求知中学2018-2019学年高一下学期第二次月考化学试题江西省横峰中学等五校2019-2020学年新高一竞赛班联考化学试题黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期期末考试化学试题内蒙古额市一中2019-2020学年高一第一学期期中化学试题天津市六校(静海一中,杨村中学,宝坻一中,大港一中等)2019-2020学年高一上学期期中联考化学试题贵州省都匀第一中学2019-2020学年高一上学期期中考试化学试题福建省厦门外国语学校2017-2018学年高一上学期期中考试化学试题广东省广州市2019-2020学年高一上学期期中模拟卷试化学试题(二)内蒙古自治区乌兰察布市集宁一中2019-2020学年高一上学期12月月考化学试题云南师范大学附属中学2019-2020学年高一上学期期中考试化学试题
四、填空题 添加题型下试题
填空题
|
较难(0.4)
17. (1)0.5 mol Na2CO3中含有_____ 个Na+。
(2)等质量的HCl、NH3、CO2、O2四种气体,在相同温度和相同压强条件下,体积最大的是_______ 。
(3)实验室需要0.50mol·L—1NaCl溶液480mL。
①配制溶液时必需的仪器有:托盘天平(精确到0.1)、药匙、烧杯、玻璃棒、______ 、胶头滴管以及等质量的几片滤纸。
②配制该溶液需称取NaCl晶体的质量为_______ 。
③下列操作会使所配溶液浓度偏低的是________ 。
A 容量瓶洗涤干净后未干燥
B 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C 定容时俯视刻度线
D 烧杯和玻璃棒未洗涤
(2)等质量的HCl、NH3、CO2、O2四种气体,在相同温度和相同压强条件下,体积最大的是
(3)实验室需要0.50mol·L—1NaCl溶液480mL。
①配制溶液时必需的仪器有:托盘天平(精确到0.1)、药匙、烧杯、玻璃棒、
②配制该溶液需称取NaCl晶体的质量为
③下列操作会使所配溶液浓度偏低的是
A 容量瓶洗涤干净后未干燥
B 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C 定容时俯视刻度线
D 烧杯和玻璃棒未洗涤
您最近一年使用:0次
填空题
|
较易(0.85)
解题方法
18. 有以下物质:①石墨 ②铝 ③酒精 ④氨水 ⑤二氧化碳 ⑥碳酸钠固体 ⑦氢氧化钡溶液 ⑧纯醋酸 ⑨氧化钠固体 ⑩氯化氢气体 ⑪熔融氯化钠。
(1)其中能导电的是________ (填序号,下同);属于非电解质的是________ ;属于电解质的是________ ;属于弱电解质的是________ 。
(2)写出物质⑥溶于水的电离方程式:_____________________________
(3)写出物质⑥和⑧在水中反应的化学方程式:________________________
(1)其中能导电的是
(2)写出物质⑥溶于水的电离方程式:
(3)写出物质⑥和⑧在水中反应的化学方程式:
您最近一年使用:0次
2019-05-18更新
|
251次组卷
|
2卷引用:步步为赢 初高中衔接教材化学暑假作业:第9课时 电解质、非电解质
填空题
|
较易(0.85)
名校
解题方法
19. I.实验室可用KMnO4和浓盐酸反应制取氯气。
2KMnO4+16HCl(浓) 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
(1)用单线桥标出电子转移的方向和数目。____________________
(2)将上述配平的化学方程式改写为离子方程式__________________________________ 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl________ mol,转移的电子的数目约为____________ 。
II.根据反应Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原产物是______ 。
②氧化剂与氧化产物的物质的量之比是____ 。
2KMnO4+16HCl(浓)
 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O (1)用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式
(3)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl
II.根据反应Cu+4HNO3(浓)
 Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
Cu(NO3)2+2NO2↑+2H2O,回答下列问题:①还原产物是
②氧化剂与氧化产物的物质的量之比是
您最近一年使用:0次
2018-01-13更新
|
498次组卷
|
3卷引用:甘肃省武威市第六中学2017-2018学年高一上学期期末考试化学试题
五、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
20. 某课外探究活动小组使用常用仪器,运用实验室制备氢气的原理,巧妙设计了如图所示的简单实验装置。

甲同学设计了如图甲所示装置:
①检查该装置气密性的方法是_________
②实验时若液面不能与锌粒接触,又无酸液可加,且该装置已固定,则使反应发生的操作是_____
(2)乙同学把试管底部钻一小洞,并和广口瓶组装成如图乙所示具有启普发生器功能的装置,若该装置中的隔板是用铜丝制成的,隔板上放锌粒,酸使用H2SO4,写出反应的离子方程式:_____
(3)丙同学设计了如图丙所示装置,即用橡皮塞代替铁架台来固定试管,则丙同学的做法________ (填“可行”或“不可行”),理由是______________

甲同学设计了如图甲所示装置:
①检查该装置气密性的方法是
②实验时若液面不能与锌粒接触,又无酸液可加,且该装置已固定,则使反应发生的操作是
(2)乙同学把试管底部钻一小洞,并和广口瓶组装成如图乙所示具有启普发生器功能的装置,若该装置中的隔板是用铜丝制成的,隔板上放锌粒,酸使用H2SO4,写出反应的离子方程式:
(3)丙同学设计了如图丙所示装置,即用橡皮塞代替铁架台来固定试管,则丙同学的做法
【知识点】 化学实验基础操作解读 常见气体的制备与收集解读 化学实验
您最近一年使用:0次
2019-05-21更新
|
227次组卷
|
2卷引用:步步为赢 初高中衔接教材化学暑假作业:第30课时 气体制备或性质实验装置气密性的检查
解答题-实验探究题
|
较难(0.4)
21. 某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案:
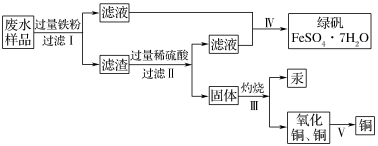
(1)现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的仪器是________ (填序号);

(2)步骤Ⅰ中加入过量铁粉的目的是________ ;步骤Ⅱ中________ (填“能”或“不能”)用盐酸代替硫酸。
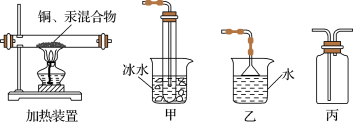
(3)步骤Ⅲ的实验装置如图所示,加热装置应与装置________ (填“甲”“乙”或“丙”)连接,理由是_____________
(4)利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;
方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉,过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。从安全角度考虑,方案________ (填“甲”“乙”或“丙”,下同)不好;从产品纯度考虑,方案________ 不好。
(5)写出步骤Ⅰ中涉及反应的离子方程式:________________

(1)现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的仪器是

(2)步骤Ⅰ中加入过量铁粉的目的是
(3)步骤Ⅲ的实验装置如图所示,加热装置应与装置

(4)利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;
方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉,过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。从安全角度考虑,方案
(5)写出步骤Ⅰ中涉及反应的离子方程式:
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学实验基础、认识化学科学、初中衔接知识点
试卷题型(共 21题)
题型
数量
单选题
15
未知
1
填空题
3
解答题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 物质分离、提纯的常见物理方法 蒸发与结晶 过滤 | |
| 2 | 0.85 | 摩尔质量 阿伏加德罗常数的含义 | |
| 3 | 0.65 | 物质的量浓度 物质的量浓度概念、含义 物质的量浓度的计算 物质的量浓度计算-与溶质成分有关的计算 | |
| 4 | 0.65 | 阿伏加德罗定律的应用 物质的量有关计算 物质的量浓度计算-与溶质成分有关的计算 | |
| 5 | 0.65 | 一定物质的量浓度的溶液的配制 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度的溶液实验的仪器 | |
| 6 | 0.65 | 无机物质的分类 分散系概念及其分类 电解质、非电解质概念 | |
| 7 | 0.65 | 氧化还原反应基本概念 氧化还原反应定义、本质及特征 | |
| 9 | 0.65 | 离子方程式的正误判断 | |
| 10 | 0.65 | 电解质与非电解质 非电解质、电解质物质类别判断 物质水溶液的导电性 | |
| 11 | 0.65 | 离子反应的发生条件 离子共存 无附加条件的离子共存 限定条件下的离子共存 | |
| 12 | 0.65 | 物质的量有关计算 根据n=m/M进行相关计算 离子反应在化合物组成的分析、鉴定的应用 探究物质组成或测量物质的含量 | |
| 13 | 0.4 | 氧化还原反应方程式的配平 氧化还原反应的规律 | |
| 14 | 0.4 | 物质的量浓度的计算 | |
| 15 | 0.4 | 化学实验基础操作 物质分离、提纯的常见物理方法 物质分离、提纯的常见化学方法 | |
| 16 | 0.85 | 氧化还原反应基本概念 氧化还原反应有关计算 基于氧化还原反应守恒规律的计算 | |
| 二、未知 | |||
| 8 | 0.65 | 氧化性、还原性强弱的比较 氧化还原反应的规律 | 未知 |
| 三、填空题 | |||
| 17 | 0.4 | 阿伏加德罗定律的应用 根据n=N/NA进行相关计算 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度的溶液实验的仪器 | |
| 18 | 0.85 | 非电解质、电解质物质类别判断 物质水溶液的导电性 电离方程式 | |
| 19 | 0.85 | 单线桥、双线桥分析氧化还原反应 氧化还原反应方程式的配平 氧化还原反应在生活、生产中的应用 氧化还原反应的规律 | |
| 四、解答题 | |||
| 20 | 0.65 | 化学实验基础操作 常见气体的制备与收集 化学实验 | 实验探究题 |
| 21 | 0.4 | 化学实验基础操作 物质分离、提纯综合应用 物质制备的探究 综合实验设计与评价 | 实验探究题 |



