名校
解题方法
1 . 海洋资源的利用具有广阔的前景。利用空气吹出法从海水中提取溴的流程如图:
(1)“吸收塔”中发生反应的离子方程式为_______ 。
(2)“蒸馏塔”具有将溴单质与水溶液分离的作用,其温度应控制在_____ (填序号)。
A.40∼50℃ B.60∼70℃ C.100℃以上
(3)物质A_____ (填化学式)可以循环利用。
(4)探究“氧化”的适宜条件,测得不同条件下溶液中被氧化的 的百分含量如图:
的百分含量如图: 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。
①结合实际生产,“氧化”的适宜条件为______ 。
②海水中溴元素的浓度是64mg/L,经该方法处理后1m3海水最终得到38.4gBr2,则该实验海水中溴元素的提取率为______ 。
③吸收后的空气进行循环利用,吹出时,吹出塔中 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示,当
流量的关系如图所示,当 流量过大,
流量过大, 吹出率反而下降,其原因:
吹出率反而下降,其原因:______ 。
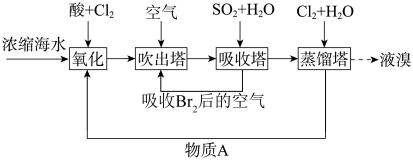
(1)“吸收塔”中发生反应的离子方程式为
(2)“蒸馏塔”具有将溴单质与水溶液分离的作用,其温度应控制在
A.40∼50℃ B.60∼70℃ C.100℃以上
(3)物质A
(4)探究“氧化”的适宜条件,测得不同条件下溶液中被氧化的
 的百分含量如图:
的百分含量如图: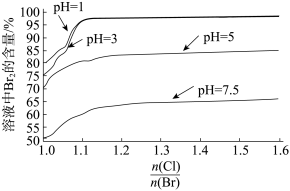
 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。①结合实际生产,“氧化”的适宜条件为
②海水中溴元素的浓度是64mg/L,经该方法处理后1m3海水最终得到38.4gBr2,则该实验海水中溴元素的提取率为
③吸收后的空气进行循环利用,吹出时,吹出塔中
 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示,当
流量的关系如图所示,当 流量过大,
流量过大, 吹出率反而下降,其原因:
吹出率反而下降,其原因:
您最近半年使用:0次
名校
解题方法
2 . 碲(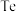 )是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是
)是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是 、
、 )制取粗碲、
)制取粗碲、 固体的工艺流程如图所示。
固体的工艺流程如图所示。 属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成
属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成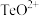 和
和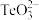 。
。
回答下列问题:
(1)“焙烧”过程在焙烧炉内完成,焙烧炉内壁材料可以为___________(填标号)。
(2)“焙烧”常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部加入,这样操作的目的是___________ ;“焙烧”时, 转化为
转化为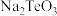 和
和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(3)“调 ”时控制
”时控制 为
为 ,此时生成
,此时生成 的离子方程式为
的离子方程式为___________ ;加入硫酸的量不宜过多,其原因是___________ 。
(4)“还原”时,获得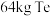 理论上需要标准状况下
理论上需要标准状况下 的体积为
的体积为___________ 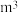 ;流程中可以循环利用的物质是
;流程中可以循环利用的物质是___________ (填化学式)。
(5)获得 固体“一系列操作”包含
固体“一系列操作”包含___________ 、过滤、洗涤、干燥。
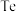 )是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是
)是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是 、
、 )制取粗碲、
)制取粗碲、 固体的工艺流程如图所示。
固体的工艺流程如图所示。
 属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成
属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成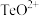 和
和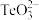 。
。回答下列问题:
(1)“焙烧”过程在焙烧炉内完成,焙烧炉内壁材料可以为___________(填标号)。
A. | B. | C. | D. |
(2)“焙烧”常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部加入,这样操作的目的是
 转化为
转化为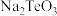 和
和 ,该反应的化学方程式为
,该反应的化学方程式为(3)“调
 ”时控制
”时控制 为
为 ,此时生成
,此时生成 的离子方程式为
的离子方程式为(4)“还原”时,获得
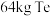 理论上需要标准状况下
理论上需要标准状况下 的体积为
的体积为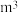 ;流程中可以循环利用的物质是
;流程中可以循环利用的物质是(5)获得
 固体“一系列操作”包含
固体“一系列操作”包含
您最近半年使用:0次
3 .  被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为
被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为 ,含少量
,含少量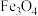 、
、 和
和 )为原料制备
)为原料制备 的流程如下:
的流程如下: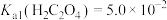 ,
,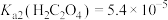 ,
, ;
;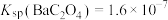 ,
,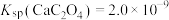 。
。
回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有_____ 种。
(2)浸渣的主要成分为_____ 和_____ (填化学式),“浸出”步骤中 与
与 溶液反应的原理为
溶液反应的原理为_____ (用离子方程式表示)。
(3)若浸出液中 ,
, ,“除钙”步骤中,当沉钙率为90%时,钡损率为
,“除钙”步骤中,当沉钙率为90%时,钡损率为_____ 。
(4)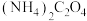 溶液显
溶液显_____ (填“酸”“碱”或“中”)性;“沉钛”步骤所得沉淀为 ,该步骤生成的能循环利用的物质是
,该步骤生成的能循环利用的物质是_____ (填化学式)。
(5)“热解”步骤的化学方程式为_____ 。
(6) 在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。
在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。 ,则B点微粒的坐标为
,则B点微粒的坐标为_____ 。
②Ti在晶胞中的位置为_____ ;晶胞中一个Ba周围与其最近的O的个数为_____ 。
 被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为
被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为 ,含少量
,含少量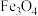 、
、 和
和 )为原料制备
)为原料制备 的流程如下:
的流程如下: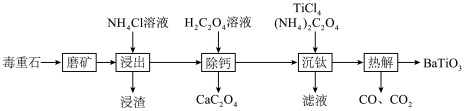
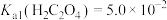 ,
,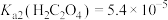 ,
, ;
;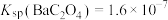 ,
,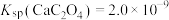 。
。回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有
(2)浸渣的主要成分为
 与
与 溶液反应的原理为
溶液反应的原理为(3)若浸出液中
 ,
, ,“除钙”步骤中,当沉钙率为90%时,钡损率为
,“除钙”步骤中,当沉钙率为90%时,钡损率为(4)
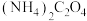 溶液显
溶液显 ,该步骤生成的能循环利用的物质是
,该步骤生成的能循环利用的物质是(5)“热解”步骤的化学方程式为
(6)
 在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。
在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。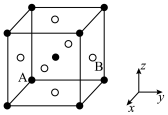
 ,则B点微粒的坐标为
,则B点微粒的坐标为②Ti在晶胞中的位置为
您最近半年使用:0次
解题方法
4 . 工业上用赤铁矿(主要含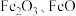 ,还含有少量的
,还含有少量的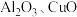 等杂质)制备绿矾
等杂质)制备绿矾 的流程如下:
的流程如下: 溶液加入赤铁矿中发生反应的离子方程式为
溶液加入赤铁矿中发生反应的离子方程式为___________ 。
(2)试剂b为___________ (填化学式,下同),“溶液I”中氧化性最强的阳离子为___________ ,检验该离子的试剂是___________ 。
(3)操作③需要隔绝空气的主要原因是___________ 。
(4) 样品受热分解过程中样品质量随温度变化的曲线如图所示:请回答下列问题:
样品受热分解过程中样品质量随温度变化的曲线如图所示:请回答下列问题: 时,固体物质
时,固体物质 的化学式为
的化学式为___________ 。
②继续将物质 隔绝空气加热到
隔绝空气加热到 至反应完全,得到一种固体物质
至反应完全,得到一种固体物质 ,同时有两种等物质的量的常见含硫氧化物生成,则
,同时有两种等物质的量的常见含硫氧化物生成,则 的质量为
的质量为___________ 。
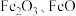 ,还含有少量的
,还含有少量的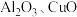 等杂质)制备绿矾
等杂质)制备绿矾 的流程如下:
的流程如下:
 溶液加入赤铁矿中发生反应的离子方程式为
溶液加入赤铁矿中发生反应的离子方程式为(2)试剂b为
(3)操作③需要隔绝空气的主要原因是
(4)
 样品受热分解过程中样品质量随温度变化的曲线如图所示:请回答下列问题:
样品受热分解过程中样品质量随温度变化的曲线如图所示:请回答下列问题:
 时,固体物质
时,固体物质 的化学式为
的化学式为②继续将物质
 隔绝空气加热到
隔绝空气加热到 至反应完全,得到一种固体物质
至反应完全,得到一种固体物质 ,同时有两种等物质的量的常见含硫氧化物生成,则
,同时有两种等物质的量的常见含硫氧化物生成,则 的质量为
的质量为
您最近半年使用:0次
解题方法
5 .  广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为
广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为 ,杂质为
,杂质为 等元素的化合物,提取氧化锌的工艺流程如图。
等元素的化合物,提取氧化锌的工艺流程如图。
② 下,
下, 的
的 的
的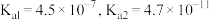 ,
, 的
的 。
。
③当离子浓度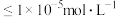 时,可视为沉淀完全。
时,可视为沉淀完全。
回答下列问题:
(1)为了提高“焙烧”效率,可采取的措施为_______ ,“滤渣1”的主要成分是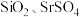 、
、_______ (填化学式)。
(2)若考虑环保因素,“氧化除铁”工序加入的X应选择_______(填标号)最合适。
(3)等浓度的①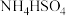 溶液 ②
溶液 ② 溶液 ③
溶液 ③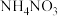 溶液的
溶液的 从小到大的顺序为
从小到大的顺序为_______ (用标号表示)。
(4)室温时,“沉铝”过程发生反应的离子方程式为_______ 。用 调节溶液的
调节溶液的
_______ (保留一位小数),“沉铝”完全。
(5)“沉锌”工序中生成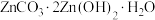 沉淀,写出发生反应的离子方程式:
沉淀,写出发生反应的离子方程式:_______ ;“滤液”的主要成分为 ,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:
,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:_______ 。
 广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为
广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为 ,杂质为
,杂质为 等元素的化合物,提取氧化锌的工艺流程如图。
等元素的化合物,提取氧化锌的工艺流程如图。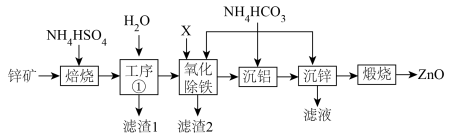
②
 下,
下, 的
的 的
的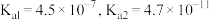 ,
, 的
的 。
。③当离子浓度
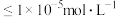 时,可视为沉淀完全。
时,可视为沉淀完全。回答下列问题:
(1)为了提高“焙烧”效率,可采取的措施为
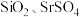 、
、(2)若考虑环保因素,“氧化除铁”工序加入的X应选择_______(填标号)最合适。
A. | B. | C. | D. |
(3)等浓度的①
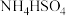 溶液 ②
溶液 ② 溶液 ③
溶液 ③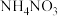 溶液的
溶液的 从小到大的顺序为
从小到大的顺序为(4)室温时,“沉铝”过程发生反应的离子方程式为
 调节溶液的
调节溶液的
(5)“沉锌”工序中生成
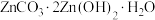 沉淀,写出发生反应的离子方程式:
沉淀,写出发生反应的离子方程式: ,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:
,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:
您最近半年使用:0次
名校
解题方法
6 . 锗是一种重要的半导体材料,工业上用精硫锗矿(主要成分为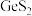 )制取高纯度锗的工艺流程如图所示:
)制取高纯度锗的工艺流程如图所示: 分子中各原子均达到8电子稳定结构,其结构式为
分子中各原子均达到8电子稳定结构,其结构式为___________ 。
(2) 升华时通入
升华时通入 的目的是:
的目的是:___________ 、___________ 。
(3)酸浸时 、S元素均被氧化到最高价态,写出该反应的离子方程式:
、S元素均被氧化到最高价态,写出该反应的离子方程式:___________ ,酸浸时温度不能过高的原因是___________ 。
(4) 易水解生成
易水解生成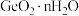 ,证明
,证明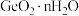 沉淀洗涤干净的方法是
沉淀洗涤干净的方法是___________ 。
(5)测定锗的含量:称取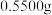 锗样品,加入双氧水溶解,再加入盐酸生成
锗样品,加入双氧水溶解,再加入盐酸生成 ,以淀粉为指示剂,用
,以淀粉为指示剂,用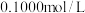 的碘酸钾标准溶液滴定,消耗碘酸钾的体积为
的碘酸钾标准溶液滴定,消耗碘酸钾的体积为 。已知:酸性条件下
。已知:酸性条件下 ,能将
,能将 氧化为
氧化为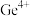 ,①在滴定过程中依次发生的离子方程式为:
,①在滴定过程中依次发生的离子方程式为:___________ 、 ,②该样品中储的质量分数是
,②该样品中储的质量分数是___________ %(精确到0.01%)。
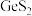 )制取高纯度锗的工艺流程如图所示:
)制取高纯度锗的工艺流程如图所示: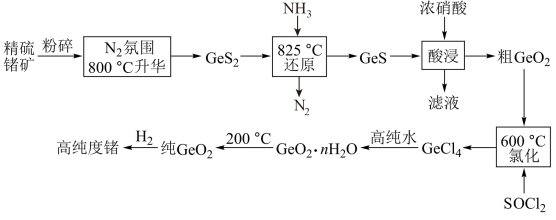
 分子中各原子均达到8电子稳定结构,其结构式为
分子中各原子均达到8电子稳定结构,其结构式为(2)
 升华时通入
升华时通入 的目的是:
的目的是:(3)酸浸时
 、S元素均被氧化到最高价态,写出该反应的离子方程式:
、S元素均被氧化到最高价态,写出该反应的离子方程式:(4)
 易水解生成
易水解生成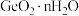 ,证明
,证明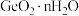 沉淀洗涤干净的方法是
沉淀洗涤干净的方法是(5)测定锗的含量:称取
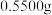 锗样品,加入双氧水溶解,再加入盐酸生成
锗样品,加入双氧水溶解,再加入盐酸生成 ,以淀粉为指示剂,用
,以淀粉为指示剂,用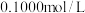 的碘酸钾标准溶液滴定,消耗碘酸钾的体积为
的碘酸钾标准溶液滴定,消耗碘酸钾的体积为 。已知:酸性条件下
。已知:酸性条件下 ,能将
,能将 氧化为
氧化为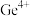 ,①在滴定过程中依次发生的离子方程式为:
,①在滴定过程中依次发生的离子方程式为: ,②该样品中储的质量分数是
,②该样品中储的质量分数是
您最近半年使用:0次
解题方法
7 . 利用金属矿渣(含有FeS2、SiO2及Cu2O)制备FeCO3的实验流程如下。已知煅烧过程中FeS2和Cu2O转化为Fe2O3和CuO。 的反应外,还发生反应的
的反应外,还发生反应的离子方程式 有___________ 、___________ 。
(2)检验Fe3+是否完全被还原的实验操作是___________ 。
(3)FeSO4溶液浓度的测定。取制得的FeSO4溶液25.00mL,置于锥形瓶中,加入一定量的酸溶液,用0.1000mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液19.50mL。计算FeSO4溶液的物质的是浓度___________ 。(写出计算过程)
(4)制备 FeCO3.写出“沉铁”步骤发生反应的离子方程式 :___________ 。
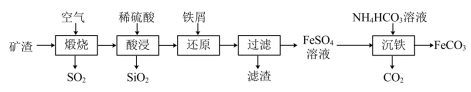
 的反应外,还发生反应的
的反应外,还发生反应的(2)检验Fe3+是否完全被还原的实验操作是
(3)FeSO4溶液浓度的测定。取制得的FeSO4溶液25.00mL,置于锥形瓶中,加入一定量的酸溶液,用0.1000mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液19.50mL。计算FeSO4溶液的物质的是浓度
(4)制备 FeCO3.写出“沉铁”步骤发生反应的
您最近半年使用:0次
解题方法
8 . 某实验小组以含铁污泥(主要成分为 、
、 及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾
及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾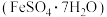 和柠檬酸铁铵。
和柠檬酸铁铵。
(1)写出“酸浸”时, 与硫酸反应的离子方程式:
与硫酸反应的离子方程式:___________ 。
(2)“滤液X”中含有的阳离子为___________ 。
(3)路线I中,加入 溶液的目的是
溶液的目的是___________ 。
(4)写出加入氨水“沉淀”时的离子方程式:___________ 。
(5)写出加入过量铁粉时发生反应的离子方程式:___________ 、___________ 。
(6)“酸浸”时加入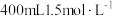 硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为
硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为___________ g。
 、
、 及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾
及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾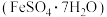 和柠檬酸铁铵。
和柠檬酸铁铵。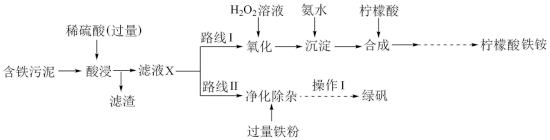
(1)写出“酸浸”时,
 与硫酸反应的离子方程式:
与硫酸反应的离子方程式:(2)“滤液X”中含有的阳离子为
(3)路线I中,加入
 溶液的目的是
溶液的目的是(4)写出加入氨水“沉淀”时的离子方程式:
(5)写出加入过量铁粉时发生反应的离子方程式:
(6)“酸浸”时加入
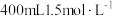 硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为
硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为
您最近半年使用:0次
名校
解题方法
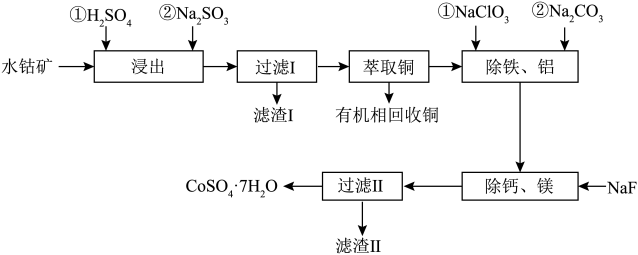
9 . CoSO47H2O有着广泛的应用,可以用作催化剂,用于有机合成反应中;还可以用于电镀、染色、制备颜料等工业应用。一种水钴矿中含SiO2、Co2O3、CuO、FeO、Al2O3、CaO及MgO等,以该水钴矿为原料提取出CoSO4·7H2O的工艺流程如下:
②当离子浓度小于或等于105molL1时认为该离子沉淀完全。
请回答下列问题:
(1)为提高“浸出”速率,可以采取的措施是_______ 写出2条措施即可)。
(2)“浸出”步骤中,Co2O3发生反应的化学方程式为_______ 。
(3)滤渣Ⅰ的成分是_______ (填化学式)。
(4)“除铁、铝”步骤中,除铁时反应过程中氧化剂与还原剂的物质的量之比为_______ ;除铝时同时生成沉淀和气体,则发生反应的离子方程式为_______ 。
(5)“除钙、镁”步骤时,当钙离子和镁离子恰好除尽时,溶液中的氟离子浓度应不低于_______ molL1。
(6)由“过滤Ⅱ”后的母液得到CoSO47H2O的操作是_______ ,_______ 、过滤、洗涤、干燥。
②当离子浓度小于或等于105molL1时认为该离子沉淀完全。
请回答下列问题:
(1)为提高“浸出”速率,可以采取的措施是
(2)“浸出”步骤中,Co2O3发生反应的化学方程式为
(3)滤渣Ⅰ的成分是
(4)“除铁、铝”步骤中,除铁时反应过程中氧化剂与还原剂的物质的量之比为
(5)“除钙、镁”步骤时,当钙离子和镁离子恰好除尽时,溶液中的氟离子浓度应不低于
(6)由“过滤Ⅱ”后的母液得到CoSO47H2O的操作是
您最近半年使用:0次
名校
解题方法
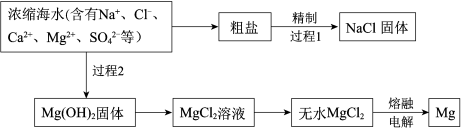
10 . 浩瀚的海洋中蕴藏着丰富的资源。
过程1除去粗盐中的Ca2+、Mg2+、SO 杂质时,粗盐溶解后加入沉淀剂:a.过量的Na2CO3溶液b.过量的BaCl2溶液c.过量的NaOH溶液过滤除去沉淀,再加入适量的盐酸。
杂质时,粗盐溶解后加入沉淀剂:a.过量的Na2CO3溶液b.过量的BaCl2溶液c.过量的NaOH溶液过滤除去沉淀,再加入适量的盐酸。
①加入沉淀剂的顺序正确的是___________ (填序号)。
A.abc B.bac C.cba
②加入适量盐酸,反应的离子方程式有2H++CO =H2O+CO2↑和
=H2O+CO2↑和___________ 。
(2)海水提镁。
过程2中加入的试剂是___________ 。由无水MgCl2获得Mg的化学方程式是___________ 。
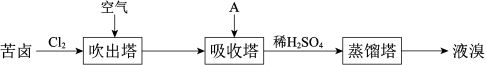
(3)海水提溴。
主要工业生产流程如下图所示:___________ 。
②吸收塔中,A吸收了Br2后的溶液中含有Br‒和BrO ,则A是
,则A是___________ (填序号)。
a.NaCl溶液 b.Na2CO3溶液 c.SO2气体
③从吸收塔出来的溶液中加入稀H2SO4得到Br2的离子方程式是___________ 。
过程1除去粗盐中的Ca2+、Mg2+、SO
 杂质时,粗盐溶解后加入沉淀剂:a.过量的Na2CO3溶液b.过量的BaCl2溶液c.过量的NaOH溶液过滤除去沉淀,再加入适量的盐酸。
杂质时,粗盐溶解后加入沉淀剂:a.过量的Na2CO3溶液b.过量的BaCl2溶液c.过量的NaOH溶液过滤除去沉淀,再加入适量的盐酸。①加入沉淀剂的顺序正确的是
A.abc B.bac C.cba
②加入适量盐酸,反应的离子方程式有2H++CO
 =H2O+CO2↑和
=H2O+CO2↑和(2)海水提镁。
过程2中加入的试剂是
(3)海水提溴。
主要工业生产流程如下图所示:
②吸收塔中,A吸收了Br2后的溶液中含有Br‒和BrO
 ,则A是
,则A是a.NaCl溶液 b.Na2CO3溶液 c.SO2气体
③从吸收塔出来的溶液中加入稀H2SO4得到Br2的离子方程式是
您最近半年使用:0次



