研究小组以无水甲苯为溶剂,PCl5(易水解)和NaN3为反应物制备纳米球状红磷。该红磷可提高钠离子电池的性能。
(1)甲苯干燥和收集的回流装置如图1所示(夹持及加热装置略)。以二苯甲酮为指示剂,无水时体系呈蓝色。_____ 中。
②冷凝水的进口是______ (填“a”或“b”)。
③用Na干燥甲苯的原理是_____ (用化学方程式表示)。
④回流过程中,除水时打开的活塞是_____ ;体系变蓝后,改变开关状态收集甲苯。
(2)纳米球状红磷的制备装置如图2所示(搅拌和加热装置略)。_____ 。用Ar气赶走空气的目的是_____ 。
②经冷却、离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是_____ 和_____ 。
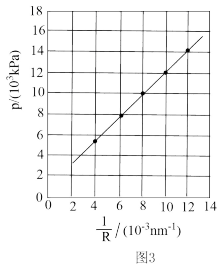
③所得纳米球状红磷的平均半径R与B装置中气体产物的压强p的关系如图3所示。欲控制合成R=125nm的红磷,气体产物的压强为_____ kPa,需NaN3的物质的量为______ mol(保留3位小数)。已知:p=a×n,其中a=2.5×105kPa•mol-1,n为气体产物的物质的量。
(1)甲苯干燥和收集的回流装置如图1所示(夹持及加热装置略)。以二苯甲酮为指示剂,无水时体系呈蓝色。

②冷凝水的进口是
③用Na干燥甲苯的原理是
④回流过程中,除水时打开的活塞是
(2)纳米球状红磷的制备装置如图2所示(搅拌和加热装置略)。
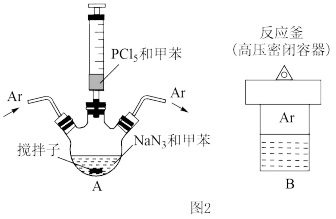
②经冷却、离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是
③所得纳米球状红磷的平均半径R与B装置中气体产物的压强p的关系如图3所示。欲控制合成R=125nm的红磷,气体产物的压强为
2022高三·全国·专题练习 查看更多[9]
(已下线)题型四 以无机物制备为载体的综合实验-备战2024年高考化学答题技巧与模板构建广东省佛山市第四中学2023-2024学年上学期高二开学考试化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)2022年重庆高考真题化学试题变式题(实验探究题)2022年重庆高考真题化学试题(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编
更新时间:2023-02-22 15:15:53
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】K4[Fe(CN)6](亚铁氯化钾)俗称黄血盐,是国内外广泛使用的食盐抗结剂,可以防止食盐受潮结块,其在化学实验、电镀、食品添加剂及医学上有广泛用途。用含NaCN废水合成黄血盐的主要工艺流程如图:
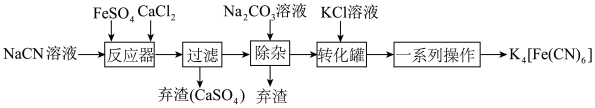
回答下列问题:
(1)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至400℃时能分解产生氰化钾(KCN)。据此判断,烹饪食品时,使用含黄血盐的食盐应注意的问题为____ 。
(2)HCN是一种极弱的酸。实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液再用蒸馏水稀释,用平衡移动原理(离子方程式及文字)解释其原因____ 。
(3)流程中加入碳酸钠溶液的主要目的是____ ,用碳酸钾代替纯碱进行脱钙反应,可以直接得到亚铁氰化钾,沉淀和产物容易彻底分离,但是成本高。有人认为也可以用硫酸钾,实际上不妥,其原因是____ 。
(4)流程中的一系列操作包括结晶、过滤、洗涤、干燥等步骤。为了得到较大颗粒的亚铁氰化钾,结晶速率应该是____ (填“快速”或“慢速”)。
(5)在25℃下,将amol·L-1的KCN溶液与0.01mol·L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a____ 0.01mol·L-1(填“>”、“<”或“=”),用含a的代数式表示HCN的电离常数K=____ 。
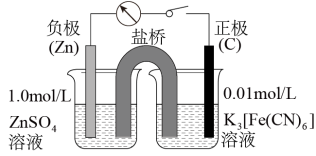
(6)亚铁氰化钾易被氧化为铁氰化钾,检验是否变质的方法是____ ,借助下列装置可以将铁氰化钾转化为亚铁氰化钾,其正极的电极反应式为____ 。

回答下列问题:
(1)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至400℃时能分解产生氰化钾(KCN)。据此判断,烹饪食品时,使用含黄血盐的食盐应注意的问题为
(2)HCN是一种极弱的酸。实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液再用蒸馏水稀释,用平衡移动原理(离子方程式及文字)解释其原因
(3)流程中加入碳酸钠溶液的主要目的是
(4)流程中的一系列操作包括结晶、过滤、洗涤、干燥等步骤。为了得到较大颗粒的亚铁氰化钾,结晶速率应该是
(5)在25℃下,将amol·L-1的KCN溶液与0.01mol·L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a
(6)亚铁氰化钾易被氧化为铁氰化钾,检验是否变质的方法是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如下流程转化为粗As2O3。
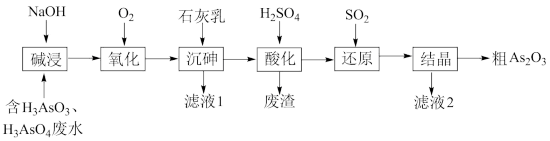
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是___________ 。
(2)“氧化”时,1mol AsO 转化为AsO
转化为AsO 至少需要O2
至少需要O2_____ 。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)⇌Ca2+(aq)+2OH-(aq)△H<0
b.5Ca2++OH-+3AsO ⇌Ca5(AsO4)3OH △H>0
⇌Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。高于85℃后,随温度升高,沉淀率______ (填“提高”或“下降”)。用化学平衡原理解释其原因是___________ 。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是___________ 。
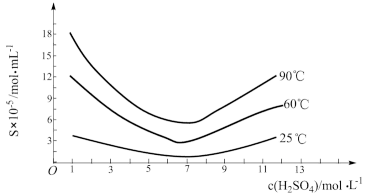
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是___________ 。
(6)下列说法中,正确的是___________ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液1、2和废渣一同弃掉
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的

(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是
(2)“氧化”时,1mol AsO
 转化为AsO
转化为AsO 至少需要O2
至少需要O2(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)⇌Ca2+(aq)+2OH-(aq)△H<0
b.5Ca2++OH-+3AsO
 ⇌Ca5(AsO4)3OH △H>0
⇌Ca5(AsO4)3OH △H>0研究表明:“沉砷”的最佳温度是85℃。高于85℃后,随温度升高,沉淀率
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是

(6)下列说法中,正确的是
a.粗As2O3中含有CaSO4
b.工业生产中,滤液1、2和废渣一同弃掉
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
Ⅰ.pH=2 时, NaNO2溶液只能将 I-氧化为 I2,同时生成 NO;
Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl;
Ⅲ.I2在碱性溶液中反应生成 I-和 IO 。
。
(1)反应①的离子方程式___________ 。
(2)方案甲中,根据 I2的特性,分离操作 X 应为___________ 、___________ 。
(3)Cl2、酸性 KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的 I-却选择了价格较高的NaNO2,原因是___________ 。
(4)写出反应②的离子反应方程式___________
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的 I2、I-。 请检验滤液中的 I-,将实验方案补充完整。实验中可供选择的试剂:稀 H2SO4、淀粉溶液、Fe2(SO4)3溶液。
A.将滤液___________ ,直到水层用淀粉溶液检验不出碘单质存在。
B.从水层取少量溶液于试管中,___________ 。

资料显示:
Ⅰ.pH=2 时, NaNO2溶液只能将 I-氧化为 I2,同时生成 NO;
Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl;
Ⅲ.I2在碱性溶液中反应生成 I-和 IO
 。
。 (1)反应①的离子方程式
(2)方案甲中,根据 I2的特性,分离操作 X 应为
(3)Cl2、酸性 KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的 I-却选择了价格较高的NaNO2,原因是
(4)写出反应②的离子反应方程式
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的 I2、I-。 请检验滤液中的 I-,将实验方案补充完整。实验中可供选择的试剂:稀 H2SO4、淀粉溶液、Fe2(SO4)3溶液。
A.将滤液
B.从水层取少量溶液于试管中,
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】铋酸钠(NaBiO3)浅黄色、不溶于冷水、与沸水或酸溶液反应。它常用作分析试剂、氧化剂,如在钢铁分析中测定锰等。某同学在实验室用氯气将Bi(OH)3(白色,难溶于水)氧化制取(NaBiO3),并探究其性质。各实验装置如下图所示:
(1)装置的连接顺序是:________ (填装置下面的字母)
___________→___________→___________→___________。
(2)仪器a的名称是___________ ;装置C的作用是___________ 。
(3)当观察到B中白色固体转化为淡黄色固体且黄色不再加深时,可以判断B中反应已经完成,下一步应进行的操作是___________ 。
(4)装置B中发生反应的离子方程式为___________ 。
(5)该同学将铋酸钠固体加到足量的浓盐酸中,发现浅黄色固体溶解,并有黄绿色气体产生,于是该同学很矛盾,矛盾的原因是:该实验现象说明 的氧化性比
的氧化性比 强,可是从装置B中的反应来看,
强,可是从装置B中的反应来看, 的氧化性比(NaBiO3)强。请你向该同学解释其原因
的氧化性比(NaBiO3)强。请你向该同学解释其原因___________ 。
(6)为测定产品的纯度。取上述(NaBiO3)产品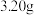 ,用足量硫酸和
,用足量硫酸和 稀溶液使其还原为
稀溶液使其还原为 ,再将其准确配制成
,再将其准确配制成 溶液,取出
溶液,取出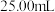 ,用
,用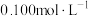 的
的 标准溶液滴定生成的
标准溶液滴定生成的 ,滴定终点时消耗
,滴定终点时消耗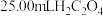 标准溶液,则该产品的纯度为
标准溶液,则该产品的纯度为___________ 。已知: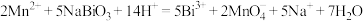 ,
, 的摩尔质量为280g/mol)
的摩尔质量为280g/mol)

(1)装置的连接顺序是:
___________→___________→___________→___________。
(2)仪器a的名称是
(3)当观察到B中白色固体转化为淡黄色固体且黄色不再加深时,可以判断B中反应已经完成,下一步应进行的操作是
(4)装置B中发生反应的离子方程式为
(5)该同学将铋酸钠固体加到足量的浓盐酸中,发现浅黄色固体溶解,并有黄绿色气体产生,于是该同学很矛盾,矛盾的原因是:该实验现象说明
 的氧化性比
的氧化性比 强,可是从装置B中的反应来看,
强,可是从装置B中的反应来看, 的氧化性比(NaBiO3)强。请你向该同学解释其原因
的氧化性比(NaBiO3)强。请你向该同学解释其原因(6)为测定产品的纯度。取上述(NaBiO3)产品
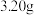 ,用足量硫酸和
,用足量硫酸和 稀溶液使其还原为
稀溶液使其还原为 ,再将其准确配制成
,再将其准确配制成 溶液,取出
溶液,取出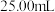 ,用
,用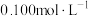 的
的 标准溶液滴定生成的
标准溶液滴定生成的 ,滴定终点时消耗
,滴定终点时消耗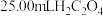 标准溶液,则该产品的纯度为
标准溶液,则该产品的纯度为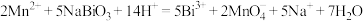 ,
, 的摩尔质量为280g/mol)
的摩尔质量为280g/mol)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】I、某化学课外活动小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题,可供选择的试剂有:A.大理石 B.盐酸 C.氢氧化钠溶液 D.澄清石灰水
甲、乙、丙三位同学设计的制备实验方案的反应流程分别如下:
甲:NaOH溶液 Na2CO3溶液
Na2CO3溶液
乙:NaOH溶液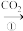 NaHCO3溶液
NaHCO3溶液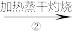 Na2CO3固体
Na2CO3固体 Na2CO3溶液
Na2CO3溶液
丙:NaOH溶液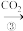 NaHCO3溶液
NaHCO3溶液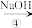 Na2CO3溶液
Na2CO3溶液
请回答下列问题:
(1)___________ 方案最优,其实验的关键是:_________ 。
(2)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3,乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学___________ (填“能”或“不能”)达到实验目的;若能,请说明计算所需的数据;若不能,请简要说明理由:___________ 。
II、若以上所需氢氧化钠溶液需要配制成98mL1.0mol/L的溶液,回答以下问题:
(3)计算:需___________ g的NaOH固体;实验中用到的玻璃仪器除了烧杯、玻璃棒、胶头滴管、量筒、试剂瓶,还需要___________ 。
(4)下列实验步骤,正确的操作顺序是:___________ 。
A.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
B.把已冷却的氢氧化钠溶液注入已查漏的容量瓶中
C.继续往容量瓶中加蒸馏水,使液面接近刻度线1-2cm处改用胶头滴管滴加蒸馏水,使液面达到刻度线
D.根据计算,用天平称取一定质量的氢氧化钠固体置于小烧杯中加入水溶解,并不断搅拌
E.盖上容量瓶的塞子,振荡,摇匀
(5)如果上述B操作中把未冷却的氢氧化钠溶液注入容量瓶中,所配溶液的浓度将___________ (填“偏高”、“偏低”或“无影响”,下同);如果上述D操作中用滤纸称量固体,所配溶液的浓度将___________ ;如果上述C操作中目光俯视,所配溶液的浓度将___________ 。
甲、乙、丙三位同学设计的制备实验方案的反应流程分别如下:
甲:NaOH溶液
 Na2CO3溶液
Na2CO3溶液乙:NaOH溶液
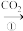 NaHCO3溶液
NaHCO3溶液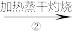 Na2CO3固体
Na2CO3固体 Na2CO3溶液
Na2CO3溶液丙:NaOH溶液
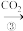 NaHCO3溶液
NaHCO3溶液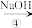 Na2CO3溶液
Na2CO3溶液请回答下列问题:
(1)
(2)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3,乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学
II、若以上所需氢氧化钠溶液需要配制成98mL1.0mol/L的溶液,回答以下问题:
(3)计算:需
(4)下列实验步骤,正确的操作顺序是:
A.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
B.把已冷却的氢氧化钠溶液注入已查漏的容量瓶中
C.继续往容量瓶中加蒸馏水,使液面接近刻度线1-2cm处改用胶头滴管滴加蒸馏水,使液面达到刻度线
D.根据计算,用天平称取一定质量的氢氧化钠固体置于小烧杯中加入水溶解,并不断搅拌
E.盖上容量瓶的塞子,振荡,摇匀
(5)如果上述B操作中把未冷却的氢氧化钠溶液注入容量瓶中,所配溶液的浓度将
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
Ⅰ.制备K2FeO4装置如图所示,夹持、加热等装置略。
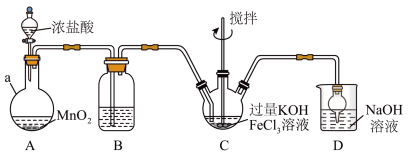
(1)A中发生反应的化学方程式为______ 。
(2)C中反应为放热反应,而反应温度需控制在0~5℃,采用的控温方法为_____ ,反应中KOH必须过量的原因是_____ 。
(3)写出C中总反应的离子方程式:______ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
(4)根据以上数据,样品中K2FeO4的质量分数为______ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______ (填“偏高”“偏低”或“无影响”)。
Ⅰ.制备K2FeO4装置如图所示,夹持、加热等装置略。

(1)A中发生反应的化学方程式为
(2)C中反应为放热反应,而反应温度需控制在0~5℃,采用的控温方法为
(3)写出C中总反应的离子方程式:
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O
 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。(4)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次



