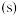解题方法
1 . 氯及其化合物在生产生活中有广泛应用。回答下列问题:
(1)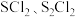 常用于硫化橡胶工业。
常用于硫化橡胶工业。
已知:① ;
;
② ;
;
③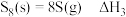 。
。
则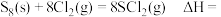
___________ (用含 的式子表示)。
的式子表示)。
(2)光气 在有机合成中常作氯化剂。工业上,可用
在有机合成中常作氯化剂。工业上,可用 和氯气混合合成光气。已知:合成
和氯气混合合成光气。已知:合成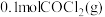 时放出
时放出 热量,写出该反应的热化学方程式:
热量,写出该反应的热化学方程式:___________ 。
(3)在恒温恒容的密闭容器中充入 和
和 ,发生反应:
,发生反应: ,下列情况表明该反应已达到平衡状态的是___________(填字母)。
,下列情况表明该反应已达到平衡状态的是___________(填字母)。
(4)硫酰氯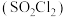 常用于有机合成。制备原理:
常用于有机合成。制备原理: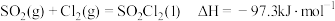 。实验测得速率方程为
。实验测得速率方程为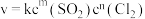 (k为速率常数,只与温度、催化剂有关,与浓度无关。m、n为反应级数,可以为整数、分数、正数、负数和0)。
(k为速率常数,只与温度、催化剂有关,与浓度无关。m、n为反应级数,可以为整数、分数、正数、负数和0)。
①为了测得反应级数,实验数据记录如下:
根据上述实验结果,计算
___________ ,
___________ 。
②已知: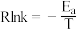 (R为常数,
(R为常数, 为活化能,T为温度)。测得
为活化能,T为温度)。测得 及在催化剂
及在催化剂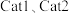 作用下随
作用下随 的变化如图所示。
的变化如图所示。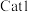 对应的活化能为
对应的活化能为___________  。催化效果:
。催化效果: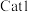
___________ (填“大于”“小于”或“等于”)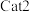 。
。
(5)我国古代采用“地康法”制备氯气: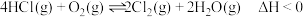 。为了探究制氯气的原理,总压强保持恒定为
。为了探究制氯气的原理,总压强保持恒定为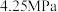 ,向密闭容器中充入
,向密闭容器中充入 和
和 ,发生上述反应,在温度
,发生上述反应,在温度 下,测得
下,测得 的平衡转化率与投料比
的平衡转化率与投料比 的关系如图所示。
的关系如图所示。
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 时平衡常数
时平衡常数
___________  (
( 是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数,结果保留两位小数)。从工业生产角度分析,投料比过大的缺点是
是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数,结果保留两位小数)。从工业生产角度分析,投料比过大的缺点是___________ 。
(1)
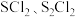 常用于硫化橡胶工业。
常用于硫化橡胶工业。已知:①
 ;
;②
 ;
;③
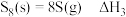 。
。则
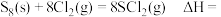
 的式子表示)。
的式子表示)。(2)光气
 在有机合成中常作氯化剂。工业上,可用
在有机合成中常作氯化剂。工业上,可用 和氯气混合合成光气。已知:合成
和氯气混合合成光气。已知:合成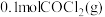 时放出
时放出 热量,写出该反应的热化学方程式:
热量,写出该反应的热化学方程式:(3)在恒温恒容的密闭容器中充入
 和
和 ,发生反应:
,发生反应: ,下列情况表明该反应已达到平衡状态的是___________(填字母)。
,下列情况表明该反应已达到平衡状态的是___________(填字母)。| A.混合气体密度不随时间变化 |
| B.气体总压强不随时间变化 |
C. 的消耗速率等于 的消耗速率等于 的生成速率 的生成速率 |
| D.Q(浓度商)不随时间变化 |
(4)硫酰氯
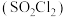 常用于有机合成。制备原理:
常用于有机合成。制备原理: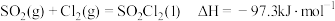 。实验测得速率方程为
。实验测得速率方程为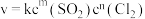 (k为速率常数,只与温度、催化剂有关,与浓度无关。m、n为反应级数,可以为整数、分数、正数、负数和0)。
(k为速率常数,只与温度、催化剂有关,与浓度无关。m、n为反应级数,可以为整数、分数、正数、负数和0)。①为了测得反应级数,实验数据记录如下:
| 序号 |  | 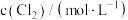 | 速率/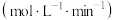 |
| a | 0.10 | 0.10 |  |
| b | 0.20 | 0.10 |  |
| c | 0.10 | 0.05 |  |


②已知:
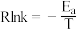 (R为常数,
(R为常数, 为活化能,T为温度)。测得
为活化能,T为温度)。测得 及在催化剂
及在催化剂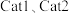 作用下随
作用下随 的变化如图所示。
的变化如图所示。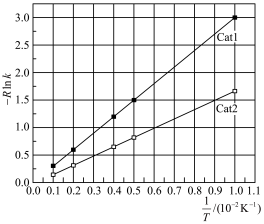
 对应的活化能为
对应的活化能为 。催化效果:
。催化效果:
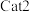 。
。(5)我国古代采用“地康法”制备氯气:
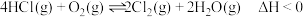 。为了探究制氯气的原理,总压强保持恒定为
。为了探究制氯气的原理,总压强保持恒定为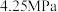 ,向密闭容器中充入
,向密闭容器中充入 和
和 ,发生上述反应,在温度
,发生上述反应,在温度 下,测得
下,测得 的平衡转化率与投料比
的平衡转化率与投料比 的关系如图所示。
的关系如图所示。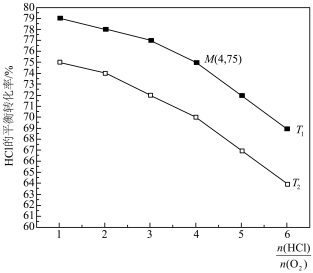

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 时平衡常数
时平衡常数
 (
( 是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数,结果保留两位小数)。从工业生产角度分析,投料比过大的缺点是
是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数,结果保留两位小数)。从工业生产角度分析,投料比过大的缺点是
您最近一年使用:0次
名校
解题方法
2 . 某温度下,在2L恒容密闭容器中投入4mol NH2COONH4发生如下反应
 有关数据如下:
有关数据如下:
下列说法错误的是

 有关数据如下:
有关数据如下:| 时间段/min | CO2的平均生成速率/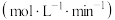 |
| 0~1 | 0.4 |
| 0~2 | 0.3 |
| 0~3 | 0.2 |
A.30s时,NH3的浓度大于 |
B.0~1min内,NH2COONH4(s)的反应速率为 |
| C.2min30s时,该反应还未达到平衡 |
| D.当CO2的体积百分数不变时,不能说明此反应达到了平衡状态 |
您最近一年使用:0次
解题方法
3 . 将4mol  (g)和2mol
(g)和2mol  (g)在2L的密闭容器中混合,并在一定条件下发生反应:
(g)在2L的密闭容器中混合,并在一定条件下发生反应:
 ,若经2s后测得
,若经2s后测得 的物质的量为0.6mol。下列叙述正确的是
的物质的量为0.6mol。下列叙述正确的是
 (g)和2mol
(g)和2mol  (g)在2L的密闭容器中混合,并在一定条件下发生反应:
(g)在2L的密闭容器中混合,并在一定条件下发生反应:
 ,若经2s后测得
,若经2s后测得 的物质的量为0.6mol。下列叙述正确的是
的物质的量为0.6mol。下列叙述正确的是A. |
B.2s时 的转化率为15% 的转化率为15% |
C.反应开始到2s时, 的物质的量浓度减小0.85 的物质的量浓度减小0.85 |
D.用 表示的平均反应速率为0.3 表示的平均反应速率为0.3 |
您最近一年使用:0次
名校
4 . 回答下列问题
(1) 时,在体积
时,在体积 的密闭容器中发生反应
的密闭容器中发生反应 ,
, 随时间的变化如下表:
随时间的变化如下表:
①如图中 点处,
点处, (正)
(正)________  (逆)(填“<”、“=”或“>”)。
(逆)(填“<”、“=”或“>”)。
②图中表示 的变化的曲线是
的变化的曲线是________ 。
③下列不能使该反应的反应速率增大的是________ 。
A.及时分离出 气体 B.适当升高温度
气体 B.适当升高温度
C.增大 的浓度 D.选择高效的催化剂
的浓度 D.选择高效的催化剂 溶液和酸性
溶液和酸性 溶液之间的反应
溶液之间的反应 来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
①通过实验 ,可探究出浓度的改变对反应速率的影响,通过实验
,可探究出浓度的改变对反应速率的影响,通过实验________ (实验序号)可探究出温度变化对化学反应速率的影响。
② 组实验中溶液褪色时间t
组实验中溶液褪色时间t________ (填“<”、“=”或“>”)8s,C组实验的反应速率
________ 。(用含有 的式子表示)
的式子表示)
③同学们在实验中发现反应速率总是如图所示,其中 时间内速率变快的主要原因可能是:①产物(
时间内速率变快的主要原因可能是:①产物( 或
或 )是反应的催化剂:②
)是反应的催化剂:②________________ 。
(1)
 时,在体积
时,在体积 的密闭容器中发生反应
的密闭容器中发生反应 ,
, 随时间的变化如下表:
随时间的变化如下表:时间 | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
 点处,
点处, (正)
(正) (逆)(填“<”、“=”或“>”)。
(逆)(填“<”、“=”或“>”)。②图中表示
 的变化的曲线是
的变化的曲线是③下列不能使该反应的反应速率增大的是
A.及时分离出
 气体 B.适当升高温度
气体 B.适当升高温度C.增大
 的浓度 D.选择高效的催化剂
的浓度 D.选择高效的催化剂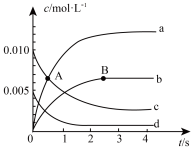
 溶液和酸性
溶液和酸性 溶液之间的反应
溶液之间的反应 来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)实验序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
|
|
| |||||
|
|
|
|
| |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
B | T1 | 2 | 0.02 | 3 | 0.1 |
| 8 |
C | 313 | 2 | 0.02 |
| 0.1 | 1 | t |
 ,可探究出浓度的改变对反应速率的影响,通过实验
,可探究出浓度的改变对反应速率的影响,通过实验②
 组实验中溶液褪色时间t
组实验中溶液褪色时间t
 的式子表示)
的式子表示)③同学们在实验中发现反应速率总是如图所示,其中
 时间内速率变快的主要原因可能是:①产物(
时间内速率变快的主要原因可能是:①产物( 或
或 )是反应的催化剂:②
)是反应的催化剂:②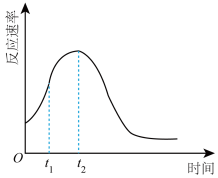
您最近一年使用:0次
5 . 已知: ,
, 温度时的平衡常数
温度时的平衡常数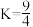 。
。 温度时,在①、②、③、④四个相同体积的恒容容器中投料,起始浓度如下表所示。下列判断
温度时,在①、②、③、④四个相同体积的恒容容器中投料,起始浓度如下表所示。下列判断不正确 的是
 ,
, 温度时的平衡常数
温度时的平衡常数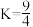 。
。 温度时,在①、②、③、④四个相同体积的恒容容器中投料,起始浓度如下表所示。下列判断
温度时,在①、②、③、④四个相同体积的恒容容器中投料,起始浓度如下表所示。下列判断| 温度 | 容器编号 | 起始浓度/ | |||
 |  |  |  | ||
 | ① | 0.1 | 0.1 | 0 | 0 |
| ② | 0.2 | 0.1 | 0 | 0 | |
| ③ | 0.1 | 0.2 | 0.1 | 0.1 | |
 | ④ | 0.04 | 0.04 | 0.06 | 0.06 |

A.容器① 达到平衡,用 达到平衡,用 表示的化学反应速率为: 表示的化学反应速率为: |
| B.容器③中反应向正反应方向进行 |
C.容器④中反应向正反应方向进行,则 |
D.已知: ,若 ,若 的状态为液态,则能量变化曲线可能为图中① 的状态为液态,则能量变化曲线可能为图中① |
您最近一年使用:0次
名校
解题方法
6 . 可逆反应 在不同条件下的反应速率最大的是
在不同条件下的反应速率最大的是
 在不同条件下的反应速率最大的是
在不同条件下的反应速率最大的是A.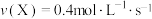 | B. |
C.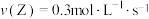 | D. |
您最近一年使用:0次
名校
解题方法
7 . 对于可逆反应 ,在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
,在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
 ,在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
,在不同条件下的化学反应速率如下,其中表示的反应速率最快的是A.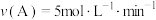 | B. |
C.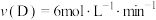 | D. |
您最近一年使用:0次
名校
8 . 为了研究碳酸钙与盐酸反应的反应速率,某同学通过实验测定足量碳酸钙固体与一定量稀盐酸反应生成 的体积(已换算为标况下的体积)随时间的变化情况,绘制出如图所示的曲线甲。下列有关说法中
的体积(已换算为标况下的体积)随时间的变化情况,绘制出如图所示的曲线甲。下列有关说法中不正确 的是
 的体积(已换算为标况下的体积)随时间的变化情况,绘制出如图所示的曲线甲。下列有关说法中
的体积(已换算为标况下的体积)随时间的变化情况,绘制出如图所示的曲线甲。下列有关说法中
A.因反应放热,导致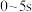 内的反应速率逐渐增大 内的反应速率逐渐增大 |
B. 后,影响反应速率的主要外界因素是盐酸的浓度 后,影响反应速率的主要外界因素是盐酸的浓度 |
C. 内,用盐酸的浓度变化表示该反应的速率为 内,用盐酸的浓度变化表示该反应的速率为 |
| D.若向反应体系中加入适量氯化钠溶液,则曲线甲可能将变成曲线乙 |
您最近一年使用:0次
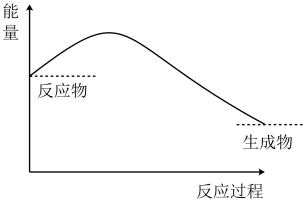
9 . Ⅰ.锌片与稀硫酸反应的能量变化特征如图所示,回答下列问题。___________ 反应(填“吸热”或“放热”)。
(2)锌片和铜片用导线相连后,若将锌片和铜片浸泡在稀硫酸溶液中,可观察到铜片处的现象___________ 。
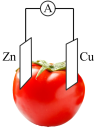
Ⅱ.以相同大小铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
(3)该实验目的是研究水果种类和___________ 对水果电池电流大小的影响。
(4)该实验装置中,正极的材料是___________ ,负极的电极反应式是___________ 。
(5)当有 参与反应,转移的电子数目为
参与反应,转移的电子数目为___________ 。
Ⅲ.某温度下,体积为 恒容密闭容器中,X、Y两种气体参与反应,物质的量随时间的变化曲线如图所示。请回答下列问题:
恒容密闭容器中,X、Y两种气体参与反应,物质的量随时间的变化曲线如图所示。请回答下列问题:___________ 。
(7)在 内,用Y表示的反应速率为
内,用Y表示的反应速率为___________ 。
(2)锌片和铜片用导线相连后,若将锌片和铜片浸泡在稀硫酸溶液中,可观察到铜片处的现象
Ⅱ.以相同大小铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
| 实验编号 | 水果种类 | 电极间距离/cm | 电流 |
|
| 1 | 番茄 | 1 | 98.7 | |
| 2 | 番茄 | 2 | 72.5 | |
| 3 | 苹果 | 2 | 27.2 |
(3)该实验目的是研究水果种类和
(4)该实验装置中,正极的材料是
(5)当有
 参与反应,转移的电子数目为
参与反应,转移的电子数目为Ⅲ.某温度下,体积为
 恒容密闭容器中,X、Y两种气体参与反应,物质的量随时间的变化曲线如图所示。请回答下列问题:
恒容密闭容器中,X、Y两种气体参与反应,物质的量随时间的变化曲线如图所示。请回答下列问题: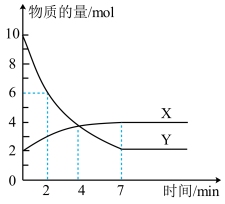
(7)在
 内,用Y表示的反应速率为
内,用Y表示的反应速率为
您最近一年使用:0次
2024·黑龙江吉林·模拟预测
解题方法
10 . 工业上以1,4-丁二醇(BD)为原料催化脱氢制备γ-丁内酯(BL),其副反应产物为四氢呋喃( ,THF)、正丁醇(BuOH)以及其他四碳有机物。其他条件相同时,不同温度下,向1L容器中通入4×10-2molBD反应2h,测得BL、THF、BuOH在四碳有机产物中的物质的量分数如表:
,THF)、正丁醇(BuOH)以及其他四碳有机物。其他条件相同时,不同温度下,向1L容器中通入4×10-2molBD反应2h,测得BL、THF、BuOH在四碳有机产物中的物质的量分数如表:
| 温度/℃ | 220 | 240 | 250 | 255 |
| BL/% | 60.2 | 84.6 | 92.6 | 95.2 |
| THF/% | 1.2 | 1.8 | 1.9 | 2.1 |
| BuOH/% | 0.2 | 0.3 | 0.4 | 0.6 |
已知:HO(CH2)4OH(g,BD)
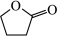 (g,BL)+2H2(g) △H>0
(g,BL)+2H2(g) △H>0
| A.255℃,2h时n(BL)=1.5×10-2mol,则0~2h内v(H2)主反应=1.5×10-2mol•L-1•h-1 |
| B.250℃,2h时n(BD)+n(BL)+n(THF)+n(BuOH)=4×10-2mol |
| C.220℃,2h时n(BL)=9.03×10-3mol,则BD的总转化率为37.5% |
| D.由表中数据可知:220~255℃,BL的选择性随着温度的升高而提高 |
您最近一年使用:0次