1 . 为研究“影响金属与盐酸反应剧烈程度的因素”,某兴趣小组进行如下探究。
(1)【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出假设】I、可能与金属本身的性质有关:
Ⅱ、可能与盐酸的浓度有关:
Ⅲ、___________ (请你填写一个合理的猜想)。
(2)【实验探究】实验所用金属均已用砂纸打磨。
实验①:为探究猜想I,小李同学分别在两支试管中放入相同质量的锌粒和铁片,然后分别加入同体积同浓度的稀盐酸,观察到放锌粒的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,由此得出结论,金属活动性:Zn>Fe.你认为上述方案是否合理___________ (填“合理”或“不合理”),理由是___________ 。

实验②:为探究猜想Ⅱ,小刘同学利用上列图甲装置进行对照实验,将等质量且过量的锌粒分别与等体积、浓度分别为5%、15%的稀盐酸反应。其中注射器的作用是___________ ,该装置气密性的检查方法是___________ 。(填A或B)
A.打开分液漏斗活塞,拉动注射器活塞一段距离,锥形瓶的水中有气泡产生,说明气密性完好。
B.关闭分液漏斗活塞,推动(或拉动)注射器活塞一段距离,松手后又回到原来位置,说明气密性完好。
实验③:小刘同学还用压强传感器替换注射器进行数字化实验,测得两次实验压强随时间的变化关系曲线如图乙所示。请你根据该图中信息写出1条合理结论:___________ 。
(1)【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出假设】I、可能与金属本身的性质有关:
Ⅱ、可能与盐酸的浓度有关:
Ⅲ、
(2)【实验探究】实验所用金属均已用砂纸打磨。
实验①:为探究猜想I,小李同学分别在两支试管中放入相同质量的锌粒和铁片,然后分别加入同体积同浓度的稀盐酸,观察到放锌粒的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,由此得出结论,金属活动性:Zn>Fe.你认为上述方案是否合理

实验②:为探究猜想Ⅱ,小刘同学利用上列图甲装置进行对照实验,将等质量且过量的锌粒分别与等体积、浓度分别为5%、15%的稀盐酸反应。其中注射器的作用是
A.打开分液漏斗活塞,拉动注射器活塞一段距离,锥形瓶的水中有气泡产生,说明气密性完好。
B.关闭分液漏斗活塞,推动(或拉动)注射器活塞一段距离,松手后又回到原来位置,说明气密性完好。
实验③:小刘同学还用压强传感器替换注射器进行数字化实验,测得两次实验压强随时间的变化关系曲线如图乙所示。请你根据该图中信息写出1条合理结论:
您最近一年使用:0次
2 . 丙醛是一种重要的有机原料,在许多领域都有广泛的应用。在铑催化剂作用下,乙烯羰基合成丙醛涉及的反应如下:
主反应Ⅰ.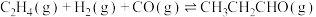

副反应Ⅱ.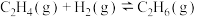

(1)
_____ 0 (填:“>”或“<)。
(2)保持温度不变,在恒容反应器中,按照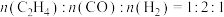 投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时
投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时 的转化率为80%,
的转化率为80%, 的选择性为25%,则
的选择性为25%,则 的转化率为
的转化率为______ %,
_____ kPa/min,反应Ⅰ的
_____  。(用含p的代数式表示,
。(用含p的代数式表示, 的选择性=
的选择性= )。
)。
(3)在装有相同催化剂的。相同恒压容器中,按照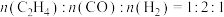 投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下
投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下 的转化率(
的转化率( )如图所示。则B、D两点的平均反应速率v(B)
)如图所示。则B、D两点的平均反应速率v(B)_____ v(D)(填“>”、“=”、“<”),产生这一结果的原因可能是______ 。
(4)T℃时,向恒温恒容的甲容器中,通入1mol 、1mol CO和2mol
、1mol CO和2mol  ;向绝热恒容的乙容器中通入1mol
;向绝热恒容的乙容器中通入1mol  、1mol CO、2mol
、1mol CO、2mol  ,若只发生上述反应Ⅰ。则甲乙容器中
,若只发生上述反应Ⅰ。则甲乙容器中 的平衡转化率
的平衡转化率
____  (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是_____ 。
主反应Ⅰ.
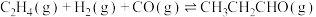

副反应Ⅱ.
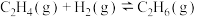


(1)

(2)保持温度不变,在恒容反应器中,按照
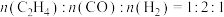 投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时
投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时 的转化率为80%,
的转化率为80%, 的选择性为25%,则
的选择性为25%,则 的转化率为
的转化率为

 。(用含p的代数式表示,
。(用含p的代数式表示, 的选择性=
的选择性= )。
)。(3)在装有相同催化剂的。相同恒压容器中,按照
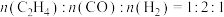 投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下
投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下 的转化率(
的转化率( )如图所示。则B、D两点的平均反应速率v(B)
)如图所示。则B、D两点的平均反应速率v(B)(4)T℃时,向恒温恒容的甲容器中,通入1mol
 、1mol CO和2mol
、1mol CO和2mol  ;向绝热恒容的乙容器中通入1mol
;向绝热恒容的乙容器中通入1mol  、1mol CO、2mol
、1mol CO、2mol  ,若只发生上述反应Ⅰ。则甲乙容器中
,若只发生上述反应Ⅰ。则甲乙容器中 的平衡转化率
的平衡转化率
 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是
您最近一年使用:0次
解题方法
3 . 红矾钠(重铬酸钠: )是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿(
)是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿( ,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题:
,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题: 转化为
转化为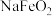 和
和 。
。
②“浸取”时铁元素以 形式存在。
形式存在。
(1)写出“焙烧”时 被氧化的化学方程式:
被氧化的化学方程式:_______ 。
(2)为了加快浸取速率可采取的措施有_______ (请写出两种方法)。
(3)矿物中相关元素可溶性组分的物质的量浓度c与pH的关系如图所示。当溶液中可溶性组分的浓度 时认为已除尽。
时认为已除尽。_______ ,滤渣的主要成分有_______ 。
(4)“酸化”时,不可以将硫酸改为盐酸(HCl),原因是(用离子方程式表示)_______ 。
(5)“冷却结晶”所得母液中,除 外,可在上述流程中循环利用的物质还有
外,可在上述流程中循环利用的物质还有_______ (用化学式表示)。
(6) 的三种结构:①
的三种结构:①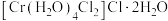 、②
、②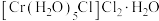 、③
、③ ,下列说法错误的是_______。
,下列说法错误的是_______。
 )是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿(
)是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿( ,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题:
,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题: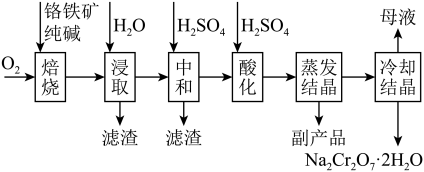
 转化为
转化为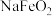 和
和 。
。②“浸取”时铁元素以
 形式存在。
形式存在。(1)写出“焙烧”时
 被氧化的化学方程式:
被氧化的化学方程式:(2)为了加快浸取速率可采取的措施有
(3)矿物中相关元素可溶性组分的物质的量浓度c与pH的关系如图所示。当溶液中可溶性组分的浓度
 时认为已除尽。
时认为已除尽。
(4)“酸化”时,不可以将硫酸改为盐酸(HCl),原因是(用离子方程式表示)
(5)“冷却结晶”所得母液中,除
 外,可在上述流程中循环利用的物质还有
外,可在上述流程中循环利用的物质还有(6)
 的三种结构:①
的三种结构:①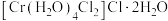 、②
、②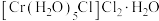 、③
、③ ,下列说法错误的是_______。
,下列说法错误的是_______。A.①中配合离子空间结构为 或 或 (已略去位于正八面体中心的 (已略去位于正八面体中心的 ) ) |
B.②③中 的配位数都是6 的配位数都是6 |
| C.②中存在的作用力有离子键、共价键、配位键和氢键等 |
D.等物质的量浓度、等体积的①②③溶液中, 的物质的量相等 的物质的量相等 |
您最近一年使用:0次
名校
解题方法
4 . 含氮物质是一类常见物质,在人们的生产、生活活动中有重要作用。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。_______ ,收集N2的方法是_______ (填标号)。
②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
③V1=_______ ,V3=_______ 。
④已知该反应的速率方程为 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=_______ (填整数)。
(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:_______ ←d(填接口序号);由该装置可知,该实验中制备NH3需用到的试剂是_______ (填化学式)。
(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
④实验现象及分析
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是_______ (写出离子方程式);
ii.实验6观察到_______ (填实验现象),证明溶液呈棕色是因为存在[Fe(NO)]2+,且其颜色掩盖了Fe3+的黄色。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。

②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
| 实验编号 | 溶液体积/mL | 收集1.0mLN2所用时间/s | |||
| NaNO2溶液 | NH4Cl溶液 | 醋酸 | 水 | ||
| 1 | 4.0 | 4.0 | 4.0 | 8.0 | 334 |
| 2 | V1 | 4.0 | 4.0 | V3 | 150 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 83 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
④已知该反应的速率方程为
 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:

(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
| 实验编号 | 5 | 6 |
| 操作方法 | 取上述滴有NaNO2溶液的棕色混合液,向其中滴加稀KSCN溶液 | 取上述棕色混合液,按下图所示加热
|
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是
ii.实验6观察到
您最近一年使用:0次
解题方法
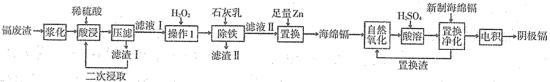
5 . 镉(Cd)是炼锌业的副产品,主要用在电池、染料稳定剂,同时也是重要的污染源,回收再利用以减少排放是重要课题。某冶炼厂的镉废渣中主要含有Cd、CdO,还含有Cu、Zn、Pb、Fe、CuO和SiO2等杂质,从镉废渣中回收镉的一种工艺流程如图所示。
②溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)将废渣先“浆化”再“酸浸”的目的是___________ 。
(2)“压滤”所得滤渣I的主要成分是___________ (填化学式);“酸浸”后滤液中还含有微量的Pb2+,其微量存在的主要原因是___________ 。
(3)“除铁”时,加入的石灰乳调节溶液pH的范围是___________ ,若石灰乳加过量,缺陷是___________ 。
(4)将“置换”出来的海绵镉在空气中堆放反复搅拌进行“自然氧化”,再用硫酸进行“酸溶”,“置换净化”处理是将残余的微量的Cu2+和Pb2+进行深度脱除,以提高阴极镉产品的纯度,写出“置换净化”除Pb2+的离子反应方程式___________ 。
(5)电极电位是表示某种离子或原子在溶液中得失电子的难易程度。在25℃下,部分电对的电极电位如表所示。
根据表中信息和已有知识可知,采用低电流条件“电积”时,阴极主要得到的是镉不是锌的原因___________ 。

②溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 离子 |  |  |  |  |  |  |
开始沉淀时( ) ) | 8.2 | 7.8 | 7.5 | 6.7 | 5.2 | 2.2 |
完全沉淀时( ) ) | 9.7 | 9.3 | 9.0 | 8.5 | 6.7 | 3.2 |
(1)将废渣先“浆化”再“酸浸”的目的是
(2)“压滤”所得滤渣I的主要成分是
(3)“除铁”时,加入的石灰乳调节溶液pH的范围是
(4)将“置换”出来的海绵镉在空气中堆放反复搅拌进行“自然氧化”,再用硫酸进行“酸溶”,“置换净化”处理是将残余的微量的Cu2+和Pb2+进行深度脱除,以提高阴极镉产品的纯度,写出“置换净化”除Pb2+的离子反应方程式
(5)电极电位是表示某种离子或原子在溶液中得失电子的难易程度。在25℃下,部分电对的电极电位如表所示。
| 电对 |  | 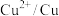 | 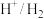 | 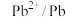 |
| 电极电位/V |  | 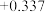 | 0 | 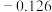 |
| 电对 | 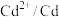 | 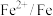 | 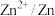 | 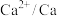 |
| 电极电位/V | 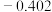 |  | 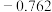 | 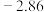 |
您最近一年使用:0次
名校
解题方法
6 . 我国最新型055型万吨驱逐舰上使用了最新一代国产有源相控阵雷达,采用了最先进的氮化镓( )半导体技术。某工厂利用铝土矿(主要成分为
)半导体技术。某工厂利用铝土矿(主要成分为 、
、 、
、 )为原料制备
)为原料制备 的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应,
的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应, 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是
 )半导体技术。某工厂利用铝土矿(主要成分为
)半导体技术。某工厂利用铝土矿(主要成分为 、
、 、
、 )为原料制备
)为原料制备 的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应,
的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应, 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是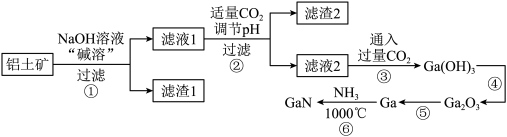
| A.可以通过粉碎铝土矿、搅拌等方法提高“碱溶”效率 |
B.由过程②、③可知,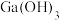 的酸性比 的酸性比 强 强 |
C.已知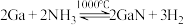 , , 与足量 与足量 反应,转移电子数为 反应,转移电子数为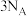 |
D.滤渣1是 ,生成滤渣2的离子方程式可能为 ,生成滤渣2的离子方程式可能为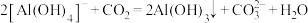 |
您最近一年使用:0次
2024-05-12更新
|
173次组卷
|
2卷引用:安徽师范大学附属中学2024届高三下学期5月测试化学试卷
名校
解题方法
7 . 为了探究温度和浓度对化学反应速率的影响,某同学设计了如下实验:在一张白纸上用黑色记号笔在合适的位置画上三个粗细、深浅一致的“十”字,分别在“十”字上放锥形瓶;按照表格中的试剂和条件进行反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,随着反应的进行,锥形瓶底部的“十”字会被遮盖。下列说法错误的是
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 硫酸 | H2O | ||
| V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
| Ⅰ | 20 | 10.0 | 0.10 | 10.0 | 0.10 | 0 |
| Ⅱ | 20 | 5.0 | 0.10 | 10.0 | 0.10 | V1 |
| Ⅲ | 40 | 10.0 | 0.10 | 10.0 | 0.10 | V2 |
| A.V1=0,V2=5.0 |
| B.实验还需要秒表,用于测定锥形瓶底部的“十”字完全被遮盖所需的时间 |
C.锥形瓶内发生反应的离子方程式 +2H+= SO2↑+S↓+H2O +2H+= SO2↑+S↓+H2O |
| D.进行实验Ⅲ时,应分别将Na2S2O3溶液和硫酸加热至40℃,然后在锥形瓶内混合 |
您最近一年使用:0次
名校
解题方法
8 . 乙烯(CH2=CH2)是非常重要的化工基础原料,由乙烯可以制备很多有机物。
I.在恒温1L的刚性密闭容器中,加入1mol乙烯和1mol水,发生CH2=CH2(g)+H2O(g) CH3-CH2-OH(g)。乙醇的物质的量与反应时间的关系如下图:
CH3-CH2-OH(g)。乙醇的物质的量与反应时间的关系如下图:
(1)计算在0-6min内的反应速率v(H2O)=___________ mol·L-1·min-1。
(2)8min时反应达到化学平衡状态,其理由是:___________ 。
Ⅱ.在恒温1L的刚性密闭容器中,加入1mol乙烯和1mol氢气,发生CH2=CH2(g)+H2(g) CH3CH3(g),容器内气体的压强与反应时间的关系如下图:
CH3CH3(g),容器内气体的压强与反应时间的关系如下图:
(3)下列措施能增大反应速率的是___________(填字母)。
(4)达到化学平衡状态时,下列数值与开始时相同的是___________(填序号)
(5)反应进行到10min时,乙烯(CH2=CH2)的转化率a%=___________ 。
I.在恒温1L的刚性密闭容器中,加入1mol乙烯和1mol水,发生CH2=CH2(g)+H2O(g)
 CH3-CH2-OH(g)。乙醇的物质的量与反应时间的关系如下图:
CH3-CH2-OH(g)。乙醇的物质的量与反应时间的关系如下图:| 时间(min) | 0 | 2 | 4 | 6 | 8 | 10 |
| 乙醇的物质的量(mol) | 0 | 0.3 | 0.5 | 0.6 | 0.65 | 0.65 |
(2)8min时反应达到化学平衡状态,其理由是:
Ⅱ.在恒温1L的刚性密闭容器中,加入1mol乙烯和1mol氢气,发生CH2=CH2(g)+H2(g)
 CH3CH3(g),容器内气体的压强与反应时间的关系如下图:
CH3CH3(g),容器内气体的压强与反应时间的关系如下图:| 时间(min) | 0 | 2 | 4 | 6 | 8 | 10 |
| 气体压强(MPa) | 100 | 80 | 70 | 65 | 60 | 60 |
| A.升高温度 |
| B.降低压强 |
| C.减小CH3CH3的浓度 |
| D.加入合适的催化剂 |
| A.容器内气体的压强 |
| B.容器内n(H2) |
| C.容器内c(CH2=CH2) |
| D.容器内气体的总质量 |
您最近一年使用:0次
名校
9 . 已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O。某化学小组欲探究H2C2O4溶液和酸性KMnO4溶液反应过程中浓度、温度对化学反应速率的影响,进行了如下实验(忽略混合时溶液体积变化):
下列说法不正确的是
| 编号 | 0.01mol·L-1酸性KMnO4溶液体积/mL | 0.1mol·L-1H2C2O4溶液体积/mL | 水的体积/mL | 反应温度/℃ | 反应时间/min |
| Ⅰ | 2 | 2 | 0 | 20 | 2.1 |
| Ⅱ | V1 | 2 | 1 | 20 | 5.5 |
| Ⅲ | V2 | 2 | 0 | 50 | 0.5 |
| A.V1=1,V2=2 |
| B.实验计时是从溶液混合开始,溶液呈紫红色时结束 |
| C.设计实验Ⅰ、Ⅲ的目的是探究温度对反应速率的影响 |
| D.实验Ⅲ中用酸性KMnO4溶液的浓度变化表示的反应速率v(KMnO4)=0.02mol·L-1·min-1 |
您最近一年使用:0次
解题方法
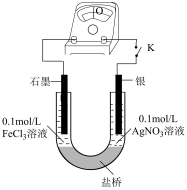
10 . (一)某研究性学习小组为探究 Fe3+与 Ag 反应,进行如下实验:按下图连接装置并加入药品(盐桥中的物质不参与反应)。_______________ (填“正极”或“负极”)。
(2)盐桥中装有含有 KNO3饱和溶液的琼脂,K 闭合时,K+移向_______________ 溶液。
(3)结合上述实验,写出本原电池装置的负极反应:_______________ 。
(二)某研究性学习小组利用草酸(H2C2O4)溶液和酸性 KMnO4溶液之间的反应
来探究“外界条件改变对化学反应速率的影响”,实验设计如下:(假设溶液混合
时体积可以加和)
(4)写出草酸与酸性 KMnO4溶液反应的离子方程式:_______ 。
(5)乙同学欲通过实验①、②探究反应物浓度对该反应速率的影响,则a=_______ ,T=_______ 。若 t1<8 s,可以得出的结论是:_______ 。
(6)通过比较实验②、③的结果,可以探究_______ 变化对化学反应速率的影响。
(2)盐桥中装有含有 KNO3饱和溶液的琼脂,K 闭合时,K+移向
(3)结合上述实验,写出本原电池装置的负极反应:
(二)某研究性学习小组利用草酸(H2C2O4)溶液和酸性 KMnO4溶液之间的反应
来探究“外界条件改变对化学反应速率的影响”,实验设计如下:(假设溶液混合
时体积可以加和)
| 实验序号 | 实验温度(K) | 酸性KMnO4溶液 | 草酸溶液 | 蒸馏水 | 褪色时间 | ||
| c(mol/L) | V(mL) | c(mol/L) | V(mL) | V(mL) | t(s) | ||
| ① | 298 | 0.02 | 2.0 | 0.10 | 4.0 | 0 | t1 |
| ② | T | 0.02 | 2.0 | 0.10 | 3.0 | a | 8.0 |
| ③ | 343 | 0.02 | 2.0 | 0.10 | 3.0 | a | t2 |
| ④ | 373 | 0.02 | 2.0 | 0.10 | 3.0 | a | t3 |
(4)写出草酸与酸性 KMnO4溶液反应的离子方程式:
(5)乙同学欲通过实验①、②探究反应物浓度对该反应速率的影响,则a=
(6)通过比较实验②、③的结果,可以探究
您最近一年使用:0次




