1 . 一定条件下在容积不变的容器中充入 和
和 发生如下反应:
发生如下反应: ,其他条件不变时,分别探究温度和催化剂的比表面积对上述反应的影响。实验测得
,其他条件不变时,分别探究温度和催化剂的比表面积对上述反应的影响。实验测得 与时间的关系如图所示。已知:
与时间的关系如图所示。已知:

ⅰ.起始投料比 均为2:3;
均为2:3;
ⅱ.比表面积:单位质量的物质具有的总面积。
下列说法不正确的是
 和
和 发生如下反应:
发生如下反应: ,其他条件不变时,分别探究温度和催化剂的比表面积对上述反应的影响。实验测得
,其他条件不变时,分别探究温度和催化剂的比表面积对上述反应的影响。实验测得 与时间的关系如图所示。已知:
与时间的关系如图所示。已知:
ⅰ.起始投料比
 均为2:3;
均为2:3;ⅱ.比表面积:单位质量的物质具有的总面积。
下列说法不正确的是
| A.Ⅰ、Ⅱ曲线证明催化剂比表面积对上述反应有影响 |
B.Ⅱ中 的平衡转化率为50% 的平衡转化率为50% |
C.在Ⅲ的条件下,该反应的平衡常数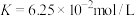 |
D. min,Ⅲ中平均反应速率 min,Ⅲ中平均反应速率 |
您最近一年使用:0次
解题方法
2 . 为证明 形成络离子(络合物)可促使铜与酸置换出氢气反应的发生,进行下列实验。已知
形成络离子(络合物)可促使铜与酸置换出氢气反应的发生,进行下列实验。已知 能与
能与 形成络离子
形成络离子 ,与双硫腙(
,与双硫腙(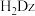 ,二元弱酸)形成络合物
,二元弱酸)形成络合物 ,与
,与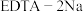 (用
(用 表示,忽略其电离出的
表示,忽略其电离出的 )形成络合物
)形成络合物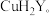 。
。
下列有关说法错误的是
 形成络离子(络合物)可促使铜与酸置换出氢气反应的发生,进行下列实验。已知
形成络离子(络合物)可促使铜与酸置换出氢气反应的发生,进行下列实验。已知 能与
能与 形成络离子
形成络离子 ,与双硫腙(
,与双硫腙(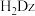 ,二元弱酸)形成络合物
,二元弱酸)形成络合物 ,与
,与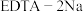 (用
(用 表示,忽略其电离出的
表示,忽略其电离出的 )形成络合物
)形成络合物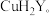 。
。编号 | 8 | 铜粉 | 加入某种物质 | 实验现象 |
I | 10 | 6.4g | 无 | 无现象 |
II | 10 | 6.4g | 0.1 | 有气泡 |
III | 10 | 6.4g | 0.2 | 有气泡,比实验II密集 |
IV | 10 | 6.4g | 0.224L | ___________________ |
| A.实验I作对照组 |
| B.实验IV中无气泡产生 |
C.实验III比实验II气泡密集的原因可能是实验III中 的浓度比实验II中的大 的浓度比实验II中的大 |
| D.实验I和实验II、实验I和实验III均能证明形成络合物可促进铜与酸的反应 |
您最近一年使用:0次
3 . 一定条件下, 可催化
可催化 在水中发生反应,过程分为两步
在水中发生反应,过程分为两步
i.
ⅱ.
某小组设计以下实验探究上述反应速率的影响因素(如图),
已知:(1)试管①中是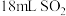 的稀溶液;②③④中是
的稀溶液;②③④中是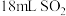 的饱和溶液
的饱和溶液
(2)四组实验中溶液出现混浊所用时间:①>②>③>④

下列说法错误的是
 可催化
可催化 在水中发生反应,过程分为两步
在水中发生反应,过程分为两步i.

ⅱ.

某小组设计以下实验探究上述反应速率的影响因素(如图),
已知:(1)试管①中是
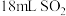 的稀溶液;②③④中是
的稀溶液;②③④中是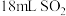 的饱和溶液
的饱和溶液(2)四组实验中溶液出现混浊所用时间:①>②>③>④

下列说法错误的是
A.通过实验①②可探究 的浓度对反应速率的影响 的浓度对反应速率的影响 |
B.实验①③可证明酸性条件下 的催化效果更好 的催化效果更好 |
C.实验④开始加入 ,发生反应ⅱ生成 ,发生反应ⅱ生成 和 和 ,加快了反应速率 ,加快了反应速率 |
D.总反应为: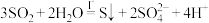 |
您最近一年使用:0次
名校
4 . 某实验小组利用下图装置探究H2C2O4溶液与酸性KMnO4溶液的反应(夹持装置略去)。

查阅资料:①H2C2O4为二元弱酸。
②溶液浓度越大,越不利于气体的扩散。
(1)H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为___________ 。
(2)仪器A的名称为___________ 。
(3)检查装置气密性的方法为___________ 。
(4)若以单位时间内生成的气体体积作为反应速率的观测指标,则量筒中的试剂为___________。
(5)探究H2C2O4溶液与酸性KMnO4溶液的浓度对反应速率的影响,实验数据如下表所示:
①c1=___________ 。
②某同学从实验1和2的褪色时间分析出实验2的反应速率小于实验1,请分析该结论是否正确,并说明原因:___________ 。
③结合实验数据,下列说法错误的是___________ 。(填标号)
A.其他条件不变时,c(H2C2O4)浓度越高,反应速率越快
B.其他条件不变时,当c(H2C2O4)为0.8mol·L-1,褪色时间一定介于163s至360s之间
C.实验5中v(H2C2O4)=0.15mol·L-1·min-1
D.其他条件不变时,当c(H2C2O4)>0.9mol·L-1,溶液浓度增大,不利于CO2扩散,可能导致褪色时间延长
(6)H2C2O4溶液与酸性KMnO4溶液生成的Mn2+对该反应有催化作用。请以实验1为对照组,设计实验方案证明Mn2+的催化作用___________ 。

查阅资料:①H2C2O4为二元弱酸。
②溶液浓度越大,越不利于气体的扩散。
(1)H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为
(2)仪器A的名称为
(3)检查装置气密性的方法为
(4)若以单位时间内生成的气体体积作为反应速率的观测指标,则量筒中的试剂为___________。
| A.饱和NaHCO3溶液 | B.饱和NaCl溶液 | C.水 | D.饱和Na2CO3溶液 |
| 实验 序号 | KMnO4溶液 | H2C2O4溶液 | H2SO4溶液 | 褪色时间 | ||
| c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | t/s | |
| 1 | 0.005 | 4.0 | 0.2 | 2.0 | 0.120 | 307 |
| 2 | 0.020 | 4.0 | 0.2 | 2.0 | 0.120 | 545 |
| 3 | 0.010 | 4.0 | 0.5 | 2.0 | 0.120 | 201 |
| 4 | 0.010 | 4.0 | 0.7 | 2.0 | 0.120 | 163 |
| 5 | 0.010 | 4.0 | 0.9 | 2.0 | 0.120 | 360 |
| 6 | 0.010 | 4.0 | 1.0 | 2.0 | c1 | 512 |
②某同学从实验1和2的褪色时间分析出实验2的反应速率小于实验1,请分析该结论是否正确,并说明原因:
③结合实验数据,下列说法错误的是
A.其他条件不变时,c(H2C2O4)浓度越高,反应速率越快
B.其他条件不变时,当c(H2C2O4)为0.8mol·L-1,褪色时间一定介于163s至360s之间
C.实验5中v(H2C2O4)=0.15mol·L-1·min-1
D.其他条件不变时,当c(H2C2O4)>0.9mol·L-1,溶液浓度增大,不利于CO2扩散,可能导致褪色时间延长
(6)H2C2O4溶液与酸性KMnO4溶液生成的Mn2+对该反应有催化作用。请以实验1为对照组,设计实验方案证明Mn2+的催化作用
您最近一年使用:0次
2023-07-12更新
|
344次组卷
|
2卷引用:福建省厦门市2022-2023学年高一下学期期末考试化学试题
名校
5 . 某学习小组为了探究影响高锰酸钾酸性溶液与NaHSO3溶液反应速率的因素,该小组设计如表实验方案。
下列说法不正确的是
| 实验 | V(NaHSO3)/mL c=0.2mol·L-1 | V(KMnO4)/mL c=0.1mol·L-1 | V(H2SO4)/mL c=0.6mol·L-1 | V(MnSO4)/mL c=0.1mol·L-1 | V(H2O)mL | 褪色时间 t/min |
| 1 | 3.0 | 2.0 | 1.0 | 0.0 | 2.0 | 8 |
| 2 | 3.0 | 2.0 | 2.0 | 0.0 | a | 6 |
| 3 | 4.0 | 2.0 | 2.0 | 0.0 | 0.0 | 4 |
| 4 | 3.0 | 2.0 | 1.0 | 0.5 | b | 3 |
| A.a=1.0,b=1.5 |
| B.实验3从反应开始到反应结束这段时间内反应速率v(MnO4‑)=0.00625mol/(L。min) |
| C.实验证明MnSO4可能是该反应的催化剂 |
D.该反应的离子方程式为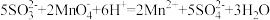 |
您最近一年使用:0次
19-20高三·浙江·阶段练习
名校
解题方法
6 . 用Na2FeO4溶液氧化废水中的还原性污染物M,为研究其降解效果,设计如图对比实验探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度变化与时间的关系如图所示,下列说法不正确的是
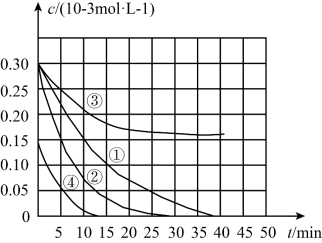

| 实验编号 | 温度/K | pH |
| ① | 298 | 1 |
| ② | 310 | 1 |
| ③ | 298 | 7 |
| ④ | 298 | 1 |
| A.实验①在0~15min内M的降解速率为1.33×10-5mol•L-1•min-1 |
| B.若其他条件相同,实验①②说明升高温度,M降解速率增大 |
| C.若其他条件相同,实验①③证明pH越高,越不利于M的降解 |
| D.若其他条件相同,实验①④说明M的浓度越小,降解的速率越快 |
您最近一年使用:0次
2021-06-06更新
|
317次组卷
|
6卷引用:【浙江新东方】53.
(已下线)【浙江新东方】53.(苏教版2019)必修第二册专题6 化学反应与能量变化 B 素养拓展区(已下线)专题2.1.2 影响化学反应速率的因素(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)2.1.2 影响化学反应速率的因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第七章 化学反应速率与化学平衡 热点强化13 控制变量探究影响化学反应速率的因素河北省保定市唐县第一中学2022-2023学年高一下学期5月月考化学试题
解题方法
7 . 将浓度均为 的
的 、
、 、
、 、
、 溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
资料:该“碘钟实验”的总反应为 。反应分A、B两步进行。
。反应分A、B两步进行。
反应A: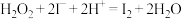 ;
;
反应B:……
(1)反应B的离子方程式是___________ 。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的 溶液中加入
溶液中加入 溶液和试剂X,溶液变为蓝色。
溶液和试剂X,溶液变为蓝色。
b.再向得到的蓝色溶液中加入 溶液,溶液的蓝色褪去。
溶液,溶液的蓝色褪去。
试剂X是___________ 。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ(溶液浓度均为 )
)
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是 ,实验Ⅲ是
,实验Ⅲ是 。
。
①实验Ⅲ中x、y、z,所对应的数值分别是___________ 、___________ 、___________ 。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是___________ 。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验IV。(溶液浓度均为 )
)
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验IV未产生颜色变化的原因:___________ 。
 的
的 、
、 、
、 、
、 溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。资料:该“碘钟实验”的总反应为
 。反应分A、B两步进行。
。反应分A、B两步进行。反应A:
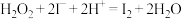 ;
;反应B:……
(1)反应B的离子方程式是
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的
 溶液中加入
溶液中加入 溶液和试剂X,溶液变为蓝色。
溶液和试剂X,溶液变为蓝色。b.再向得到的蓝色溶液中加入
 溶液,溶液的蓝色褪去。
溶液,溶液的蓝色褪去。试剂X是
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ(溶液浓度均为
 )
)| 用量/mL 实验序号 |  溶液 溶液 |  溶液 溶液 |  溶液 溶液 | KI溶液 (含淀粉) |  |
| 实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
| 实验Ⅲ | 5 | 2 |  |  |  |
 ,实验Ⅲ是
,实验Ⅲ是 。
。①实验Ⅲ中x、y、z,所对应的数值分别是
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是
(4)为探究其他因素对该“碘钟实验”的影响,进行实验IV。(溶液浓度均为
 )
)| 用量/mL 实验序号 |  溶液 溶液 |  溶液 溶液 |  溶液 溶液 | KI溶液(含淀粉) |  |
| 实脸IV | 4 | 4 | 9 | 3 | 0 |
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验IV未产生颜色变化的原因:
您最近一年使用:0次
名校
解题方法
8 . 含氮物质是一类常见物质,在人们的生产、生活活动中有重要作用。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。_______ ,收集N2的方法是_______ (填标号)。
②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
③V1=_______ ,V3=_______ 。
④已知该反应的速率方程为 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=_______ (填整数)。
(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:_______ ←d(填接口序号);由该装置可知,该实验中制备NH3需用到的试剂是_______ (填化学式)。
(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
④实验现象及分析
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是_______ (写出离子方程式);
ii.实验6观察到_______ (填实验现象),证明溶液呈棕色是因为存在[Fe(NO)]2+,且其颜色掩盖了Fe3+的黄色。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。

②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
| 实验编号 | 溶液体积/mL | 收集1.0mLN2所用时间/s | |||
| NaNO2溶液 | NH4Cl溶液 | 醋酸 | 水 | ||
| 1 | 4.0 | 4.0 | 4.0 | 8.0 | 334 |
| 2 | V1 | 4.0 | 4.0 | V3 | 150 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 83 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
④已知该反应的速率方程为
 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:

(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
| 实验编号 | 5 | 6 |
| 操作方法 | 取上述滴有NaNO2溶液的棕色混合液,向其中滴加稀KSCN溶液 | 取上述棕色混合液,按下图所示加热
|
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是
ii.实验6观察到
您最近一年使用:0次
名校
解题方法
9 . 下列实验装置(部分夹持装置已略去)可以达到对应实验目的的是
| 选项 | A | B | C | D |
| 实验 目的 | 测定锌与稀硫酸的反应速率 | 测定H2C2O4溶液的浓度 | 比较AgCl和Ag2S溶解度大小 | 证明Fe能在该条件下发生析氢腐蚀 |
| 实验 装置 | 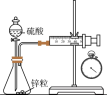 |  | 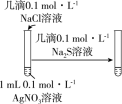 |  取铁电极附近溶液滴加铁氰化钾 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . 下列实验过程可以达到实验目的的是
| 实验目的 | 实验过程 | |
| A | 根据褪色时间来研究浓度对反应速率的影响 | 往2支试管中分别加入同体积、等浓度的草酸溶液,再分别加入同体积、不同浓度的 溶液 溶液 |
| B | 比较 和 和 的催化效果 的催化效果 | 向等体积等浓度的 溶液中分别加入5滴等浓度的 溶液中分别加入5滴等浓度的 和 和 溶液,观察气体产生的速度 溶液,观察气体产生的速度 |
| C | 证明 与KI的反应是可逆反应 与KI的反应是可逆反应 | 向5mL KI溶液中滴加1mL KI溶液中滴加1mL 溶液,振荡,用苯多次萃取后,取水层分装在两支试管,向其中一支滴加几滴KSCN溶液,对比两试管中溶液的颜色 溶液,振荡,用苯多次萃取后,取水层分装在两支试管,向其中一支滴加几滴KSCN溶液,对比两试管中溶液的颜色 |
| D | 探究温度对反应速率的影响 | 将5mL 溶液和5mL 溶液和5mL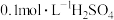 溶液混合后,均分至两支试管,一支放入冷水中,另一支放入热水中,观察现象 溶液混合后,均分至两支试管,一支放入冷水中,另一支放入热水中,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次







