2021高一·全国·专题练习
解题方法
1 . 为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验。请回答下列问题:
(1)过氧化氢分解的化学方程式为_______ 。
(2)实验①的目的是_______ 。
(3)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是_______ (用实验中所提供的几种试剂)。
(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图所示的实验。请回答相关问题:
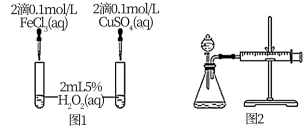
①定性分析:如图1可通过观察_______ ,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是_______ 。
②定量分析:用图2所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是_______ 。
(5)通过对上述实验过程的分析,在实验设计时,要考虑____ 方法的应用。
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入3滴FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡;试管B中产生的气泡量增多 |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2溶液 | 两支试管中均未明显见到有气泡产生 |
(2)实验①的目的是
(3)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是
(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图所示的实验。请回答相关问题:

①定性分析:如图1可通过观察
②定量分析:用图2所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是
(5)通过对上述实验过程的分析,在实验设计时,要考虑
您最近一年使用:0次
名校
2 . 为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验。请回答下列问题:
(1)实验①的目的是___ 。
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是____ (用实验中所提供的几种试剂)。
(3)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图所示的实验。请回答相关问题:
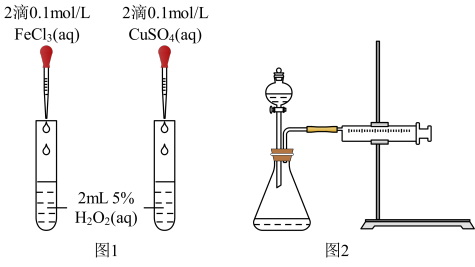
①定性分析:如图1可通过观察____ ,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是___ 。
②定量分析:用图2所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是___ 。
(4)MnO2对H2O2分解反应也有催化作用,另一个同学用图2装置,将状态不同的1gMnO2分别加入盛有30mL等浓度的H2O2溶液的锥形瓶中,产生气体进入注射器针筒中,记录结果如下:
①实验结果表明,催化剂的催化效果与___ 有关。
②实验过程中放出气体的体积(标准状况)和时间的关系如图所示。解释反应速率变化的原因___ 。
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入3滴FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡;试管B中产生的气泡量增多 |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2溶液 | 两支试管中均未明显见到有气泡产生 |
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是
(3)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图所示的实验。请回答相关问题:

①定性分析:如图1可通过观察
②定量分析:用图2所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是
(4)MnO2对H2O2分解反应也有催化作用,另一个同学用图2装置,将状态不同的1gMnO2分别加入盛有30mL等浓度的H2O2溶液的锥形瓶中,产生气体进入注射器针筒中,记录结果如下:
| MnO2状态 | 触摸锥形瓶情况 | 该温度下针筒内收集到气体的体积 | 所需时间 |
| 粉末状 | 很烫 | 30mL | 3min |
| 块状 | 微热 | 30mL | 9min |
②实验过程中放出气体的体积(标准状况)和时间的关系如图所示。解释反应速率变化的原因
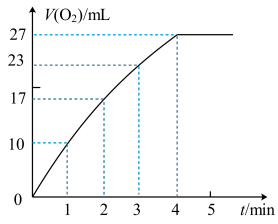
您最近一年使用:0次
解题方法
3 . 下列实验方案不能达到相应实验目的的是
| 实验目的 | 实验方案 | |
| A | 制备CuSO4 | 用稀硫酸、过氧化氢和铜粉反应 |
| B | 加快酸性KMnO4与H2C2O4溶液的反应速率 | 加入一粒黄豆大的MnSO4固体 |
| C | 除去NaCl固体表面的少量KC1杂质 | 用饱和NaCl溶液洗涤 |
| D | 探究浓度对反应速率的影响 | 向盛有同体积、不同浓度NaHSO3溶液的试管中同时加入同体积、同浓度NaClO溶液,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 某化学兴趣小组进行以下实验探究。
Ⅰ.设计实验探究反应速率的测定和比较实验步骤:
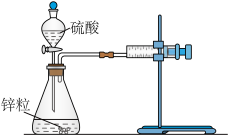
(1)用如图所示装置,加入 的稀硫酸溶液,测量收集
的稀硫酸溶液,测量收集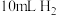 所需的时间。
所需的时间。
(2)另取一套相同的装置,加入40 mL 4 mol·L-1的稀硫酸溶液,测量收集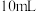 (相同条件下)
(相同条件下) 所需的时间。
所需的时间。
实验现象:锌跟稀硫酸反应产生气泡,收集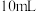 气体,(2)所用时间比(1)所用时间
气体,(2)所用时间比(1)所用时间__________ (填“长”或“短”)
实验结论: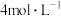 的稀硫酸与锌反应比
的稀硫酸与锌反应比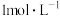 的稀硫酸与锌反应速率
的稀硫酸与锌反应速率___________ (填“大”或“小”):
注意事项:①锌粒的质量、颗粒(即表面积)大小___________ ;
②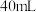 的硫酸要迅速加入;
的硫酸要迅速加入;
③装置____________ ,且计时要迅速准确;
④气体收集可以用排水量气装置代替。
实验讨论:除本实验测定反应速率的方法外,可行的方案还有_________________________ (任写一种)。
Ⅱ.利用 与大理石反应来研究影响反应速率的因素,所用
与大理石反应来研究影响反应速率的因素,所用 浓度为
浓度为 、
、 ,大理石有细颗粒与粗颗粒两种规格,实验温度为
,大理石有细颗粒与粗颗粒两种规格,实验温度为 、
、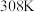 。
。
请完成以下实验设计表。
Ⅰ.设计实验探究反应速率的测定和比较实验步骤:

(1)用如图所示装置,加入
 的稀硫酸溶液,测量收集
的稀硫酸溶液,测量收集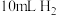 所需的时间。
所需的时间。(2)另取一套相同的装置,加入40 mL 4 mol·L-1的稀硫酸溶液,测量收集
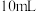 (相同条件下)
(相同条件下) 所需的时间。
所需的时间。实验现象:锌跟稀硫酸反应产生气泡,收集
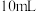 气体,(2)所用时间比(1)所用时间
气体,(2)所用时间比(1)所用时间实验结论:
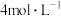 的稀硫酸与锌反应比
的稀硫酸与锌反应比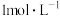 的稀硫酸与锌反应速率
的稀硫酸与锌反应速率注意事项:①锌粒的质量、颗粒(即表面积)大小
②
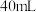 的硫酸要迅速加入;
的硫酸要迅速加入;③装置
④气体收集可以用排水量气装置代替。
实验讨论:除本实验测定反应速率的方法外,可行的方案还有
Ⅱ.利用
 与大理石反应来研究影响反应速率的因素,所用
与大理石反应来研究影响反应速率的因素,所用 浓度为
浓度为 、
、 ,大理石有细颗粒与粗颗粒两种规格,实验温度为
,大理石有细颗粒与粗颗粒两种规格,实验温度为 、
、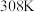 。
。请完成以下实验设计表。
| 实验编号 | T/K | 大理石规格 |  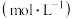 | 实验目的 |
| ① | 298 | 粗颗粒 |  | (1)实验①和②探究 浓度对该反应速率的影响; 浓度对该反应速率的影响;(2)实验①和 (3)实验①和 |
| ② | ||||
| ③ | 粗颗粒 | |||
| ④ |
您最近一年使用:0次
2020-10-11更新
|
145次组卷
|
3卷引用:陕西省西安市远东第一中学2018-2019学年高二上学期10月月考化学试题
名校
解题方法
5 . 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
(1)实验①的目的是___________________________________________ ,实验中滴加FeCl3溶液的目的是________________________________ 。
(2)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是________________________________________________________ (用实验中所提供的几种试剂)。
(3)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图甲所示,则A、B、C三点所表示的瞬时反应速率最慢的是_____________ 。

(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图乙、丙所示的实验。请回答相关问题:
①定性分析:如图乙可通过观察_________________________________ ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______________________________________ 。
②定量分析:用图丙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是______________________________ 。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________ 方法的应用。
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液。 | 试管A、B中均未明显见到有气泡产生。 |
(2)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是
(3)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图甲所示,则A、B、C三点所表示的瞬时反应速率最慢的是

(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图乙、丙所示的实验。请回答相关问题:
①定性分析:如图乙可通过观察
②定量分析:用图丙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是
(5)通过对上述实验过程的分析,在实验设计时,要考虑
您最近一年使用:0次
2010·湖北武汉·一模
6 . 某班级的探究小组研究氧化铜能否在氯酸钾的受热分解中起到催化剂的作用,设计了如下实验:
(一)制备氧化铜
(1)称取5.0g CuSO4·5H2O晶体,研细后溶解:此步骤需要的仪器有_____ 。
(2)向盛有硫酸铜溶液的烧杯中滴加NaOH溶液,直到不再产生沉淀为止。此步实验现象:___________ ;离子方程式为:________ 。
(3)A.把步骤(2)中的溶液和沉淀转移到蒸发皿内,稍微加热至沸腾,搅拌,直到沉淀全部变为黑色固体,停止加热,再过滤、洗涤、干燥、再转移到研钵中研细备用。
B.把步骤(2)中的溶液和沉淀转移到过滤器中过滤,洗涤,将上述沉淀在蒸发皿中进行蒸发,至全部变为黑色固体为止。再转移到研钵中研细备用。
你认为哪一个步骤更好,说明理由:________________ 。
(二)证明氧化铜起催化剂作用
设计对比实验①任取两份氯酸钾,分别放入两支试管,在其中一份中加入经精确称量的ng氧化铜粉末;②将两份氯酸钾同时在相同条件下正确加热,将放出的气体通入水中;③停止加热,冷却,将原先混有氧化铜的反应后混合物加水溶解,小心过滤,得到滤出物,洗涤并干燥;④观察滤出物的颜色和状态;⑤将滤出物和炭粉混和,在密闭容器中高温加热,将反应产生的气体通入澄清的石灰水中,并观察试验现象。
请回答下列问题:
(1)氧化铜作催化剂的理论依据是:____________ 。
(2)以上实验步骤,有一步不够严密,请指出是哪一步:______ (填步骤序号);该步骤应该做何改进?__________________ 。
(3)要达到实验目的,还应该再增加一个实验步骤,这个实验步骤是______ 。
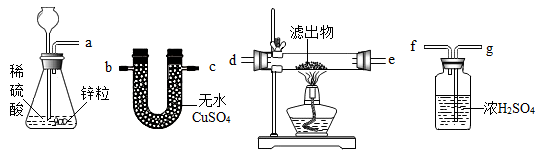
(4)若用另一套实验装置和操作替换第⑤步实验,也可以达到这一步的实验目的,请从图中所给的仪器作出合理选择,将它们连接成一个符合设计者要求的试验装置。这个实验装置按照气流从左到右的连接顺序是__ 接__接__接__接__接__。
(一)制备氧化铜
(1)称取5.0g CuSO4·5H2O晶体,研细后溶解:此步骤需要的仪器有
(2)向盛有硫酸铜溶液的烧杯中滴加NaOH溶液,直到不再产生沉淀为止。此步实验现象:
(3)A.把步骤(2)中的溶液和沉淀转移到蒸发皿内,稍微加热至沸腾,搅拌,直到沉淀全部变为黑色固体,停止加热,再过滤、洗涤、干燥、再转移到研钵中研细备用。
B.把步骤(2)中的溶液和沉淀转移到过滤器中过滤,洗涤,将上述沉淀在蒸发皿中进行蒸发,至全部变为黑色固体为止。再转移到研钵中研细备用。
你认为哪一个步骤更好,说明理由:
(二)证明氧化铜起催化剂作用
设计对比实验①任取两份氯酸钾,分别放入两支试管,在其中一份中加入经精确称量的ng氧化铜粉末;②将两份氯酸钾同时在相同条件下正确加热,将放出的气体通入水中;③停止加热,冷却,将原先混有氧化铜的反应后混合物加水溶解,小心过滤,得到滤出物,洗涤并干燥;④观察滤出物的颜色和状态;⑤将滤出物和炭粉混和,在密闭容器中高温加热,将反应产生的气体通入澄清的石灰水中,并观察试验现象。
请回答下列问题:
(1)氧化铜作催化剂的理论依据是:
(2)以上实验步骤,有一步不够严密,请指出是哪一步:
(3)要达到实验目的,还应该再增加一个实验步骤,这个实验步骤是
(4)若用另一套实验装置和操作替换第⑤步实验,也可以达到这一步的实验目的,请从图中所给的仪器作出合理选择,将它们连接成一个符合设计者要求的试验装置。这个实验装置按照气流从左到右的连接顺序是

您最近一年使用:0次
名校
解题方法
7 . 含氮物质是一类常见物质,在人们的生产、生活活动中有重要作用。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。_______ ,收集N2的方法是_______ (填标号)。
②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
③V1=_______ ,V3=_______ 。
④已知该反应的速率方程为 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=_______ (填整数)。
(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:_______ ←d(填接口序号);由该装置可知,该实验中制备NH3需用到的试剂是_______ (填化学式)。
(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
④实验现象及分析
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是_______ (写出离子方程式);
ii.实验6观察到_______ (填实验现象),证明溶液呈棕色是因为存在[Fe(NO)]2+,且其颜色掩盖了Fe3+的黄色。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。

②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
| 实验编号 | 溶液体积/mL | 收集1.0mLN2所用时间/s | |||
| NaNO2溶液 | NH4Cl溶液 | 醋酸 | 水 | ||
| 1 | 4.0 | 4.0 | 4.0 | 8.0 | 334 |
| 2 | V1 | 4.0 | 4.0 | V3 | 150 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 83 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
④已知该反应的速率方程为
 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:

(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
| 实验编号 | 5 | 6 |
| 操作方法 | 取上述滴有NaNO2溶液的棕色混合液,向其中滴加稀KSCN溶液 | 取上述棕色混合液,按下图所示加热
|
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是
ii.实验6观察到
您最近一年使用:0次
解题方法
8 . 铜是与人类关系非常密切的有色金属,人类使用铜及其合金已有数千年历史。某实验小组以铜为原料进行如下实验,回答下列问题:
Ⅰ.制备 并探究其性质
并探究其性质

(1)仪器a的名称为_______ 。若用 和浓硫酸反应制备
和浓硫酸反应制备 ,应选用装置
,应选用装置_______ (填“A”或“B”)。
(2)通入 后,装置C中的现象为
后,装置C中的现象为_______ 。装置D中出现淡黄色浑浊,发生反应的化学方程式为_______ 。
Ⅱ.探究温度对 催化
催化 分解速率的影响
分解速率的影响
实验事实将光洁无锈的铜丝插入装有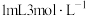 硫酸的试管中,一段时间后铜丝表面未发生变化。再向该试管中加入
硫酸的试管中,一段时间后铜丝表面未发生变化。再向该试管中加入 的
的 溶液,铜丝表面产生气泡并逐渐变多,溶液变成蓝色。经检验产生的气体为
溶液,铜丝表面产生气泡并逐渐变多,溶液变成蓝色。经检验产生的气体为 ,查阅资料发现是
,查阅资料发现是 催化
催化 分解的结果。
分解的结果。
(3)写出该过程中生成 的离子方程式
的离子方程式_______ 。
提出问题 加入 溶液后,铜丝表面产生气泡逐渐变多,即
溶液后,铜丝表面产生气泡逐渐变多,即 分解速率逐渐增大,是什么原因导致的?
分解速率逐渐增大,是什么原因导致的?
提出猜想 实验小组同学提出了一种猜想:反应过程中溶液温度升高, 催化
催化 分解的速率增大。
分解的速率增大。
实验验证 小组同学通过测量相同时间内生成 的体积,来比较不同温度下
的体积,来比较不同温度下 催化
催化 分解速率的大小,实验设计如下。所用试剂为
分解速率的大小,实验设计如下。所用试剂为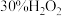 溶液、
溶液、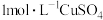 溶液、蒸馏水。
溶液、蒸馏水。
说明:各实验采用排水法,在相同温度和压强下测量 体积。
体积。
实验分析及结论
(4)通过实验测得 。小组同学认为实验
。小组同学认为实验 的结果不能证明猜想成立,理由是
的结果不能证明猜想成立,理由是_______ 。
(5)为进一步验证猜想,小组同学又进行了实验 。
。
①表中
_______ ,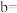
_______ ,
_______ 。
②小组同学结合实验 ,依据
,依据_______ (用含 和
和 的不等式表示)判断猜想成立。
的不等式表示)判断猜想成立。
Ⅰ.制备
 并探究其性质
并探究其性质
(1)仪器a的名称为
 和浓硫酸反应制备
和浓硫酸反应制备 ,应选用装置
,应选用装置(2)通入
 后,装置C中的现象为
后,装置C中的现象为Ⅱ.探究温度对
 催化
催化 分解速率的影响
分解速率的影响实验事实将光洁无锈的铜丝插入装有
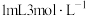 硫酸的试管中,一段时间后铜丝表面未发生变化。再向该试管中加入
硫酸的试管中,一段时间后铜丝表面未发生变化。再向该试管中加入 的
的 溶液,铜丝表面产生气泡并逐渐变多,溶液变成蓝色。经检验产生的气体为
溶液,铜丝表面产生气泡并逐渐变多,溶液变成蓝色。经检验产生的气体为 ,查阅资料发现是
,查阅资料发现是 催化
催化 分解的结果。
分解的结果。(3)写出该过程中生成
 的离子方程式
的离子方程式提出问题 加入
 溶液后,铜丝表面产生气泡逐渐变多,即
溶液后,铜丝表面产生气泡逐渐变多,即 分解速率逐渐增大,是什么原因导致的?
分解速率逐渐增大,是什么原因导致的?提出猜想 实验小组同学提出了一种猜想:反应过程中溶液温度升高,
 催化
催化 分解的速率增大。
分解的速率增大。实验验证 小组同学通过测量相同时间内生成
 的体积,来比较不同温度下
的体积,来比较不同温度下 催化
催化 分解速率的大小,实验设计如下。所用试剂为
分解速率的大小,实验设计如下。所用试剂为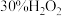 溶液、
溶液、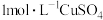 溶液、蒸馏水。
溶液、蒸馏水。| 实验序号 | 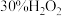 溶液体积/ 溶液体积/ | 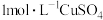 溶液体积/ 溶液体积/ | 蒸馏水体积/ | 水浴温度/℃ |  时生成 时生成 的体积/ 的体积/ |
| 1 | 10 | 1 | 1 | 20 |  |
| 2 | 10 | 1 | 1 | 30 |  |
| 3 | 10 | 1 | 1 | 40 |  |
| 4 | 10 | a | b | 20 | 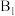 |
| 5 | 10 | c |  | ||
| 6 | 10 | 40 |  |
 体积。
体积。实验分析及结论
(4)通过实验测得
 。小组同学认为实验
。小组同学认为实验 的结果不能证明猜想成立,理由是
的结果不能证明猜想成立,理由是(5)为进一步验证猜想,小组同学又进行了实验
 。
。①表中


②小组同学结合实验
 ,依据
,依据 和
和 的不等式表示)判断猜想成立。
的不等式表示)判断猜想成立。
您最近一年使用:0次
23-24高二·全国·假期作业
9 . 某学生为探究锌与稀盐酸反应的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有1.00mol·L-1、2.00mol·L-1两种浓度,每次实验稀盐酸的用量为25.00mL,锌有细颗粒与粗颗粒两种规格,用量为6.50g。实验温度为25℃、35℃。(已知Zn2+对该反应速率无影响)
(1)请在实验目的一栏中的空白项处填出对应的实验编号:
(2)实验①记录如下(换算成标况):
①计算在30~40s范围内盐酸的平均反应速率ν(HCl)=___________ (忽略溶液体积变化);
②反应速率最大的时间段(如0~10s)为___________ ,可能原因是___________ ;
③反应速率后段明显下降的主要影响因素是___________ 。
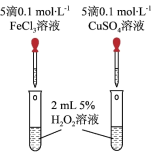
(3)某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如图所示的实验。___________ 现象,比较得出Fe3+和Cu2+对H2O2分解的催化效果结论;
②某同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___________ 。
(1)请在实验目的一栏中的空白项处填出对应的实验编号:
| 编号 | t/℃ | 锌规格 | 盐酸浓度/mol·L-1 | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | I.实验①和②探究盐酸浓度对该反应速率的影响; Ⅱ.实验 Ⅲ.实验 |
| ② | 25 | 粗颗粒 | 1.00 | |
| ③ | 35 | 粗颗粒 | 2.00 | |
| ④ | 25 | 细颗粒 | 2.00 |
(2)实验①记录如下(换算成标况):
| 时间/s | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积/mL | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
②反应速率最大的时间段(如0~10s)为
③反应速率后段明显下降的主要影响因素是
(3)某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如图所示的实验。
②某同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是
您最近一年使用:0次
名校
解题方法
10 . 下列实验过程可以达到实验目的的是
| 实验目的 | 实验过程 | |
| A | 根据褪色时间来研究浓度对反应速率的影响 | 往2支试管中分别加入同体积、等浓度的草酸溶液,再分别加入同体积、不同浓度的 溶液 溶液 |
| B | 比较 和 和 的催化效果 的催化效果 | 向等体积等浓度的 溶液中分别加入5滴等浓度的 溶液中分别加入5滴等浓度的 和 和 溶液,观察气体产生的速度 溶液,观察气体产生的速度 |
| C | 证明 与KI的反应是可逆反应 与KI的反应是可逆反应 | 向5mL KI溶液中滴加1mL KI溶液中滴加1mL 溶液,振荡,用苯多次萃取后,取水层分装在两支试管,向其中一支滴加几滴KSCN溶液,对比两试管中溶液的颜色 溶液,振荡,用苯多次萃取后,取水层分装在两支试管,向其中一支滴加几滴KSCN溶液,对比两试管中溶液的颜色 |
| D | 探究温度对反应速率的影响 | 将5mL 溶液和5mL 溶液和5mL 溶液混合后,均分至两支试管,一支放入冷水中,另一支放入热水中,观察现象 溶液混合后,均分至两支试管,一支放入冷水中,另一支放入热水中,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次




