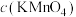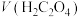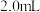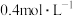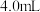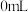1 . 已知Cu与 在硫酸中可以发生如下反应:
在硫酸中可以发生如下反应: 。某学习小组将Cu与
。某学习小组将Cu与 在硫酸中的反应设计为原电池,并进行相关实验探究。回答下列问题:
在硫酸中的反应设计为原电池,并进行相关实验探究。回答下列问题:
I.实验准备
(1)硫酸溶液的配制
①配制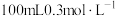 的
的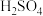 溶液,需要
溶液,需要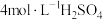 溶液的体积为
溶液的体积为___________ mL(计算结果保留一位小数)。
②在实验室配制上述溶液的过程中,需要用到下图所示仪器的是___________ (填仪器名称)。
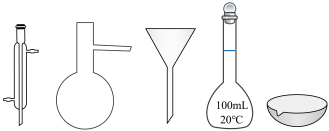
II.实验探究
【实验任务】利用相关原电池装置进行实验,探究物质氧化性或还原性的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【进行实验】
(2)利用下表所示装置进行实验1~4,记录数据。
已知:本实验条件下, 对电压的影响可忽略。
对电压的影响可忽略。
①根据表中信息,补充数据: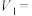
___________ 。
②由实验2和4可知,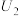
___________ 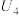 (填“大于”“小于”或“等于”),说明其他条件相同时,
(填“大于”“小于”或“等于”),说明其他条件相同时, 溶液的浓度越大,其氧化性越强。
溶液的浓度越大,其氧化性越强。
(3)由(2)中实验结果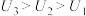 ,学习小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
,学习小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
猜想1:酸性条件下, 的氧化性随pH减小而增强。
的氧化性随pH减小而增强。
猜想2:酸性条件下,Cu的还原性随pH减小而增强。
为验证猜想,学习小组的同学在(2)中实验1~4的基础上,利用下表中的装置进行实验5~7,并记录数据。
②该实验装置中盐桥的作用为___________ 。
③若实验结果为: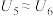 、
、___________ ,说明猜想2不成立,猜想1成立。
(4)已知Cu与 反应时,加入氨水可形成深蓝色的、稳定的
反应时,加入氨水可形成深蓝色的、稳定的 。小组同学利用(3)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:
。小组同学利用(3)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:___________ 。
(5)通过上述实验探究过程可以得出的结论为:影响物质的氧化性(或还原性)强弱的因素为___________ 。
 在硫酸中可以发生如下反应:
在硫酸中可以发生如下反应: 。某学习小组将Cu与
。某学习小组将Cu与 在硫酸中的反应设计为原电池,并进行相关实验探究。回答下列问题:
在硫酸中的反应设计为原电池,并进行相关实验探究。回答下列问题:I.实验准备
(1)硫酸溶液的配制
①配制
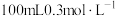 的
的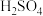 溶液,需要
溶液,需要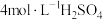 溶液的体积为
溶液的体积为②在实验室配制上述溶液的过程中,需要用到下图所示仪器的是

II.实验探究
【实验任务】利用相关原电池装置进行实验,探究物质氧化性或还原性的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【进行实验】
(2)利用下表所示装置进行实验1~4,记录数据。
| 实验装置 | 实验序号 | 烧杯中所加的试剂 | 电压表的读数 | ||
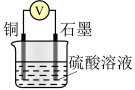 | 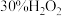 | 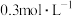 硫酸溶液 硫酸溶液 |  | ||
| V/mL | V/mL | V/mL | |||
| 1 | 30.0 | / | 10.0 | 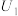 | |
| 2 | 30.0 | 1.0 | 9.0 | 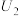 | |
| 3 | 30.0 | 2.0 | 8.0 |  | |
| 4 | 30.0 | 1.0 |  | 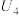 | |
 对电压的影响可忽略。
对电压的影响可忽略。①根据表中信息,补充数据:
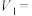
②由实验2和4可知,
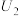
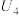 (填“大于”“小于”或“等于”),说明其他条件相同时,
(填“大于”“小于”或“等于”),说明其他条件相同时, 溶液的浓度越大,其氧化性越强。
溶液的浓度越大,其氧化性越强。(3)由(2)中实验结果
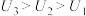 ,学习小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
,学习小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:猜想1:酸性条件下,
 的氧化性随pH减小而增强。
的氧化性随pH减小而增强。猜想2:酸性条件下,Cu的还原性随pH减小而增强。
为验证猜想,学习小组的同学在(2)中实验1~4的基础上,利用下表中的装置进行实验5~7,并记录数据。
| 实验装置 | 实验序号 | 实验操作 | 电压表的读数 |
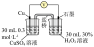 | 5 | / | 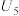 |
| 6 | 向①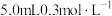 硫酸溶液 硫酸溶液 | 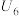 | |
| 7 | 向另一侧烧杯中滴加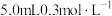 硫酸溶液 硫酸溶液 | 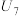 |
③若实验结果为:
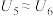 、
、(4)已知Cu与
 反应时,加入氨水可形成深蓝色的、稳定的
反应时,加入氨水可形成深蓝色的、稳定的 。小组同学利用(3)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:
。小组同学利用(3)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因:(5)通过上述实验探究过程可以得出的结论为:影响物质的氧化性(或还原性)强弱的因素为
您最近一年使用:0次
名校
解题方法
2 . 某研究性学习小组设计下列实验探究Zn和FeCl3溶液的反应,回答下列问题:
(1)由FeCl3固体配制未酸化的250mL0.5mol·L-1FeCl3溶液(pH=1.3),不需要使用的实验仪器有___________ (从下列图中选择,写出名称)。

(2)将Zn投入到未酸化的0.5mol·L-1FeCl3溶液(pH=1.3)中,在不同的实验条件下,实验现象如表:
①实验中产生的气体为___________ ,实验ii中产生气体的速率明显快于实验i,可能的原因是___________ (答出两点)。
②“滴加铁氰化钾溶液后,可见蓝色沉淀”说明混合溶液中存在Fe2+。生成Fe2+的离子方程式为___________ 。
(3)实验i和ii均先有气体生成,后有溶液颜色的变化。研究性学习小组猜想,可能是此实验条件下,氧化性:H+>Fe3+。
①为了检验上述猜想是否正确,查阅资料:可利用标准电极电势(用φθ表示)判断氧化性、还原性强弱,且电极电势越小,还原剂的还原性越强,已知(溶液中离子浓度的影响在此忽略不计):φθ(Fe3+ /Fe2+)=0.77 V,φθ (2H+ /H2)=0 V,φθ (Fe2+ /Fe)=—0.417 V,φθ (Zn2+ /Zn) =—0.76 V。则Fe3+、H+、Zn2+、Fe2+的氧化性大小关系为___________ 。
②研究小组进一步分析后,将锌粒改为锌粉,继续进行实验:
对比实验iii和iv,实验iv中“气泡不明显,红褐色褪色明显”的原因可能为___________ 。
③结合实验探究过程及现象分析,影响Zn与FeCl3溶液反应的条件有___________ (答两点即可的)。
(1)由FeCl3固体配制未酸化的250mL0.5mol·L-1FeCl3溶液(pH=1.3),不需要使用的实验仪器有

(2)将Zn投入到未酸化的0.5mol·L-1FeCl3溶液(pH=1.3)中,在不同的实验条件下,实验现象如表:
| 实验编号 | 条件 | 现象 |
| i | 锌粒18℃ | 刚开始无明显气泡,0.5min后有气体产生,一段时间后,溶液颜色加深。向反应后的溶液中滴加铁氰化钾溶液后,可见蓝色沉淀 |
| ii | 锌粒65℃ | 产生气泡较快,大约12 s后,气泡非常明显,溶液很快转为红棕色。较长时间后发现红棕色基本消失,最后产生红棕色沉淀 |
②“滴加铁氰化钾溶液后,可见蓝色沉淀”说明混合溶液中存在Fe2+。生成Fe2+的离子方程式为
(3)实验i和ii均先有气体生成,后有溶液颜色的变化。研究性学习小组猜想,可能是此实验条件下,氧化性:H+>Fe3+。
①为了检验上述猜想是否正确,查阅资料:可利用标准电极电势(用φθ表示)判断氧化性、还原性强弱,且电极电势越小,还原剂的还原性越强,已知(溶液中离子浓度的影响在此忽略不计):φθ(Fe3+ /Fe2+)=0.77 V,φθ (2H+ /H2)=0 V,φθ (Fe2+ /Fe)=—0.417 V,φθ (Zn2+ /Zn) =—0.76 V。则Fe3+、H+、Zn2+、Fe2+的氧化性大小关系为
②研究小组进一步分析后,将锌粒改为锌粉,继续进行实验:
| 实验编号 | 条件 | 现象 |
| iii | 锌粉18℃ 不振荡 | 大约3min可以看到明显的气泡,溶液颜色逐渐变深。向反应后的溶液中滴加铁氰化钾溶液后,可见蓝色沉淀 |
| iv | 锌粉65℃ 振荡 | 气泡不明显,红褐色褪色明显。向反应后的溶液中滴加铁氰化钾溶液后,可见蓝色沉淀 |
③结合实验探究过程及现象分析,影响Zn与FeCl3溶液反应的条件有
您最近一年使用:0次
2022-01-19更新
|
1229次组卷
|
5卷引用:福建省漳州市2022届高三毕业班第一次质量检测化学试题
福建省漳州市2022届高三毕业班第一次质量检测化学试题(已下线)一轮巩固卷8-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)(已下线)易错点06 铁及其化合物-备战2023年高考化学考试易错题福建省永安第九中学2022-2023学年高三上学期期中考试化学试题(已下线)专题六 金属元素及其化合物-实战高考·二轮复习核心突破
名校
3 . 某兴趣小组同学探究 溶液与草酸(
溶液与草酸( )溶液反应速率的影响因素。配制
)溶液反应速率的影响因素。配制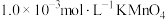 溶液、
溶液、 草酸溶液。将
草酸溶液。将 溶液与草酸溶液按如下比例混合。
溶液与草酸溶液按如下比例混合。
【设计实验】
(1)实验①和②的目的是_______ 。
(2)甲认为上述实验应控制pH相同,可加入的试剂是_______ (填序号)。
a. 盐酸 b. 硫酸 c. 草酸
【实施实验】
小组同学将溶液pH调至1进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:i. 紫色溶液变为青色溶液,ii. 青色溶液逐渐褪至无色溶液。
资料:(a) 在溶液中无色
在溶液中无色
(b) 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应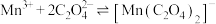 (青色)后氧化性减弱;
(青色)后氧化性减弱;
(c) 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。
(3)乙同学从氧化还原角度推测阶段i中可能产生了 。你认为该观点是否合理
。你认为该观点是否合理_______ ,并说明理由:_______ 。
【深入探究】
进一步实验证明溶液中含有 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
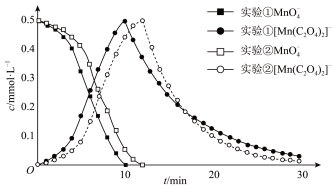
(4)第i阶段中检测到有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为_______ 。
(5)实验②在第ii阶段的反应速率较大,可能的原因是:实验②中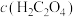 低,电离产生的
低,电离产生的 低,所以
低,所以_______ 。
(6)据此推测,若在第ii阶段增强溶液的酸性,使溶液中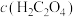 增大,
增大, 减小,溶液褪至无色的时间会
减小,溶液褪至无色的时间会_______ (填“增加”“减少”或“不变”)。
【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是_______ (说出两点)
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
 溶液与草酸(
溶液与草酸( )溶液反应速率的影响因素。配制
)溶液反应速率的影响因素。配制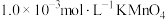 溶液、
溶液、 草酸溶液。将
草酸溶液。将 溶液与草酸溶液按如下比例混合。
溶液与草酸溶液按如下比例混合。【设计实验】
| 序号 | 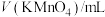 | V(草酸)/mL | 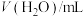 | 反应温度 |
| ① | 2.0 | 2.0 | 0 |  |
| ② | 2.0 | 1.0 | 1.0 |  |
(2)甲认为上述实验应控制pH相同,可加入的试剂是
a. 盐酸 b. 硫酸 c. 草酸
【实施实验】
小组同学将溶液pH调至1进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:i. 紫色溶液变为青色溶液,ii. 青色溶液逐渐褪至无色溶液。
资料:(a)
 在溶液中无色
在溶液中无色(b)
 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应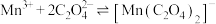 (青色)后氧化性减弱;
(青色)后氧化性减弱;(c)
 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。(3)乙同学从氧化还原角度推测阶段i中可能产生了
 。你认为该观点是否合理
。你认为该观点是否合理【深入探究】
进一步实验证明溶液中含有
 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
(4)第i阶段中检测到有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为(5)实验②在第ii阶段的反应速率较大,可能的原因是:实验②中
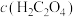 低,电离产生的
低,电离产生的 低,所以
低,所以(6)据此推测,若在第ii阶段增强溶液的酸性,使溶液中
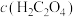 增大,
增大, 减小,溶液褪至无色的时间会
减小,溶液褪至无色的时间会【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
您最近一年使用:0次
2023-05-01更新
|
275次组卷
|
2卷引用:北京市清华大学附属中学2022-2023 学年高二下学期期中考试化学试题
名校
4 . Ⅰ.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
(1)催化剂能增大化学反应速率的原因是___________ 。
(2)实验①和②的目的是探究___________ 对反应速率的影响。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是___________ 。
(3)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图。
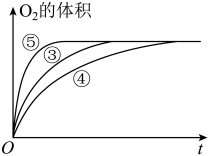
分析下图能够得出的实验结论:
①___________ 环境能增大H2O2分解的速率;
②___________ 环境能减小H2O2分解的速率。
(4)设计实验进一步探究Fe3+和Cu2+对H2O2分解的催化效果:在两支试管中各加入2mL5%的H2O2溶液,再向其中分别滴入1mL浓度均为0.1mol/L的FeCl3溶液和CuSO4溶液。有同学建议将CuSO4改为CuCl2溶液,理由是___________ ;还有同学认为即使改用了CuCl2溶液,仍不严谨,建议补做对比实验:向2mL5%的H2O2溶液中滴入的试剂及其用量是___________ 。
Ⅱ.为进一步研究浓度对反应速率的影响,该实验小组又涉及了如下实验方案:混合试剂1和试剂2,记录溶液褪色所需的时间。
(5)写出上述反应的离子方程式:___________ 。
(6)实验1中tmin时溶液褪色,用草酸表示的反应速率v(H2C2O4)=___________ mol·L-1·min-1。联系实验1、2,预期结论是___________ 。
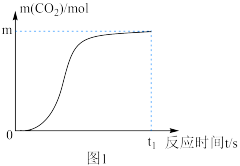
(7)n(CO2)随时间的变化如下图1所示,其变化的原因是___________ 。
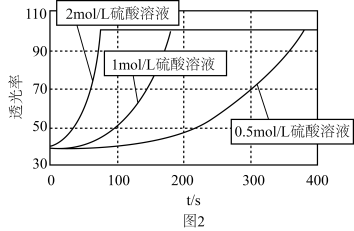
(8)研究发现KMnO4溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图2所示,由此得出的结论是___________ 。
| 分组实验 | 催化剂 | |
| ① | 10mL5%H2O2溶液 | 无 |
| ② | 10mL2%H2O2溶液 | 无 |
| ③ | 10mL5%H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5%H2O2溶液+少量稀盐酸 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(2)实验①和②的目的是探究
(3)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图。

分析下图能够得出的实验结论:
①
②
(4)设计实验进一步探究Fe3+和Cu2+对H2O2分解的催化效果:在两支试管中各加入2mL5%的H2O2溶液,再向其中分别滴入1mL浓度均为0.1mol/L的FeCl3溶液和CuSO4溶液。有同学建议将CuSO4改为CuCl2溶液,理由是
Ⅱ.为进一步研究浓度对反应速率的影响,该实验小组又涉及了如下实验方案:混合试剂1和试剂2,记录溶液褪色所需的时间。
| 实验1 | 实验2 | |
| 试剂1 | 2mL0.1mol/L的草酸溶液 | 2mL0.2mol/L的草酸溶液 |
| 试剂2 | 4mL0.01mol/L的高锰酸钾酸性溶液 | 4mL0.01mol/L的高锰酸钾酸性溶液 |
(6)实验1中tmin时溶液褪色,用草酸表示的反应速率v(H2C2O4)=
(7)n(CO2)随时间的变化如下图1所示,其变化的原因是

(8)研究发现KMnO4溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图2所示,由此得出的结论是

您最近一年使用:0次
名校
解题方法
5 . 某兴趣小组同学将 的酸性
的酸性 溶液和
溶液和 溶液按如下比例混合,探究浓度对反应速率的影响。
溶液按如下比例混合,探究浓度对反应速率的影响。
现象:实验①溶液很快由紫色变为青绿色,而实验②慢一点;变为青绿色后,实验②溶液很快褪至无色,而实验①褪色慢一点。
资料: 与
与 很难形成配合物;
很难形成配合物;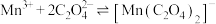 (青绿色),
(青绿色), 有强氧化性,而
有强氧化性,而 氧化性极弱。
氧化性极弱。
下列说法错误的是
 的酸性
的酸性 溶液和
溶液和 溶液按如下比例混合,探究浓度对反应速率的影响。
溶液按如下比例混合,探究浓度对反应速率的影响。序号 | 温度 |
|
|
|
|
|
① | 20℃ |
|
|
|
|
|
② | 20℃ |
|
|
|
|
|
资料:
 与
与 很难形成配合物;
很难形成配合物;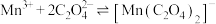 (青绿色),
(青绿色), 有强氧化性,而
有强氧化性,而 氧化性极弱。
氧化性极弱。下列说法错误的是
A. |
B. 溶液中能通过加盐酸酸化调 溶液中能通过加盐酸酸化调 |
C.溶液由青绿色褪至无色过程中,实验①中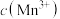 较小,导致褪色速率较慢 较小,导致褪色速率较慢 |
D.由实验可知,加入 越多, 越多, 溶液由紫色褪至无色的速率越快 溶液由紫色褪至无色的速率越快 |
您最近一年使用:0次
2023-06-02更新
|
237次组卷
|
3卷引用:河北省2022-2023学年高三下学期1月大联考化学试题
6 . 氧化剂H2O2在反应时不产生污染物被称为“绿色氧化剂”,因而受到人们越来越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
(1)实验①和②的目的是___________ 。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是__________ (填一种方法即可)。
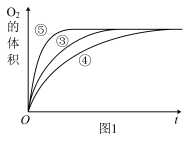
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示。分析该图能够得出的实验结论是_______________ 。
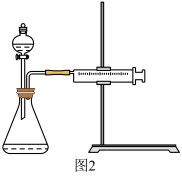
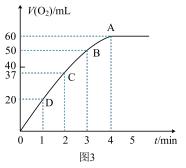
Ⅱ.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验。
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量_________ 或________ 来比较。
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示。请解释化学反应速率变化的原因:_______ 。请计算H2O2的初始物质的量浓度为__________ (保留两位有效数字)。为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无需写出具体操作):a._______ ;b._______ 。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol/LFeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol/LFeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol/LFeCl3溶液 |
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示。分析该图能够得出的实验结论是


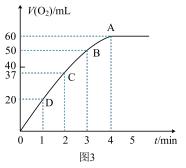
Ⅱ.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验。
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示。请解释化学反应速率变化的原因:
您最近一年使用:0次
名校
解题方法
7 . 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关四环素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应)
相关资料
①氰化物主要以CN-和[Fe(CN)6]3-两种形式存在
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂,Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计。
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH值越大,越稳定,越难被氧化。
实验过程
(1)请完成以下实验设计表(表中不要留空格)
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示。
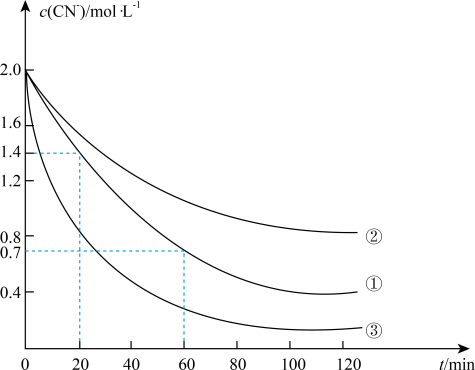
(2)实验①中20~60min时间段反应速率:υ(CN-)=___ mol•L-1•min-1。
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是__ (填一点即可),在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式___ 。
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成表2中内容。(已知:废水中的CN-浓度可用离子色谱仪测定)___
相关资料
①氰化物主要以CN-和[Fe(CN)6]3-两种形式存在
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂,Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计。
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH值越大,越稳定,越难被氧化。
实验过程
(1)请完成以下实验设计表(表中不要留空格)
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| 1 | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| 2 | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| 3 | 7 | 60 | 10 |

(2)实验①中20~60min时间段反应速率:υ(CN-)=
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成表2中内容。(已知:废水中的CN-浓度可用离子色谱仪测定)
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
您最近一年使用:0次
解题方法
8 . 氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
(1)实验①和②的目的是_________________________________ 。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________________________ (填一种方法即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
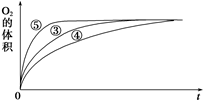
分析该图能够得出的实验结论是________________________________ 。
II.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如下图所示的实验装置进行实验。
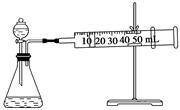
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量_______ 或______ 来比较。
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。请解释化学反应速率变化的原因:_____________ 。请计算H2O2的初始物质的量浓度为________________ (保留两位有效数字)。
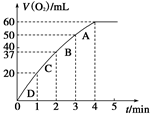
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无 需写出具体操作):a._________________ ;b.___________________ 。
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。

分析该图能够得出的实验结论是
II.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如下图所示的实验装置进行实验。

(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。请解释化学反应速率变化的原因:

为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无 需写出具体操作):a.
您最近一年使用:0次
2019-01-30更新
|
575次组卷
|
2卷引用:2015届广东省揭阳市高三毕业班二模考试理综化学试卷
名校
9 . 某实验小组为探究酸性条件下碘化钾与过氧化氧反应的化学反应速率,进行以下实验探究。
(1)实验一:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠( )的混合溶液,一段时间后溶液变蓝。该小组查阅资料知体系中存在下列两个主要反应:
)的混合溶液,一段时间后溶液变蓝。该小组查阅资料知体系中存在下列两个主要反应:
反应ⅰ: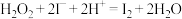 ;
;
反应ⅱ: 。
。
为了证实上述反应过程,进行下列实验(所用试剂浓度均为 )
)
实验二:向酸化的 溶液中加入淀粉KI溶液,溶液几秒后变为蓝色。再向已经变蓝的溶液中加入
溶液中加入淀粉KI溶液,溶液几秒后变为蓝色。再向已经变蓝的溶液中加入 溶液,溶液立即褪色。
溶液,溶液立即褪色。
根据此现象可知反应ⅰ的速率___________ 反应ⅱ的速率(填“大于”、“小于”或“等于”),解释实验一中溶液混合一段时间后才变蓝的原因是___________ 。
(2)为了探究 对反应速率的影响,设计两组对比实验,按下表中的试剂用量将其迅速混合观察现象。(各实验均在室温条件下进行)
对反应速率的影响,设计两组对比实验,按下表中的试剂用量将其迅速混合观察现象。(各实验均在室温条件下进行)
①V1=___________ ,V2=___________ 。
②对比实验I和实验II,
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)利用实验I的数据,计算反应ⅱ在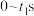 的化学反应速率
的化学反应速率
___________ 
(1)实验一:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠(
 )的混合溶液,一段时间后溶液变蓝。该小组查阅资料知体系中存在下列两个主要反应:
)的混合溶液,一段时间后溶液变蓝。该小组查阅资料知体系中存在下列两个主要反应:反应ⅰ:
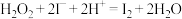 ;
;反应ⅱ:
 。
。为了证实上述反应过程,进行下列实验(所用试剂浓度均为
 )
)实验二:向酸化的
 溶液中加入淀粉KI溶液,溶液几秒后变为蓝色。再向已经变蓝的溶液中加入
溶液中加入淀粉KI溶液,溶液几秒后变为蓝色。再向已经变蓝的溶液中加入 溶液,溶液立即褪色。
溶液,溶液立即褪色。根据此现象可知反应ⅰ的速率
(2)为了探究
 对反应速率的影响,设计两组对比实验,按下表中的试剂用量将其迅速混合观察现象。(各实验均在室温条件下进行)
对反应速率的影响,设计两组对比实验,按下表中的试剂用量将其迅速混合观察现象。(各实验均在室温条件下进行)| 实验编号 | 试剂体积/mL | 溶液开始变蓝的时间/s | ||||
  |   |   |  KI(含淀粉) |  | ||
| I | 40 | 40 | 20 | 40 | 20 |  |
| II | V1 | 20 | 20 | 40 | V2 |  |
②对比实验I和实验II,

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(3)利用实验I的数据,计算反应ⅱ在
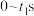 的化学反应速率
的化学反应速率

您最近一年使用:0次
10 . 氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
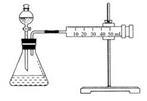
(1)实验①和②的目的是______________________ 。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_______________ (填一种即可)。
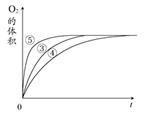
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示。分析该图能够得出的实验结论是_____________________ 。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验。
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量______________________________________ 来比较。
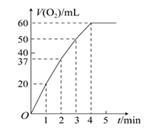
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如下图所示。解释反应速率变化的原因:_______________ 。
(3)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是_________ (填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2%H2O2溶液 | 无 |
| ② | 10 mL 5%H2O2溶液 | 无 |
| ③ | 10 mL 5%H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5%H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5%H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |

(1)实验①和②的目的是
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示。分析该图能够得出的实验结论是

Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图2所示的实验装置进行实验。
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如下图所示。解释反应速率变化的原因:

(3)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
您最近一年使用:0次
2016-12-09更新
|
179次组卷
|
3卷引用:2015-2016学年湖南省株洲十八中高二上学期期中(理)化学试卷