2024高三·全国·专题练习
解题方法
1 . 某小组探究70℃时,pH值及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下
(1)设计实验1和2的目的是___________ 。
(2)实验5中的a___________ 0.935(填“大于”、“小于”或“等于”)。
(3)根据实验3-5,可得出的结论是___________ 。
(4)下列物质中最适宜做为NaClO溶液稳定剂的是___________。
| 序号 | 硅酸钠的质量分数 | 碳酸钠的质量分数 | 初始COAC | pH值 | 12h后COAC | 12h后COAC/初始COAC |
| 1 | 0 | 0 | 1794 | 8.53 | 1218 | 0.679 |
| 2 | 0 | 0 | 1794 | 8.63 | 1288 | 0.718 |
| 3 | 0.9% | 0.6% | 1794 | 13.44 | 1676 | 0.935 |
| 4 | 1.5% | 0 | 1834 | 13.76 | 1597 | 0.871 |
| 5 | 0 | 1.5% | 1834 | 13.66 | - | a |
(2)实验5中的a
(3)根据实验3-5,可得出的结论是
(4)下列物质中最适宜做为NaClO溶液稳定剂的是___________。
A. | B.NaCl | C. | D. |
您最近一年使用:0次
2 .  常用于有机合成的氯化剂、催化剂,某实验小组在实验室中模拟制备
常用于有机合成的氯化剂、催化剂,某实验小组在实验室中模拟制备 并测定产品的含量。一些物质相关性质如表所示:
并测定产品的含量。一些物质相关性质如表所示:
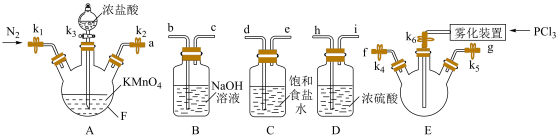
Ⅰ.制备 :
: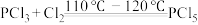
(1)仪器F的名称是___________ ,E中使用雾化装置的优点是___________ 。
(2)按气流从左往右的方向,上述装置的合理连接顺序为a→d→e→___________ (填小写字母,仪器可以重复使用)
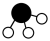
(3)固体 为氯化铯型晶体,由具有正四面体结构和正八面体结构的两种离子构成,写出
为氯化铯型晶体,由具有正四面体结构和正八面体结构的两种离子构成,写出 的电离方程式:
的电离方程式:___________ 。
Ⅱ.测定 产品的含量
产品的含量
实验结束后,准确称取4.20克 产品(含杂质),置于盛有
产品(含杂质),置于盛有 足量氢氧化钠溶液的锥形瓶中至产品完全水解,将水解液配成
足量氢氧化钠溶液的锥形瓶中至产品完全水解,将水解液配成 溶液。取
溶液。取 溶液于锥形瓶中,加入几滴
溶液于锥形瓶中,加入几滴 做指示剂,加入足量
做指示剂,加入足量 后,用
后,用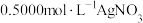 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。
已知:①磷酸银溶于硝酸
②常温下,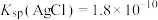 ,
,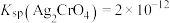
③ 为二元弱酸,具有强还原性。
为二元弱酸,具有强还原性。
(4) 和足量
和足量 溶液完全反应的离子方程式为
溶液完全反应的离子方程式为___________ 。
(5)若滴定完成后使溶液中 浓度为
浓度为 时,则溶液中
时,则溶液中 和
和 浓度之比为
浓度之比为______ 。
(6)产品中 的质量分数为
的质量分数为___________  (保留三位有效数字)。
(保留三位有效数字)。
 常用于有机合成的氯化剂、催化剂,某实验小组在实验室中模拟制备
常用于有机合成的氯化剂、催化剂,某实验小组在实验室中模拟制备 并测定产品的含量。一些物质相关性质如表所示:
并测定产品的含量。一些物质相关性质如表所示:| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 性质 |
 | -112.0 | 76.0 | 137.5 | 无色液体,易水解,易被氧化 |
 | 148 | 160 | 208.5 | 白色或淡黄色晶体,162℃升华,在潮湿空气中易水解 |

Ⅰ.制备
 :
: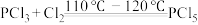
(1)仪器F的名称是
(2)按气流从左往右的方向,上述装置的合理连接顺序为a→d→e→
(3)固体
 为氯化铯型晶体,由具有正四面体结构和正八面体结构的两种离子构成,写出
为氯化铯型晶体,由具有正四面体结构和正八面体结构的两种离子构成,写出 的电离方程式:
的电离方程式:Ⅱ.测定
 产品的含量
产品的含量实验结束后,准确称取4.20克
 产品(含杂质),置于盛有
产品(含杂质),置于盛有 足量氢氧化钠溶液的锥形瓶中至产品完全水解,将水解液配成
足量氢氧化钠溶液的锥形瓶中至产品完全水解,将水解液配成 溶液。取
溶液。取 溶液于锥形瓶中,加入几滴
溶液于锥形瓶中,加入几滴 做指示剂,加入足量
做指示剂,加入足量 后,用
后,用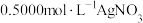 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。已知:①磷酸银溶于硝酸
②常温下,
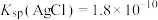 ,
,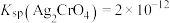
③
 为二元弱酸,具有强还原性。
为二元弱酸,具有强还原性。(4)
 和足量
和足量 溶液完全反应的离子方程式为
溶液完全反应的离子方程式为(5)若滴定完成后使溶液中
 浓度为
浓度为 时,则溶液中
时,则溶液中 和
和 浓度之比为
浓度之比为(6)产品中
 的质量分数为
的质量分数为 (保留三位有效数字)。
(保留三位有效数字)。
您最近一年使用:0次
名校
解题方法
3 .  新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
(1) 的制备。
的制备。
①化学气相沉积法。
Ⅰ.一定温度下,以 气体和
气体和 为原料制备
为原料制备 ,反应的化学方程式是
,反应的化学方程式是___________ 。
Ⅱ.上述反应适宜的温度范围是___________ ℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
②铝粉直接氮化法。
 与
与 可直接化合为
可直接化合为 固体,
固体, 能将
能将 包裹,反应难以继续进行。控制温度,在
包裹,反应难以继续进行。控制温度,在 粉中均匀掺入适量
粉中均匀掺入适量 粉,可使
粉,可使 几乎全部转化为
几乎全部转化为 固体。该过程发生的反应有:
固体。该过程发生的反应有: 、
、___________ 和 。
。
③碳热还原法。
以 、C(石墨)和
、C(石墨)和 为原料,在高温下制备
为原料,在高温下制备 。
。
已知:ⅰ.
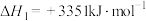
ⅱ.1g石墨与氧气生成一氧化碳,放出9.2 热量
热量
ⅲ.
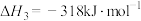
写出反应ⅱ的热化学方程式___________ 。运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:___________ 。
(2) 的性质。
的性质。
 粉末可发生水解。相同条件下,不同粒径的
粉末可发生水解。相同条件下,不同粒径的 粉末水解时溶液
粉末水解时溶液 的变化如图所示。
的变化如图所示。

① 粉末水解的化学方程式是
粉末水解的化学方程式是___________ 。
②解释 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:___________ 。
(3) 含量检测。
含量检测。
向a g 样品中加入足量浓
样品中加入足量浓 溶液,然后通入水蒸气将
溶液,然后通入水蒸气将 全部蒸出,将
全部蒸出,将 用过量的
用过量的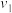



 溶液吸收完全,剩余的
溶液吸收完全,剩余的 用
用



 溶液恰好中和,则样品中
溶液恰好中和,则样品中 的质量分数是
的质量分数是___________ 。
 新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:
新型材料应用前景广泛,其制备与性质研究成为热点。相关数据如下:| 物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 相应化合物分解温度/℃ |
 | 660 | 2467 | 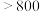 |  : : ( (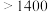 升华) 升华) :( :(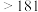 升华) 升华) |
 | 649 | 1090 |  |  : :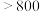 |
 的制备。
的制备。①化学气相沉积法。
Ⅰ.一定温度下,以
 气体和
气体和 为原料制备
为原料制备 ,反应的化学方程式是
,反应的化学方程式是Ⅱ.上述反应适宜的温度范围是
a.75~100 b.600~1100 c.2000~2300
②铝粉直接氮化法。
 与
与 可直接化合为
可直接化合为 固体,
固体, 能将
能将 包裹,反应难以继续进行。控制温度,在
包裹,反应难以继续进行。控制温度,在 粉中均匀掺入适量
粉中均匀掺入适量 粉,可使
粉,可使 几乎全部转化为
几乎全部转化为 固体。该过程发生的反应有:
固体。该过程发生的反应有: 、
、 。
。③碳热还原法。
以
 、C(石墨)和
、C(石墨)和 为原料,在高温下制备
为原料,在高温下制备 。
。已知:ⅰ.

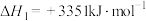
ⅱ.1g石墨与氧气生成一氧化碳,放出9.2
 热量
热量ⅲ.

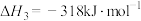
写出反应ⅱ的热化学方程式
(2)
 的性质。
的性质。 粉末可发生水解。相同条件下,不同粒径的
粉末可发生水解。相同条件下,不同粒径的 粉末水解时溶液
粉末水解时溶液 的变化如图所示。
的变化如图所示。
①
 粉末水解的化学方程式是
粉末水解的化学方程式是②解释
 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:(3)
 含量检测。
含量检测。向a g
 样品中加入足量浓
样品中加入足量浓 溶液,然后通入水蒸气将
溶液,然后通入水蒸气将 全部蒸出,将
全部蒸出,将 用过量的
用过量的



 溶液吸收完全,剩余的
溶液吸收完全,剩余的 用
用



 溶液恰好中和,则样品中
溶液恰好中和,则样品中 的质量分数是
的质量分数是
您最近一年使用:0次
名校
解题方法
4 . 高锰酸钾是化学实验中的常用试剂。
Ⅰ.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,回答下面问题:
(1)发生反应的离子方程式为:___________
(2)已知随着反应进行,化学反应速率与时间的关系如图:

时间t1以前反应速率增大的原因是___________
(3)某同学探究“外界条件改变对化学反应速率的影响”进行了如下实验:
①通过A与B,A与C进行对比实验,填写下列数值,T1=___________ ;V3=___________ mL
②某同学在设计“验证反应物浓度对速率影响”的几组平行实验中,保持H2C2O4溶液最终浓度不变,把KMnO4溶液的最终浓度设计为变量,该实验设计是否合理:___________ ,说明原因:___________
Ⅱ.高锰酸钾还常用于亚硝酸盐的测定。欲测定某样品中NaNO2的含量,某同学设计如下实验:
①称取样品a g,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液VmL。
(4)在进行滴定操作时,KMnO4溶液盛装在___________ (填“酸式”或“碱式”)滴定管中。当滴入最后一滴溶液,___________ 时达到滴定终点。测得该样品中NaNO2的质量分数为___________
(5)以下操作造成测定结果偏高的是___________
A.滴定管未用KMnO4标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
Ⅰ.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,回答下面问题:
(1)发生反应的离子方程式为:
(2)已知随着反应进行,化学反应速率与时间的关系如图:

时间t1以前反应速率增大的原因是
(3)某同学探究“外界条件改变对化学反应速率的影响”进行了如下实验:
| 实验序号 | 实验温度/K | 参加反应的物质 | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | ||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | ||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | V3 |
②某同学在设计“验证反应物浓度对速率影响”的几组平行实验中,保持H2C2O4溶液最终浓度不变,把KMnO4溶液的最终浓度设计为变量,该实验设计是否合理:
Ⅱ.高锰酸钾还常用于亚硝酸盐的测定。欲测定某样品中NaNO2的含量,某同学设计如下实验:
①称取样品a g,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液VmL。
(4)在进行滴定操作时,KMnO4溶液盛装在
(5)以下操作造成测定结果偏高的是
A.滴定管未用KMnO4标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
您最近一年使用:0次
名校
5 . 高锰酸钾是化学实验中的常用试剂。
Ⅰ.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”, 回答下面问题:
(1)发生反应的离子方程式为:______ 。
(2)已知随着反应进行试管的温度升高,化学反应速率与时间的关系如图:

时间t1以前反应速率缓慢增大的原因是______ 。
(3)某同学探究“外界条件改变对化学反应速率的影响”进行了如下实验:
①通过A与B,A与C进行对比实验,填写下列数值,T1=_______ K; V3=______ mL。
②该实验配合使用计时器,通过测定______ 所需的时间,来确定不同条件下速率的相对快慢。
③某同学在设计“验证反应物浓度对速率影响”的几组平行实验中,保持H2C2O4溶液最终浓度不变,把KMnO4溶液的最终浓度设计为变量,该实验设计是否合理:______ ,说明原因:______ 。
Ⅱ. 高锰酸钾还常用于亚硝酸盐的测定。欲测定某样品中NaNO2的含量,某同学设计如下实验:
①称取样品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液V mL。
(1)在进行滴定操作时,KMnO4溶液盛装在______ (填“酸式”或“碱式”)滴定管中。当滴入最后一滴溶液,_______ 时达到滴定终点。
(2)滴定过程中发生反应的离子方程式是______ ;测得该样品中NaNO2的质量分数为___________ 。
(3)以下操作造成测定结果偏高的是__________ 。
A.滴定管未用KMnO4标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
Ⅰ.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”, 回答下面问题:
(1)发生反应的离子方程式为:
(2)已知随着反应进行试管的温度升高,化学反应速率与时间的关系如图:

时间t1以前反应速率缓慢增大的原因是
(3)某同学探究“外界条件改变对化学反应速率的影响”进行了如下实验:
| 实验序号 | 实验温度/K | 参加反应的物质 | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | ||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | ||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | V3 |
②该实验配合使用计时器,通过测定
③某同学在设计“验证反应物浓度对速率影响”的几组平行实验中,保持H2C2O4溶液最终浓度不变,把KMnO4溶液的最终浓度设计为变量,该实验设计是否合理:
Ⅱ. 高锰酸钾还常用于亚硝酸盐的测定。欲测定某样品中NaNO2的含量,某同学设计如下实验:
①称取样品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液V mL。
(1)在进行滴定操作时,KMnO4溶液盛装在
(2)滴定过程中发生反应的离子方程式是
(3)以下操作造成测定结果偏高的是
A.滴定管未用KMnO4标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
您最近一年使用:0次
6 . CaO2难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等。
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)=CaO2(s)+2H2O(l);ΔH<0
不同浓度的H2O2对反应生成CaO2产率的影响如下表:
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因:___________ 。
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量。
步骤1:准确称取0.04~0.05g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入30mL蒸馏水和2 mL盐酸(3mol∙L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5mLKI溶液(100g·L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后________ ,用硫代硫酸钠标准溶液继续滴定,________ ,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数。滴定时发生的反应为2Na2S2O3+I2=Na2S4O6+2NaI。
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是___________ 。
(3)加入KI溶液后发生反应的离子方程式为____________ 。
(4)请补充完整实验步骤4中的内容:____________ ;____________ 。
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)=CaO2(s)+2H2O(l);ΔH<0
不同浓度的H2O2对反应生成CaO2产率的影响如下表:
| H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
| CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因:
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量。
步骤1:准确称取0.04~0.05g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入30mL蒸馏水和2 mL盐酸(3mol∙L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5mLKI溶液(100g·L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后
步骤5:平行测定3次,计算试样中CaO2的质量分数。滴定时发生的反应为2Na2S2O3+I2=Na2S4O6+2NaI。
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是
(3)加入KI溶液后发生反应的离子方程式为
(4)请补充完整实验步骤4中的内容:
您最近一年使用:0次
名校
7 . 在生产和生活中,人们关注化学反应进行的快慢和程度,以提高生产效率和调控反应条件。
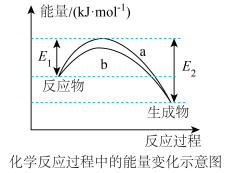
Ⅰ.合成氨的反应对人类解决粮食问题贡献巨大,反应为 。
。
(1)德国化学家F·Haber利用 和
和 在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用
在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用 、
、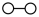 、
、 分别
分别 、
、 、
、 。
。_______ 。
A.氢气燃烧 B.氯化铵与 的反应
的反应
C.锌片与稀硫酸的反应 D.钠与冷水的反应
②下列说法正确的是_______ 。
A.使用催化剂,可以加快合成氨的反应速率
B.②→③过程,是吸热过程且只有H-H键断裂
C.③→④过程,N原子和H原子形成了含有极性键的
D.合成氨反应中,反应物断键吸收能量大于生成物成键释放的能量
(2)一定温度下,向恒容的密闭容器中充入一定量的 和
和 发生反应,测得各组分浓度随时间变化如图所示。
发生反应,测得各组分浓度随时间变化如图所示。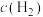 变化的曲线是
变化的曲线是_______ (填“A”“B”或“C”)。
②下列能说明该反应达到平衡状态的是_______ (填序号)。
a.容器中的压强不随时间变化
b.
c.容器中混合气体的密度不随时间变化
d.单位时间内生成3mol 的同时生成2mol
的同时生成2mol
e.容器内 的质量分数不变
的质量分数不变
(3)一定条件下,将2mol 和3mol
和3mol 通入2L的恒容密闭容器中,10min后达到化学平衡,测得
通入2L的恒容密闭容器中,10min后达到化学平衡,测得 的物质的量为2.4mol,则10min内
的物质的量为2.4mol,则10min内 的平均反应速率为
的平均反应速率为_______ , 的转化率是
的转化率是_______ ,混合气中 的物质的量分数是
的物质的量分数是_______ 。
Ⅱ.探究一定条件下反应物浓度对硫代硫酸钠( )与硫酸反应速率的影响。
)与硫酸反应速率的影响。
【查阅资料】
a. 易溶于水,能与硫酸发生反应:
易溶于水,能与硫酸发生反应: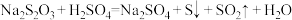
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】
实验数据:
(4)选用浊度计进行测量,原因是 溶液与
溶液与 溶液反应生成了
溶液反应生成了_______ 。
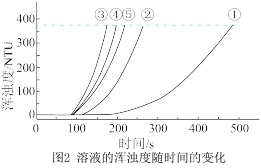
(5)实验③中,x=_______ 。
(6)实验①、②、③的目的是_______ 。
(7)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对 与硫酸反应的化学反应速率的影响,
与硫酸反应的化学反应速率的影响, 溶液浓度的改变影响更大。该推断的证据是
溶液浓度的改变影响更大。该推断的证据是_______ 。
Ⅰ.合成氨的反应对人类解决粮食问题贡献巨大,反应为
 。
。(1)德国化学家F·Haber利用
 和
和 在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用
在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用 、
、 、
、 分别
分别 、
、 、
、 。
。
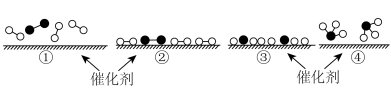
A.氢气燃烧 B.氯化铵与
 的反应
的反应C.锌片与稀硫酸的反应 D.钠与冷水的反应
②下列说法正确的是
A.使用催化剂,可以加快合成氨的反应速率
B.②→③过程,是吸热过程且只有H-H键断裂
C.③→④过程,N原子和H原子形成了含有极性键的

D.合成氨反应中,反应物断键吸收能量大于生成物成键释放的能量
(2)一定温度下,向恒容的密闭容器中充入一定量的
 和
和 发生反应,测得各组分浓度随时间变化如图所示。
发生反应,测得各组分浓度随时间变化如图所示。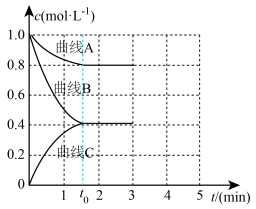
 变化的曲线是
变化的曲线是②下列能说明该反应达到平衡状态的是
a.容器中的压强不随时间变化
b.

c.容器中混合气体的密度不随时间变化
d.单位时间内生成3mol
 的同时生成2mol
的同时生成2mol
e.容器内
 的质量分数不变
的质量分数不变(3)一定条件下,将2mol
 和3mol
和3mol 通入2L的恒容密闭容器中,10min后达到化学平衡,测得
通入2L的恒容密闭容器中,10min后达到化学平衡,测得 的物质的量为2.4mol,则10min内
的物质的量为2.4mol,则10min内 的平均反应速率为
的平均反应速率为 的转化率是
的转化率是 的物质的量分数是
的物质的量分数是Ⅱ.探究一定条件下反应物浓度对硫代硫酸钠(
 )与硫酸反应速率的影响。
)与硫酸反应速率的影响。【查阅资料】
a.
 易溶于水,能与硫酸发生反应:
易溶于水,能与硫酸发生反应: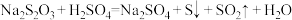
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】
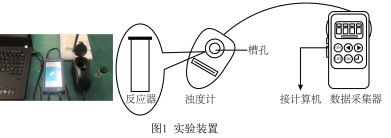
| 实验编号 |  溶液 溶液 |  溶液 溶液 | 蒸馏水 | ||
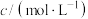 | V/mL | 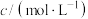 | V/mL | V/mL | |
| ① | 0.1 | 1.5 | 0.1 | 3.5 | 10 |
| ② | 0.1 | 2.5 | 0.1 | 3.5 | 9 |
| ③ | 0.1 | 3.5 | 0.1 | 3.5 | x |
| ④ | 0.1 | 3.5 | 0.1 | 2.5 | 9 |
| ⑤ | 0.1 | 3.5 | 0.1 | 1.5 | 10 |
(4)选用浊度计进行测量,原因是
 溶液与
溶液与 溶液反应生成了
溶液反应生成了(5)实验③中,x=
(6)实验①、②、③的目的是
(7)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对
 与硫酸反应的化学反应速率的影响,
与硫酸反应的化学反应速率的影响, 溶液浓度的改变影响更大。该推断的证据是
溶液浓度的改变影响更大。该推断的证据是
您最近一年使用:0次
2024-04-25更新
|
308次组卷
|
2卷引用:广东省广州市育才中学2023-2024学年高一下学期 期中考试化学试题
8 . 钢渣是钢铁行业的固体废弃物,含有2CaO·SiO2、Fe2O3、FeO、Al2O3和V2O3等物质。一种以钢渣粉为原料固定CO2并制备V2O3的工艺流程如图所示。
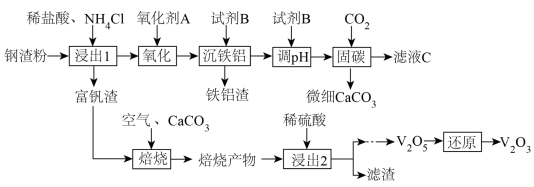
已知钢渣中Ca元素质量分数为30%。V2O3在稀盐酸和NH4Cl混合溶液中不易被浸出。该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH如下表所示:
回答下列问题:
(1)浸出1过程生成的SiO2“包裹”在钢渣表面形成固体膜,阻碍反应物向钢渣扩散。提高浸出率的措施有_______ (除粉碎外,举1例)。该浸出过程不使用稀硫酸代替稀盐酸的原因是_______ 。
(2)为避免引入杂质离子,氧化剂A应为_______ (举1例)。
(3)滤液C的溶质可循环利用,试剂B应为_______ 。
(4)若钢渣粉中含有钒酸钙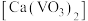 ,加入Na2CO3溶液能够使钒酸钙溶解,是因为存在平衡:
,加入Na2CO3溶液能够使钒酸钙溶解,是因为存在平衡: 。已知
。已知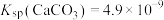 ,
,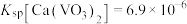 ,则该平衡常数
,则该平衡常数
_______ (结果保留2位有效数字)。
(5)富钒渣焙烧可生成钒钙盐,不同钒钙盐的溶解率随pH变化如图所示。已知浸出2的pH约为2.5,则应控制焙烧条件使该钒钙盐为_______ 。该培烧反应的化学方程式是_______ 。

(6)若Ca的浸出率为90%,理论上1吨钢渣在“固碳”中可固定_______ kgCO2。

已知钢渣中Ca元素质量分数为30%。V2O3在稀盐酸和NH4Cl混合溶液中不易被浸出。该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ca2+ |
| 开始沉淀的pH | 1.9 | 7.2 | 3.5 | 12.4 |
| 沉淀完全的pH | 2.9 | 8.2 | 5.1 | 13.8 |
(1)浸出1过程生成的SiO2“包裹”在钢渣表面形成固体膜,阻碍反应物向钢渣扩散。提高浸出率的措施有
(2)为避免引入杂质离子,氧化剂A应为
(3)滤液C的溶质可循环利用,试剂B应为
(4)若钢渣粉中含有钒酸钙
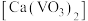 ,加入Na2CO3溶液能够使钒酸钙溶解,是因为存在平衡:
,加入Na2CO3溶液能够使钒酸钙溶解,是因为存在平衡: 。已知
。已知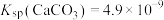 ,
,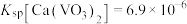 ,则该平衡常数
,则该平衡常数
(5)富钒渣焙烧可生成钒钙盐,不同钒钙盐的溶解率随pH变化如图所示。已知浸出2的pH约为2.5,则应控制焙烧条件使该钒钙盐为

(6)若Ca的浸出率为90%,理论上1吨钢渣在“固碳”中可固定
您最近一年使用:0次
名校
解题方法
9 . 某学习小组在做氢气的制备实验时,用高纯锌粒和稀硫酸为反应物,结果发现反应速率较慢。下列措施不能加快制氢气速率的是
| A.将稀硫酸换成质量分数为98%的浓硫酸 | B.向反应液中加入适量的碳粉 |
| C.改换合适的装置并适当加热 | D.将锌粒换成质量相等的锌粉 |
您最近一年使用:0次
10 . 从富钒废渣( 、
、 、
、 )中回收
)中回收 的工艺过程可表示为
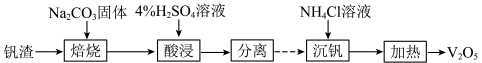
的工艺过程可表示为
(1)“焙烧”所得钠盐的阴离子呈如图(其中钒为+5价)的无限链状结构,写出“焙烧”的化学方程式:___________ 。
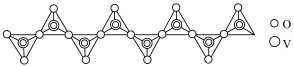
(2)“沉钒”反应是向含有 的溶液中加入
的溶液中加入 溶液,析出
溶液,析出 沉淀。
沉淀。
①写出“沉钒”反应的离子方程式:___________ 。
②已知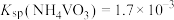 。室温下,测得“分离”后所得溶液中
。室温下,测得“分离”后所得溶液中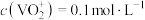 ,为使“沉钒”时钒元素的沉淀率达到99%,应使“沉钒”后的溶液中
,为使“沉钒”时钒元素的沉淀率达到99%,应使“沉钒”后的溶液中 不低于
不低于___________  。
。
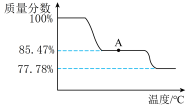
③为研究 受热发生的化学变化,某化学兴趣小组称取一定质量的
受热发生的化学变化,某化学兴趣小组称取一定质量的  在空气中加热,剩余固体质量分数(剩余固体质量/起始质量)随温度变化的曲线如图所示,则点A所得物质的化学式为
在空气中加热,剩余固体质量分数(剩余固体质量/起始质量)随温度变化的曲线如图所示,则点A所得物质的化学式为___________ 。
(3)一定温度下,恒压密闭容器中发生反应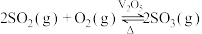 ,
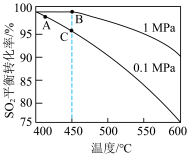
, 反应温度和压强的关系如图所示。实际生产选择图中C点的反应条件,不选择A、B点的理由分别是
反应温度和压强的关系如图所示。实际生产选择图中C点的反应条件,不选择A、B点的理由分别是___________ 。
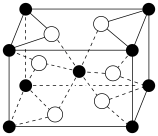
(4)还原V2O5 可以制备VO2 ,VO2的晶胞结构如图,该晶胞中矾的配位数为___________ 。
 、
、 、
、 )中回收
)中回收 的工艺过程可表示为
的工艺过程可表示为
(1)“焙烧”所得钠盐的阴离子呈如图(其中钒为+5价)的无限链状结构,写出“焙烧”的化学方程式:

(2)“沉钒”反应是向含有
 的溶液中加入
的溶液中加入 溶液,析出
溶液,析出 沉淀。
沉淀。①写出“沉钒”反应的离子方程式:
②已知
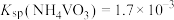 。室温下,测得“分离”后所得溶液中
。室温下,测得“分离”后所得溶液中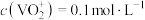 ,为使“沉钒”时钒元素的沉淀率达到99%,应使“沉钒”后的溶液中
,为使“沉钒”时钒元素的沉淀率达到99%,应使“沉钒”后的溶液中 不低于
不低于 。
。③为研究
 受热发生的化学变化,某化学兴趣小组称取一定质量的
受热发生的化学变化,某化学兴趣小组称取一定质量的  在空气中加热,剩余固体质量分数(剩余固体质量/起始质量)随温度变化的曲线如图所示,则点A所得物质的化学式为
在空气中加热,剩余固体质量分数(剩余固体质量/起始质量)随温度变化的曲线如图所示,则点A所得物质的化学式为
(3)一定温度下,恒压密闭容器中发生反应
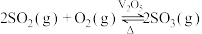 ,
, 反应温度和压强的关系如图所示。实际生产选择图中C点的反应条件,不选择A、B点的理由分别是
反应温度和压强的关系如图所示。实际生产选择图中C点的反应条件,不选择A、B点的理由分别是
(4)还原V2O5 可以制备VO2 ,VO2的晶胞结构如图,该晶胞中矾的配位数为

您最近一年使用:0次



