名校
1 . 碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。
Ⅰ.配制KI溶液
(1)配制500 mL 0.1 mol/L的KI溶液,需要称取KI的质量为_______ g。
(2)下列关于配制KI溶液的操作错误的是_______(填序号)。
Ⅱ.探究不同条件下空气中氧气氧化KI的速率。
(3)酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为_______ 。
(4)通过实验组别1和组别2探究温度对氧化速率的影响其中a=_______ ,b=_______ 。
(5)设计实验组别3的目的是_______ 。
Ⅲ.探究反应“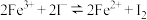 ”为可逆反应。
”为可逆反应。
试剂:0.01 mol/L KI溶液,0.005 mol/LFe2(SO4)3溶液,淀粉溶液,KSCN溶液,0.01 mol/L AgNO3溶液。实验如图:_______ ;乙同学认为该现象无法证明该反应为可逆反应,原因为_______ 。
(7)请选择上述试剂重新设计实验,证明该反应为可逆反应:_______ 。
Ⅰ.配制KI溶液
(1)配制500 mL 0.1 mol/L的KI溶液,需要称取KI的质量为
(2)下列关于配制KI溶液的操作错误的是_______(填序号)。
A. | B. | C. | D. |
Ⅱ.探究不同条件下空气中氧气氧化KI的速率。
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 蒸馏水 | 淀粉溶液 | ||
| c(KI) | c(H2SO4) | V | |||||
| 1 | 298K | 0.1 mol/L | 5mL | 0.1 mol/L | 5 mL | 10 mL | 3滴 |
| 2 | 313K | 0.1 mol/L | a mL | b mol/L | 5 mL | 10 mL | 3滴 |
| 3 | 298K | 0.1 mol/L | 10mL | 0.2 mol/L | 5 mL | 5 mL | 3滴 |
(4)通过实验组别1和组别2探究温度对氧化速率的影响其中a=
(5)设计实验组别3的目的是
Ⅲ.探究反应“
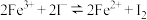 ”为可逆反应。
”为可逆反应。试剂:0.01 mol/L KI溶液,0.005 mol/LFe2(SO4)3溶液,淀粉溶液,KSCN溶液,0.01 mol/L AgNO3溶液。实验如图:
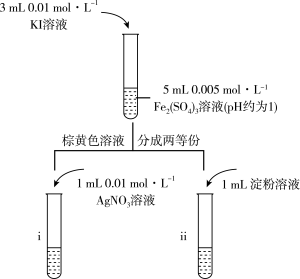
(7)请选择上述试剂重新设计实验,证明该反应为可逆反应:
您最近一年使用:0次
2022-12-05更新
|
184次组卷
|
6卷引用:广东省深圳市光明区2023届高三上学期第一次模拟考试化学试题
广东省深圳市光明区2023届高三上学期第一次模拟考试化学试题广东省珠海市第一中学2022-2023学年高三上学期11月份阶段考试化学试题(已下线)广东省广州市2022届高三一模考试(实验探究题)(已下线)回归教材重难点11 熟记“五气体”制备实验、“两定量”测定实验-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题四川省攀枝花市第十五中学校2023-2024学年高三上学期第5次半月考理科综合试题-高中化学
13-14高三上·江苏泰州·期中
2 . 活性Fe3O4为黑色固体,有磁性,其不溶于水、碱和酒精、乙醚等有机溶剂中, Fe3O4在潮湿的空气中或高温下易被O2氧化。工业上利用锈蚀废铁为原料,利用共沉淀法制备活性Fe3O4(或写为FeO·Fe2O3)的流程如下:
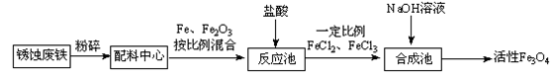
(1)在制备过程中将块状固体原料粉碎磨成粉末,作用是_____________________ 。
(2)设计合理的实验方案证明Fe3O4与盐酸反应的产物中含有Fe2+、Fe3+,简述实验操作步骤和实验现象_____________________________________________________________ 。
(可供选择的试剂:KSCN溶液、还原铁粉、氯水、酸性高锰酸钾溶液)
(3)假如在反应池中几乎没有气体产生,在合成池里所有铁元素转化为Fe3O4,则根据相关反应可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近于______ 。
(4)在一次制备Fe3O4的实验中,由于配料中心反应物比例控制不当,获得了另一种产品FexOy。取一定量该产品溶于足量盐酸中,还需通入标准状况下224 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液滴加足量NaOH溶液,将沉淀过滤、洗涤、蒸干,灼烧至恒重,得8 g固体。计算该产品的化学式______ 。(请写出计算过程)

(1)在制备过程中将块状固体原料粉碎磨成粉末,作用是
(2)设计合理的实验方案证明Fe3O4与盐酸反应的产物中含有Fe2+、Fe3+,简述实验操作步骤和实验现象
(可供选择的试剂:KSCN溶液、还原铁粉、氯水、酸性高锰酸钾溶液)
(3)假如在反应池中几乎没有气体产生,在合成池里所有铁元素转化为Fe3O4,则根据相关反应可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近于
(4)在一次制备Fe3O4的实验中,由于配料中心反应物比例控制不当,获得了另一种产品FexOy。取一定量该产品溶于足量盐酸中,还需通入标准状况下224 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液滴加足量NaOH溶液,将沉淀过滤、洗涤、蒸干,灼烧至恒重,得8 g固体。计算该产品的化学式
您最近一年使用:0次
3 . 丙醛是一种重要的有机原料,在许多领域都有广泛的应用。在铑催化剂作用下,乙烯羰基合成丙醛涉及的反应如下:
主反应Ⅰ.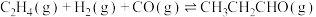

副反应Ⅱ.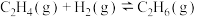

(1)
_____ 0 (填:“>”或“<)。
(2)保持温度不变,在恒容反应器中,按照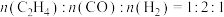 投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时
投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时 的转化率为80%,
的转化率为80%, 的选择性为25%,则
的选择性为25%,则 的转化率为
的转化率为______ %,
_____ kPa/min,反应Ⅰ的
_____  。(用含p的代数式表示,
。(用含p的代数式表示, 的选择性=
的选择性= )。
)。
(3)在装有相同催化剂的。相同恒压容器中,按照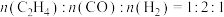 投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下
投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下 的转化率(
的转化率( )如图所示。则B、D两点的平均反应速率v(B)
)如图所示。则B、D两点的平均反应速率v(B)_____ v(D)(填“>”、“=”、“<”),产生这一结果的原因可能是______ 。
(4)T℃时,向恒温恒容的甲容器中,通入1mol 、1mol CO和2mol
、1mol CO和2mol  ;向绝热恒容的乙容器中通入1mol
;向绝热恒容的乙容器中通入1mol  、1mol CO、2mol
、1mol CO、2mol  ,若只发生上述反应Ⅰ。则甲乙容器中
,若只发生上述反应Ⅰ。则甲乙容器中 的平衡转化率
的平衡转化率
____  (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是_____ 。
主反应Ⅰ.
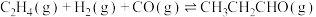

副反应Ⅱ.
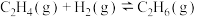


(1)

(2)保持温度不变,在恒容反应器中,按照
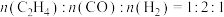 投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时
投料,发生反应Ⅰ和Ⅱ,初始压强为4p kPa,反应t min达到平衡,平衡时 的转化率为80%,
的转化率为80%, 的选择性为25%,则
的选择性为25%,则 的转化率为
的转化率为

 。(用含p的代数式表示,
。(用含p的代数式表示, 的选择性=
的选择性= )。
)。(3)在装有相同催化剂的。相同恒压容器中,按照
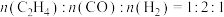 投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下
投料,发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下 的转化率(
的转化率( )如图所示。则B、D两点的平均反应速率v(B)
)如图所示。则B、D两点的平均反应速率v(B)(4)T℃时,向恒温恒容的甲容器中,通入1mol
 、1mol CO和2mol
、1mol CO和2mol  ;向绝热恒容的乙容器中通入1mol
;向绝热恒容的乙容器中通入1mol  、1mol CO、2mol
、1mol CO、2mol  ,若只发生上述反应Ⅰ。则甲乙容器中
,若只发生上述反应Ⅰ。则甲乙容器中 的平衡转化率
的平衡转化率
 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是
您最近一年使用:0次
解题方法
4 . 某研究小组为比较铝和铁的金属性强弱,设计了如下图所示装置。

(1)实验时除要保证甲中温度和浸入液面下金属板的表面积相同,稀硫酸足量外,_______ 也应该相同。
(2)甲中反应的能量变化可用下图的_______ (填“A”或“B”)表示。

(3)实验测得产生气体的速率与时间的关系如图所示:

则t1~t2时间内速率逐渐增大的主要影响因素是_______ (填字母),t2~t3时间内速率逐渐减小的主要影响因素是_______ (填字母)。
A.温度 B.浓度 C.压强
(4)已知甲中盛有20mL1mol/L的稀硫酸(假设反应前后稀硫酸体积不变),当铝片插入溶液中2min后,测得量筒内收集到的水折合成标准状况下H2的体积为224mL,则该时间段内反应速率v(H2SO4)=___ mol·L-1·min-1。

(1)实验时除要保证甲中温度和浸入液面下金属板的表面积相同,稀硫酸足量外,
(2)甲中反应的能量变化可用下图的

(3)实验测得产生气体的速率与时间的关系如图所示:

则t1~t2时间内速率逐渐增大的主要影响因素是
A.温度 B.浓度 C.压强
(4)已知甲中盛有20mL1mol/L的稀硫酸(假设反应前后稀硫酸体积不变),当铝片插入溶液中2min后,测得量筒内收集到的水折合成标准状况下H2的体积为224mL,则该时间段内反应速率v(H2SO4)=
您最近一年使用:0次
解题方法
5 . 研究氮氧化物的性质具有重要的意义。
(1)NO可以催化 与
与 的反应:
的反应:
反应Ⅰ.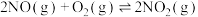
 kJ/mol
kJ/mol
反应Ⅱ.
 kJ/mol
kJ/mol
①下列说法正确的是:_____ 。
A.高温下有利于反应I的自发进行
B.反应Ⅱ的 对该反应的自发性影响不大
对该反应的自发性影响不大
C.恒温恒容下加入一定量 与
与 ,若容器内压强没有明显变化,说明不加催化剂时,
,若容器内压强没有明显变化,说明不加催化剂时, 与
与 的反应不能自发进行
的反应不能自发进行
D.NO催化下,一定量 与
与 反应一段时间后,升高温度,
反应一段时间后,升高温度, 的体积分数可能变大
的体积分数可能变大
②据报道,瑞典某工厂利用上述反应制取硫酸。在合成 时,向反应容器中适时通入冷激气(冷的原料气),其作用是
时,向反应容器中适时通入冷激气(冷的原料气),其作用是_____ 。
(2)密闭容器中加入一定量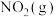 和
和 ,发生反应Ⅱ(忽略其它反应)。保持常压条件,经过相同时间,测得
,发生反应Ⅱ(忽略其它反应)。保持常压条件,经过相同时间,测得 的体积分数随温度的变化如图所示:
的体积分数随温度的变化如图所示:
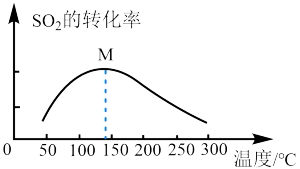
①由图可知,在M点之前,反应中 的体积分数随温度升高而减小,其原因为:
的体积分数随温度升高而减小,其原因为:_____ 。
②250℃和常压下,等物质的量的 和
和 反应后,测得平衡时NO的物质的量分数为40%,则该反应的物质的量分数平
反应后,测得平衡时NO的物质的量分数为40%,则该反应的物质的量分数平 的转化率平衡常数
的转化率平衡常数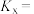
_____ 。( 是用平衡时物质的量分数代替平衡浓度计算)保持上述条件不变,提高原料中
是用平衡时物质的量分数代替平衡浓度计算)保持上述条件不变,提高原料中 的比例,使平衡时
的比例,使平衡时 的产率为90%。则
的产率为90%。则 和
和 的投料比(即起始时加入的物质的量之比)为
的投料比(即起始时加入的物质的量之比)为_____ 。
(3)在一定温度下,一定量 分解成氮气和氧气,同时释放出热量。分解的部分实验数据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:_____。
分解成氮气和氧气,同时释放出热量。分解的部分实验数据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:_____。
(4)以固体催化剂催化CO还原NO生成 和
和 气体,反应历程如下(*表示吸附态),
气体,反应历程如下(*表示吸附态),
请补充完整。
化学吸附: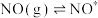 ;
;
表面反应: ;
;_____ :
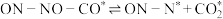 ;
;_____ 。
脱附: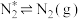 ;
;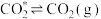
(1)NO可以催化
 与
与 的反应:
的反应:反应Ⅰ.
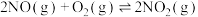
 kJ/mol
kJ/mol反应Ⅱ.

 kJ/mol
kJ/mol①下列说法正确的是:
A.高温下有利于反应I的自发进行
B.反应Ⅱ的
 对该反应的自发性影响不大
对该反应的自发性影响不大C.恒温恒容下加入一定量
 与
与 ,若容器内压强没有明显变化,说明不加催化剂时,
,若容器内压强没有明显变化,说明不加催化剂时, 与
与 的反应不能自发进行
的反应不能自发进行D.NO催化下,一定量
 与
与 反应一段时间后,升高温度,
反应一段时间后,升高温度, 的体积分数可能变大
的体积分数可能变大②据报道,瑞典某工厂利用上述反应制取硫酸。在合成
 时,向反应容器中适时通入冷激气(冷的原料气),其作用是
时,向反应容器中适时通入冷激气(冷的原料气),其作用是(2)密闭容器中加入一定量
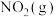 和
和 ,发生反应Ⅱ(忽略其它反应)。保持常压条件,经过相同时间,测得
,发生反应Ⅱ(忽略其它反应)。保持常压条件,经过相同时间,测得 的体积分数随温度的变化如图所示:
的体积分数随温度的变化如图所示:
①由图可知,在M点之前,反应中
 的体积分数随温度升高而减小,其原因为:
的体积分数随温度升高而减小,其原因为:②250℃和常压下,等物质的量的
 和
和 反应后,测得平衡时NO的物质的量分数为40%,则该反应的物质的量分数平
反应后,测得平衡时NO的物质的量分数为40%,则该反应的物质的量分数平 的转化率平衡常数
的转化率平衡常数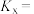
 是用平衡时物质的量分数代替平衡浓度计算)保持上述条件不变,提高原料中
是用平衡时物质的量分数代替平衡浓度计算)保持上述条件不变,提高原料中 的比例,使平衡时
的比例,使平衡时 的产率为90%。则
的产率为90%。则 和
和 的投料比(即起始时加入的物质的量之比)为
的投料比(即起始时加入的物质的量之比)为(3)在一定温度下,一定量
 分解成氮气和氧气,同时释放出热量。分解的部分实验数据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:_____。
分解成氮气和氧气,同时释放出热量。分解的部分实验数据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:_____。| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
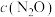 /mol·L /mol·L | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
A.增大压强, 分解速率增大 分解速率增大 |
B.增大容器的体积,该分解反应平衡右移,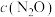 变小 变小 |
C.减小 的浓度,该分解反应速率减小 的浓度,该分解反应速率减小 |
| D.升高温度,容器内气体的压强一定变大 |
(4)以固体催化剂催化CO还原NO生成
 和
和 气体,反应历程如下(*表示吸附态),
气体,反应历程如下(*表示吸附态),请补充完整。
化学吸附:
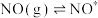 ;
;表面反应:
 ;
;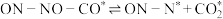 ;
;脱附:
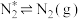 ;
;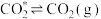
您最近一年使用:0次
解题方法
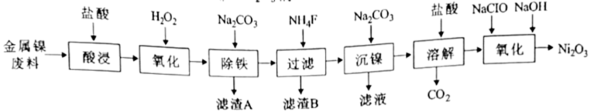
6 . 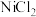 是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产
是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产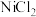 ,继而生产
,继而生产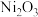 的工艺流程如下:
的工艺流程如下:
已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
②当溶液中某离子浓度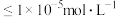 ,可认为该离子已完全沉淀;
,可认为该离子已完全沉淀;
(1)“酸浸”时,需将金属镍废料粉碎的目的是________________ ;
(2)“除铁”过程中,应调节溶液pH的范围为_____________ ;
(3)滤渣B的主要成分是氟化钙和氟化镁,写出生成氟化钙的化学反应方程式___________ ;
(4)在“沉镍”操作中,若溶液中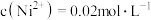 ,向其中加入等体积的
,向其中加入等体积的 溶液,使
溶液,使 沉淀完全,则所加
沉淀完全,则所加 溶液的浓度最小为
溶液的浓度最小为____________ (已知: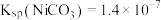 );
);
(5)“氧化”生成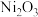 的离子方程式为
的离子方程式为_______________ ;
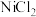 是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产
是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产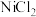 ,继而生产
,继而生产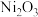 的工艺流程如下:
的工艺流程如下:
已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
氢氧化物 |
|
|
|
开始沉淀的pH | 1.1 | 6.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 9.2 |
②当溶液中某离子浓度
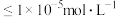 ,可认为该离子已完全沉淀;
,可认为该离子已完全沉淀;(1)“酸浸”时,需将金属镍废料粉碎的目的是
(2)“除铁”过程中,应调节溶液pH的范围为
(3)滤渣B的主要成分是氟化钙和氟化镁,写出生成氟化钙的化学反应方程式
(4)在“沉镍”操作中,若溶液中
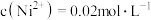 ,向其中加入等体积的
,向其中加入等体积的 溶液,使
溶液,使 沉淀完全,则所加
沉淀完全,则所加 溶液的浓度最小为
溶液的浓度最小为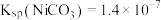 );
);(5)“氧化”生成
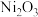 的离子方程式为
的离子方程式为
您最近一年使用:0次
名校
解题方法
7 . 低碳经济是指在可持续发展理念指导下,尽可能地减少煤炭、石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态。下列是有关碳元素的相关转化,回答下列问题:
(1)已知甲醇是一种清洁燃料,制备甲醇是煤液化的重要方向。若已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为∆H=-285.8kJ/mol、△H=-283.0kJ/mol、△H=-726.5kJ/mol,CO(g)+2H2(g) CH3OH(l)△H=
CH3OH(l)△H=________ kJ/mol。
(2)一定温度下,一定可以提高甲醇合成速率的措施有( )
a.增大起始通入 值
值
b.恒温恒容,再通入氦气
c.使用新型的高效正催化剂
d.将产生的甲醇及时移走
e.压缩体积,增大压强
(3)在恒温恒容条件下,下列说法可以判定反应CO(g)+2H2(g) CH3OH(g)已经达到平衡状态的是
CH3OH(g)已经达到平衡状态的是( )
a.体系中碳氢单键数目不再改变
b.体系中n(CO):n(H2)不再改变
c.体系中压强或者平均摩尔质量不再改变
d.单位时间内消耗氢气和CH3OH的物质的量相等
(4)在恒压的容器中,曲线X、Y、Z分别表示在T1°C、T2°C和T3°C三种温度下合成甲醇气体的过程。控制不同的原料投料比,CO的平衡转化率如图所示:
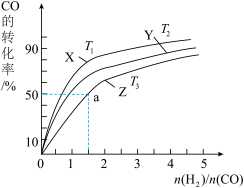
①温度T1°C、T2°C和T3°C由高到低的顺序为:_________________ ;
②若温度为T3°C时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=1.5,则平衡时CO和CH3OH的分压之比为__________ ,该反应的压强平衡常数Kp的计算式为__________ 。(Kp生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压强×该物质的物质的量分数)。
(1)已知甲醇是一种清洁燃料,制备甲醇是煤液化的重要方向。若已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为∆H=-285.8kJ/mol、△H=-283.0kJ/mol、△H=-726.5kJ/mol,CO(g)+2H2(g)
 CH3OH(l)△H=
CH3OH(l)△H=(2)一定温度下,一定可以提高甲醇合成速率的措施有
a.增大起始通入
 值
值b.恒温恒容,再通入氦气
c.使用新型的高效正催化剂
d.将产生的甲醇及时移走
e.压缩体积,增大压强
(3)在恒温恒容条件下,下列说法可以判定反应CO(g)+2H2(g)
 CH3OH(g)已经达到平衡状态的是
CH3OH(g)已经达到平衡状态的是a.体系中碳氢单键数目不再改变
b.体系中n(CO):n(H2)不再改变
c.体系中压强或者平均摩尔质量不再改变
d.单位时间内消耗氢气和CH3OH的物质的量相等
(4)在恒压的容器中,曲线X、Y、Z分别表示在T1°C、T2°C和T3°C三种温度下合成甲醇气体的过程。控制不同的原料投料比,CO的平衡转化率如图所示:

①温度T1°C、T2°C和T3°C由高到低的顺序为:
②若温度为T3°C时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=1.5,则平衡时CO和CH3OH的分压之比为
您最近一年使用:0次






