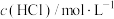真题
解题方法
1 . 室温下,为探究纳米铁去除水样中 的影响因素,测得不同条件下
的影响因素,测得不同条件下 浓度随时间变化关系如下图。
浓度随时间变化关系如下图。
下列说法正确的是
 的影响因素,测得不同条件下
的影响因素,测得不同条件下 浓度随时间变化关系如下图。
浓度随时间变化关系如下图。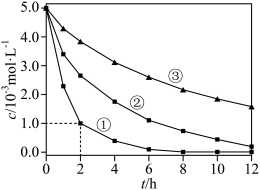
| 实验序号 | 水样体积/ | 纳米铁质量/ | 水样初始 |
| ① | 50 | 8 | 6 |
| ② | 50 | 2 | 6 |
| ③ | 50 | 2 | 8 |
A.实验①中,0~2小时内平均反应速率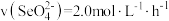 |
B.实验③中,反应的离子方程式为: |
| C.其他条件相同时,适当增加纳米铁质量可加快反应速率 |
D.其他条件相同时,水样初始 越小, 越小, 的去除效果越好 的去除效果越好 |
您最近一年使用:0次
解题方法
2 . NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:___________ 。
(2)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:___________ 。
(3)用NaOH溶液吸收,主要反应为NO+NO2+2OH−=2NO +H2O 、2NO2+2OH−=NO
+H2O 、2NO2+2OH−=NO +NO
+NO +H2O。吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
+H2O。吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是___________ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(4)用NaClO溶液吸收。其他条件同,NO转化为NO 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图-1所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图-1所示。 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___________ 。
(5)在有氧条件下,新型催化剂M能催化NH3与NOx生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图-2)。反应相同时间,NOx的去除率随反应温度的变化曲线如图-3所示,在50~250 ℃内随温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是___________ ;当反应温度高于380 ℃时,NOx转化率下降,除因为催化剂活性下降、进入反应器的NOx被还原的量减少外,还有___________ (用化学方程式表示)。
(1)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
(2)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:
(3)用NaOH溶液吸收,主要反应为NO+NO2+2OH−=2NO
 +H2O 、2NO2+2OH−=NO
+H2O 、2NO2+2OH−=NO +NO
+NO +H2O。吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
+H2O。吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是(4)用NaClO溶液吸收。其他条件同,NO转化为NO
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图-1所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图-1所示。
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
(5)在有氧条件下,新型催化剂M能催化NH3与NOx生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图-2)。反应相同时间,NOx的去除率随反应温度的变化曲线如图-3所示,在50~250 ℃内随温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是

您最近一年使用:0次
3 . 以金红石(主要成分为 )为原料制备
)为原料制备 的主要过程如下:
的主要过程如下: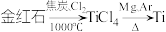 。下列叙述错误的是
。下列叙述错误的是
 )为原料制备
)为原料制备 的主要过程如下:
的主要过程如下: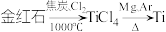 。下列叙述错误的是
。下列叙述错误的是A.利用碳氯化工艺制备 的化学方程式为 的化学方程式为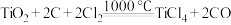 |
B.粗 提纯过程中,具体操作步骤有用水溶解、结晶、过滤等 提纯过程中,具体操作步骤有用水溶解、结晶、过滤等 |
C.制备Ti的主要过程中的 用 用 代替,会影响 代替,会影响 的产率和纯度 的产率和纯度 |
| D.将金红石和焦炭充分混合研磨后,再通入氯气可以提高反应速率 |
您最近一年使用:0次
名校
解题方法
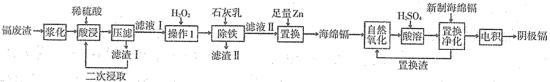
4 . 镉(Cd)是炼锌业的副产品,主要用在电池、染料稳定剂,同时也是重要的污染源,回收再利用以减少排放是重要课题。某冶炼厂的镉废渣中主要含有Cd、CdO,还含有Cu、Zn、Pb、Fe、CuO和SiO2等杂质,从镉废渣中回收镉的一种工艺流程如图所示。
②溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)将废渣先“浆化”再“酸浸”的目的是___________ 。
(2)“压滤”所得滤渣I的主要成分是___________ (填化学式);“酸浸”后滤液中还含有微量的Pb2+,其微量存在的主要原因是___________ 。
(3)“除铁”时,加入的石灰乳调节溶液pH的范围是___________ ,若石灰乳加过量,缺陷是___________ 。
(4)将“置换”出来的海绵镉在空气中堆放反复搅拌进行“自然氧化”,再用硫酸进行“酸溶”,“置换净化”处理是将残余的微量的Cu2+和Pb2+进行深度脱除,以提高阴极镉产品的纯度,写出“置换净化”除Pb2+的离子反应方程式___________ 。
(5)电极电位是表示某种离子或原子在溶液中得失电子的难易程度。在25℃下,部分电对的电极电位如表所示。
根据表中信息和已有知识可知,采用低电流条件“电积”时,阴极主要得到的是镉不是锌的原因___________ 。

②溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 离子 |  |  |  |  |  |  |
开始沉淀时( ) ) | 8.2 | 7.8 | 7.5 | 6.7 | 5.2 | 2.2 |
完全沉淀时( ) ) | 9.7 | 9.3 | 9.0 | 8.5 | 6.7 | 3.2 |
(1)将废渣先“浆化”再“酸浸”的目的是
(2)“压滤”所得滤渣I的主要成分是
(3)“除铁”时,加入的石灰乳调节溶液pH的范围是
(4)将“置换”出来的海绵镉在空气中堆放反复搅拌进行“自然氧化”,再用硫酸进行“酸溶”,“置换净化”处理是将残余的微量的Cu2+和Pb2+进行深度脱除,以提高阴极镉产品的纯度,写出“置换净化”除Pb2+的离子反应方程式
(5)电极电位是表示某种离子或原子在溶液中得失电子的难易程度。在25℃下,部分电对的电极电位如表所示。
| 电对 |  | 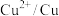 | 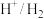 | 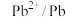 |
| 电极电位/V |  | 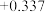 | 0 | 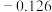 |
| 电对 | 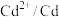 | 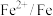 | 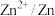 | 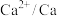 |
| 电极电位/V | 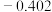 |  | 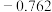 | 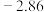 |
您最近一年使用:0次
2024-05-30更新
|
330次组卷
|
4卷引用:2024届辽宁省部分学校高三下学期联考三模化学试题
名校
5 . 探究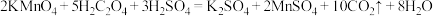 反应速率的影响因素,有关实验数据如下表所示:
反应速率的影响因素,有关实验数据如下表所示:
下列说法不正确的是
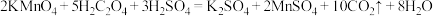 反应速率的影响因素,有关实验数据如下表所示:
反应速率的影响因素,有关实验数据如下表所示:| 编号 | 温度/℃ | 酸性 溶液 溶液 |  溶液 溶液 |  的体积 的体积(mL) |  溶液褪色平均时间/min 溶液褪色平均时间/min | ||
| 体积/mL | 浓度/( ) ) | 体积/mL | 浓度/( ) ) | ||||
| 1 | 25 | 4 | 0.1 | 8 | 0.2 | 8 | 12 |
| 2 | 80 | 2 | 0.1 | 8 | 0.2 | a | b |
| 3 | 25 | 2 | 0.1 | 8 | 0.2 | 10 | c |
| A.a=10,b<c,6<c<12 |
B.可通过比较收集相同体积的 所消耗的时间来判断反应速率的快慢 所消耗的时间来判断反应速率的快慢 |
C.用 表示该反应速率,v(实验1)为 表示该反应速率,v(实验1)为 |
D.实验时可依次向试管中加入酸性 溶液、 溶液、 溶液和水 溶液和水 |
您最近一年使用:0次
6 . 室温下,将 、
、 、KI、
、KI、 溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A:
溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A: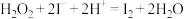 ;反应B:……;总反应为:
;反应B:……;总反应为: 。
。
回答下列问题:
(1)反应B的离子方程式是______ 。 的作用为
的作用为______ 。
(2)小组同学探究溶液颜色第一次变蓝快慢的影响因素,进行下列反应。
①实验Ⅰ中,若2s时 的浓度变为
的浓度变为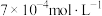 ,则0~2s时
,则0~2s时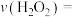
______ 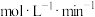
②为探究不同pH对溶液颜色第一次变蓝快慢的影响因素,进行实验Ⅰ和Ⅱ,则
______ ;实验Ⅲ和实验Ⅳ对照实验的目的为______ ;若探究温度对溶液颜色第一次变蓝快慢的影响因素,可选择实验______ 和实验______ (填写“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
 、
、 、KI、
、KI、 溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A:
溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A: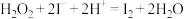 ;反应B:……;总反应为:
;反应B:……;总反应为: 。
。回答下列问题:
(1)反应B的离子方程式是
 的作用为
的作用为(2)小组同学探究溶液颜色第一次变蓝快慢的影响因素,进行下列反应。
试剂用量(mL) 序号 | 温度 | 0.01 | 0.01 | 0.01 | 0.01 |
|
Ⅰ | 25℃ | 5 | 4 | 8 | 3 | 0 |
Ⅱ | 25℃ | 5 | 2 | x | y | z |
Ⅲ | 35℃ | 5 | 4 | 8 | 3 | 0 |
Ⅳ | 35℃ | 3 | 4 | 8 | 3 | 2 |
 的浓度变为
的浓度变为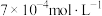 ,则0~2s时
,则0~2s时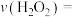
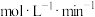
②为探究不同pH对溶液颜色第一次变蓝快慢的影响因素,进行实验Ⅰ和Ⅱ,则

您最近一年使用:0次
2024-05-28更新
|
72次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
解题方法
7 . 工业合成氨的反应如下: 。某温度下,在容积恒定为2.0L的密闭容器中充入
。某温度下,在容积恒定为2.0L的密闭容器中充入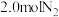 和
和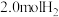 ,一段时间后反应达平衡状态,实验数据如下表所示:
,一段时间后反应达平衡状态,实验数据如下表所示:
(1)0~50s内的平均反应速率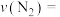
___________ 。
(2)150s时, 的转化率为
的转化率为___________ 。
(3)反应达最大限度时 的体积分数为
的体积分数为___________ %(保留三位有效数字)。
(4)已知N≡N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成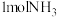 过程中的热量变化
过程中的热量变化___________ 。
(5)为加快反应速率,可以采取的措施___________ 。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离 f.使用适合催化剂
f.使用适合催化剂
(6)下列说法错误的是___________。
 。某温度下,在容积恒定为2.0L的密闭容器中充入
。某温度下,在容积恒定为2.0L的密闭容器中充入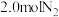 和
和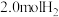 ,一段时间后反应达平衡状态,实验数据如下表所示:
,一段时间后反应达平衡状态,实验数据如下表所示:| t/s | 0 | 50 | 150 | 250 | 350 |
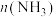 | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50s内的平均反应速率
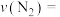
(2)150s时,
 的转化率为
的转化率为(3)反应达最大限度时
 的体积分数为
的体积分数为(4)已知N≡N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成
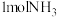 过程中的热量变化
过程中的热量变化(5)为加快反应速率,可以采取的措施
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离
 f.使用适合催化剂
f.使用适合催化剂(6)下列说法错误的是___________。
| A.使用催化剂是为了加快反应速率,提高生产效率 |
B.上述条件下, 不可能100%转化为 不可能100%转化为 |
C.为了提高 的转化率,应适当提高 的转化率,应适当提高 的浓度 的浓度 |
| D.250~350s生成物浓度保持不变,反应停止 |
您最近一年使用:0次
名校
解题方法
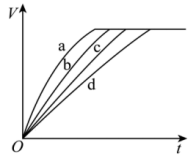
8 . 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定反应过程中产生氢气体积V的数据如图所示,下列说法正确的是
实验组别 |
| 温度/℃ | 形((Fe) |
Ⅰ | 2.0 | 30 | 块状 |
Ⅱ | 2.5 | 30 | 块状 |
Ⅲ | 2.5 | 50 | 粉末状 |
Ⅳ | 2.5 | 50 | 块状 |
A.该反应的离子方程式为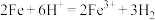 |
| B.对比实验Ⅰ、Ⅱ可探究浓度对化学反应速率的影响 |
| C.对比实验Ⅱ、Ⅲ可探究温度对化学反应速率的影响 |
| D.曲线a、b、c、d对应的实验组别分别为Ⅳ、Ⅲ、Ⅱ、Ⅰ |
您最近一年使用:0次
名校
9 . 在锌与某浓度的稀盐酸(足量)反应的实验中,得到如下结果:
下列说法中正确的是
① ②
② 和
和 均小于200 ③实验2和实验3比较,单位时间内消耗的锌的质量
均小于200 ③实验2和实验3比较,单位时间内消耗的锌的质量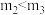 ④若锌均未完全反应,则在相同时间内,产生
④若锌均未完全反应,则在相同时间内,产生 的体积
的体积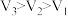
| 序号 | 锌的质量/g | 锌的形式 | 温度/℃ | 锌完全反应所需时间/s | 产生 的体积 的体积 |
| 1 | 2 | 薄片 | 15 | 200 |  |
| 2 | 2 | 粉末 | 15 |  |  |
| 3 | 2 | 粉末 | 35 |  |  |
①
 ②
② 和
和 均小于200 ③实验2和实验3比较,单位时间内消耗的锌的质量
均小于200 ③实验2和实验3比较,单位时间内消耗的锌的质量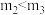 ④若锌均未完全反应,则在相同时间内,产生
④若锌均未完全反应,则在相同时间内,产生 的体积
的体积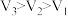
| A.①② | B.①②③ | C.②③④ | D.①②③④ |
您最近一年使用:0次
名校
解题方法
10 . 下列事实或做法与化学反应速率无关的是
| A.加热金属钠制备过氧化钠 | B.用铁触媒作催化剂合成氨 |
| C.将煤块粉碎后燃烧 | D.将食物存放在温度低的地方 |
您最近一年使用:0次